Введение
Рак поджелудочной железы (РПЖ) – двенадцатое по частоте развития злокачественное заболевание человека, характеризующееся крайне негативным прогнозом и высоким уровнем смертности [1, 2]. В 2012 г. было зарегистрировано около 338 тыс. новых случаев РПЖ [1]. Заболеваемость данной онкологической патологией варьируется от 1 до 10 случаев на 100 тыс. населения [1]. Несмотря на достаточно скромную распространенность по сравнению с другими неоплазиями, РПЖ занимает 4-е место в структуре смертности от злокачественных заболеваний в США и 5-е – в Великобритании [2, 3].
Согласно современным данным, 5-летняя выживаемость пациентов с локализованным РПЖ (I и IIA стадий) составляет 25% и прогрессивно снижается при распространенных и метастатических формах, составляя 9,9% при IIB и III стадиях и 2,3% при IV стадии [4]. При этом лишь 9% случаев РПЖ диагностируются на ранних стадиях, в то время как у 27 и 53% пациентов на момент постановки диагноза уже имеются региональные и отдаленные метастазы [4]. Таким образом, общая 5-летняя выживаемость находится в диапазоне от 6 до 10%, что делает РПЖ одним из самых летальных типов неоплазий. При этом около 70% смертей ассоциированы с отдаленным метастатическим поражением органов и систем, в то время как остальные летальные случаи связаны с обширными первичными опухолями [2, 4]. В целом на момент постановки диагноза лишь у 10–20% пациентов с РПЖ возможно проведение радикальной резекции, в остальных (нерезектабельных) случаях основой тактикой лечения являются паллиативные методики [2, 5, 6].
Внешнесекреторная недостаточность поджелу-дочной железы при РПЖ
Внешнесекреторная недостаточность поджелудочной железы (ВНПЖ) является частым осложнением как доброкачественных, так и злокачественных заболеваний поджелудочной железы, а также следствием радикальных хирургических операций [7, 8]. Основные клинические маркеры ВНПЖ [7, 9]:
- «жирный стул» (стеаторея);
- потеря веса;
- кусочки непереваренной пищи в стуле (лиенторея);
- увеличение суточного объема фекалий (полифекалия) в отсутствие сокращения объема рациона;
- стойкая диарея в отсутствие других видимых причин;
- стойкий метеоризм, особенно через 1–2 часа после приема пищи;
- сахарный диабет, вероятно связанный с текущим процессом.
Развитие ВНПЖ при РПЖ может детерминироваться различными механизмами, включая блок главного панкреатического протока и деструкцию экзокринной части органа (вследствие опухолевой инвазии), а также опосредоваться хирургическими вмешательствами (табл. 1) [10, 11]. Впервые наличие ВНПЖ у пациентов с РПЖ было продемонстрировано в исследовании I. Ihse и соавт., где на небольшой выборке пациентов при использовании теста Лунда (аспирационный метод исследования дуоденального содержимого с помощью зонда) было показано, что ВНПЖ наблюдается у 80–90% больных РПЖ [12].
Проведенные к настоящему времени исследования демонстрируют, что частота ВНПЖ у пациентов с резектабельным РПЖ составляет 46–100% [10, 13–15]. При этом частота данного синдрома у этой когорты пациентов лишь возрастает до 70–100% после оперативного лечения вне зависимости от объема хирургического вмешательства [10, 13, 14]. У пациентов с неоперабельным РПЖ частота выявления ВНПЖ составляет 50–100% [10, 16]. В одной из последних проспективных работ E.C. Sikkens и соавт. на основании анализа фекальной эластазы-1 было показано, что 67% пациентов с РПЖ на момент постановки диагноза имели ВНПЖ, при этом после 2-месячного наблюдения этот показатель возрос до 89% [17].

Как известно, прогрессирующая потеря массы тела и кахексия являются общими клиническими проявлениями для всех типов злокачественных заболеваний. Однако при РПЖ генез этих состояний обусловлен сочетанием механизмов ускоренного катаболизма в тканях и синдрома мальабсорбции вследствие ВНПЖ [18]. Впервые каузативная роль мальабсорбции в потере массы тела у пациентов с РПЖ была показана специалистами клиники Мейо в 1983 г. В небольшом проспективном исследовании, используя триолеиновый дыхательный тест для определения мальабсорбции, было продемонстрировано, что терапия панкреатином способствует коррекции как проявлений этого синдрома, так и снижения массы тела [16]. Динамика потери массы тела является независимым неблагоприятным фактором, определяющим показатель выживаемости у пациентов с злокачественными заболеваниями [19]. Поэтому коррекция ВНПЖ может рассматриваться как обязательный компонент паллиативной терапии пациентов с РПЖ.
Заместительная ферментная терапия препаратами панкреатина при РПЖ
Заместительная ферментная терапия (ЗФТ) панкреатическими ферментами в большинстве случаев может уменьшать выраженность симптомов ВНПЖ, ассоциированных с РПЖ, позволяет пациентам расширять рацион питания, улучшает их нутритивный статус и качество жизни [18]. Тем не менее, несмотря на свою доступность, ЗФТ в рамках паллиативного ведения пациентов c РПЖ применяется весьма ограниченно. Так, согласно современным ретроспективным данным из Австралии и Новой Зеландии, лишь 21% пациентов с распространенным РПЖ получают ЗФТ. При этом симптомы мальабсорбции, ассоциированные с ВНПЖ, выявляются у 70% больных [20]. Во многом это объясняется низкой информированностью врачей и пациентов о необходимости ЗФТ, а также отсутствием четких алгоритмов назначения и контроля эффективности лечения [21].
Эффективность ЗФТ у пациентов с неоперабельным РПЖ была продемонстрирована в рандомизированном плацебо-контролируемом исследовании. Так, после 4 недель терапии было отмечено, что у пациентов, получавших ЗФТ, наблюдалась динамика восстановления массы тела (на 1,2%), в то время как у пациентов в группе плацебо имела место обратная тенденция (потеря массы тела на 3,7%) [22]. В недавнем ретроспективном исследовании было показано, что медиана выживаемости больных неоперабельным РПЖ пролонгируется при сочетании стандартной паллиативной терапии и ЗФТ по сравнению с паллиативными методиками, используемыми отдельно (301 против 89 дней) [23]. В другом рандомизированном плацебо-контролируемом исследовании на когорте из 58 пациентов с выраженной ВНПЖ, перенесших оперативное вмешательство, было показано достоверное повышение показателей коэффициента абсорбции жира с 54,8 до 69,4% у больных, получавших ЗФТ (при отдельном анализе когорты больных, перенесших оперативное вмешательство по поводу РПЖ), тогда как в группе плацебо данный показатель снизился с 62,7 до 46,3% [24].
Клинические рекомендации по применению ЗФТ у пациентов с РПЖ
Панкреатические ферменты для ЗФТ доступны в различных формах, дозах и ценовых диапазонах. Микротаблетки и минимикросферы, покрытые кишечнорастворимой оболочкой, эффективнее таблетированных препаратов при лечении стеатореи, поскольку предотвращается инактивация липазы под действием кислоты в желудке и они характеризуются улучшенной фармакокинетикой, обеспечивающей более надежный контакт ферментов с химусом и большую площадь контакта. Мини-микросферы с диаметром от 1,0 до 1,2 мм эвакуируются одновременно с пищей. Их эффективность на 25% выше по сравнению с микротаблетками размером 1,8–2,0 мм [25, 26].
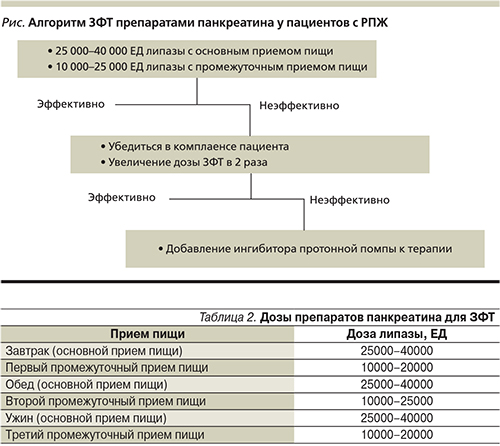
Важно отметить, что активность ферментных препаратов определяется содержанием в них липазы. Это обусловлено тем, что при патологии поджелудочной железы секреция липазы нарушается раньше, чем амилазы и протеолитические ферменты. Липаза по сравнению с амилазой и протеазами в большей степени подвергается протеолитическому гидролизу. Таким образом, дозы препаратов панкреатина подбираются по количеству липазы (табл. 2).
Пациентам с клинически выраженной стеатореей (неоформленный, с жирным блеском, зловонный стул, полифекалия) рекомендуется назначение ЗФТ на основании клинических данных. При РПЖ с признаками нутритивной недостаточности (потеря в весе, гипотрофия мышц, остеопороз, признаки гиповитаминоза) назначение ЗФТ может быть показано даже без диагностирования стеатореи с использованием метода количественной оценки экскретируемого жира и при нормальном виде кала. Абсолютными клиническими показаниями к ЗФТ являются:
- стеаторея при потере с калом более 15 г жира в сутки;
- прогрессирующая трофологическая недостаточность;
- стойкий диарейный синдром и диспепсические жалобы;
- сочетание признаков ВНПЖ с наличием болевого абдоминального синдрома, типичного для поражения поджелудочной железы.
Общие принципы рациональной ЗФТ приведены в рекомендациях Российской гастроэнтерологической ассоциации (РГА) по диагностике и лечению хронического панкреатита (2014) [27] и рекомендациях Российского общества клинической онкологии (RUSSCO) по применению ЗФТ пациентами с РПЖ (2015) [28]:
- Рекомендуемая минимальная доза для начального лечения составляет 25 000–40 000 единиц липазы на основной прием пищи и 10 000–25 000 единиц липазы – на промежуточный прием пищи (см. рисунок).
- Эффективность лечения может определяться по прибавке массы тела и снижению выраженности симптомов; любые сомнения в эффективности проводимого лечения следует расценивать как показания к лабораторному и инструментальному контролю ЗФТ.
- При недостаточной эффективности ЗФТ в начальных дозах следует удвоить дозу мини-микросфер или микротаблеток панкреатина.
- Пациентам с симптомами, сохраняющимися, несмотря на прием ферментных препаратов, покрытых кишечнорастворимой оболочкой, в максимальных дозах, следует назначать терапию, подавляющую желудочную секрецию (ингибиторы протонной помпы) [28].
Заключение
ЗФТ препаратами панкреатина является обязательным компонентом паллиативной терапии пациентов с РПЖ наряду с использованием других средств симптоматического лечения (октреотид, анальгетики, диуретики и т.п.), поскольку она позволяет больному получать полноценное питание для борьбы с болезнью. Только адекватная ЗФТ панкреатином пациентов с неоперабельным РПЖ позволяет значимо увеличивать низкую продолжительность жизни больных и улучшать ее качество.



