Болезнь Паркинсона (БП) – одно из наиболее частых нейродегенеративных заболеваний, преимущественно проявляющееся характерными двигательными нарушениями в виде сочетания гипокинезии с ригидностью, тремором покоя и постуральной неустойчивостью. Хотя существующие средства лечения, оказывающие преимущественно симптоматическое действие, уменьшают выраженность основных двигательных проявлений заболевания и даже позволяют отсрочить наступление инвалидизации и летального исхода, они не способны предотвратить наступление поздних стадий заболевания с их многочисленными как моторными, так и немоторными проблемами, плохо поддающимися коррекции. В связи с этим крайне актуален поиск новых средств, способных замедлить прогрессирование заболевания.
Дизайн исследования с “отсроченным” стартом
За прошедшее десятилетие многие средства, демонстрирующие в экспериментальных условиях многообещающие результаты, не смогли пройти фильтр клинических испытаний и подтвердить в них способность замедлять прогрессирование заболевания. В то же время ряд уже применяемых противопаркинсонических препаратов, согласно экспериментальным данным, обладает нейропротекторным потенциалом. В подобных случаях возникают сложности оценки нейропротекторного действия, поскольку собственно нейропротекторный эффект трудно отличить от чисто симптоматического эффекта этих средств. Для решения этой задачи в последние годы предложен новый дизайн исследований, предусматривающий т. н. отсроченный старт. Подобные исследования включают две фазы: в первой фазе одна группа пациентов получает активный препарат, а другая – плацебо.
Различия между группами к концу первой фазы исследования могут объясняться как чисто симптоматическим, так и нейропротекторным эффектами препарата. Вторая фаза предполагает назначение активного препарата обеим группам больных, в т. ч. тем, кто ранее получал плацебо. Если препарат оказывает только или по преимуществу симптоматическое действие, то к концу второй фазы состояние пациентов обеих групп, получающих абсолютно одинаковую терапию, сравнивается. Если же к концу второй фазы, несмотря на то, что пациенты обеих групп достаточно длительное время принимают одинаковые средства в одних и тех же дозах, различия между группами сохранятся, это будет свидетельствовать в пользу нейропротекторного эффекта.
Нейропротекторный потенциал разагилина
Разагилин (Азилект) – ингибитор моноаминооксидазы (МАО) типа В нового поколения, который в ранее проведенной серии контролируемых исследований (TEMPO, PRESTO, LARGO) продемонстрировал способность уменьшать выраженность основных симптомов паркинсонизма различной тяжести у больных БП. При этом по симптоматическому эффекту разагилин превосходил ингибитор МАО типа В предшествующего поколения – селегилин.
Одновременно на различных лабораторных моделях паркинсонизма и БП был продемонстрирован нейропротекторный потенциал препарата, который, в частности, заключается в способности тормозить апоптоз, запущенный токсическим действием глутамата, осуществлять индукцию факторов роста. Сравнительные экспериментальные исследования показывают, что по нейропротекторному действию разагилин превосходит селегилин, в т. ч. в силу того, что основной метаболит селегилина – метамфетамин – блокирует нейропротекторное действие, а основной метаболит разагилина – аминоиндан – нет.
Исследования in vitro свидетельствуют, что антиапоптотическая активность разагилина связана с пропаргиловым радикалом и не объясняется собственно торможением активности МАО. Активируя антиапоптотические молекулы (Bcl-2 и Bcl-xL) и связанный с протеинкиназой С митогенактивируемый протеинкиназный путь, а также снижая численность проапоптотических молекул (Bax и Bad), пропаргиловый радикал разагилина предотвращает открытие митохондриальных пор, активацию каспаз и развитие апоптотического каскада. Кроме того, он почти в 6 раз повышает уровень нейротрофического фактора GDNF, увеличивающего выживаемость дофаминергических нейронов in vivo и in vitro. Этот эффект, как показано в эксперименте, может быть связан с активацией нуклеарного фактора kB, общего транскрипционного фактора для GDNF, BDNF, супероксиддисмутазы и Bcl-2.
Исследование TEMPO
В ранее проведенном контролируемом клиническом исследовании TEMPO у 404 больных с ранней стадией БП показано, что разагилин в дозе 1 и 2 мг/сут уменьшает выраженность симптомов паркинсонизма, снижая оценку по Унифицированной шкале оценки болезни Паркинсона (UPDRS) соответственно на 4,2 и 3,5 балла, однако к концу 6-го месяца состояние пациентов вернулось к исходному [4]. Вслед за 6-месячной плацебо-контролируемой фазой исследования проводилась открытая фаза, в течение которой все наблюдавшиеся пациенты принимали разагилин в дозе 2 мг. К концу года наблюдения оценка по UPDRS повысилась по сравнению с исходным уровнем во всех группах, однако пациенты, принимавшие в течение года разагилин в дозе 1 мг, имели оценку на 1,8 балла ниже, чем больные, получавшие препарат в дозе 2,0 мг только последние 6 месяцев, а пациенты, принимавшие в течение года разагилин в дозе 2,0 мг, – на 2,3 балла ниже, чем больные, получавшие ту же дозу только последние 6 месяцев (рис. 1).
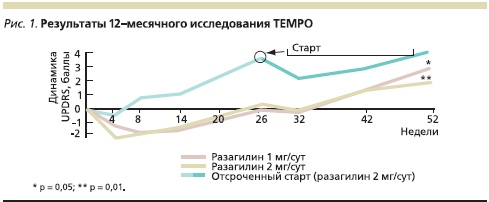
Более того, при последующем 6-летнем наблюдении показано, что различие между группами с ранним и отсроченным стартом лечения разагилином сохраняется в многолетней перспективе, причем даже спустя 6 лет пациенты с ранним началом терапии разагилином имеют оценку по UPDRS на 2,4 балла (16 %) ниже, чем пациенты, начавшие принимать препарат всего на 6 месяцев позже (рис. 2). Хотя в ходе 6-летнего наблюдения не удалось отметить снижения потребности в других дофаминергических средствах или отдаления момента развития моторных флуктуаций и дискинезий при раннем начале приема разагилина, достигнутый результат невозможно было объяснить только симптоматическим эффектом препарата [1].
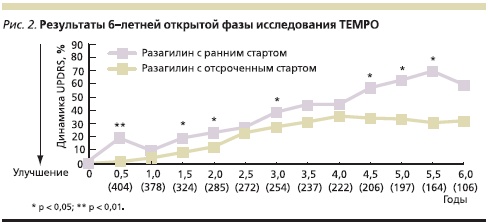
Вместе с тем исследование TEMPO не было изначально призвано доказать долгосрочность эффекта раннего назначения разагилина. Поэтому открытый характер его продолженной фазы, высокий процент выхода больных к концу исследования не позволяли быть полностью уверенными в достоверности полученных результатов. В связи с этим было запланировано новое исследование, призванное со всей строгостью доказать способность разагилина оказывать не только симптоматический эффект, но и модифицирующее влияние на течение заболевания.
Дизайн исследования ADAGIO
Название “ADAGIO” представляет собой акроним английского наименования исследования – Attenuation of Disease Progression with Azilect Given Once-daily (буквально “ослабление прогрессирования заболевания с помощью Азилекта, назначаемого 1 раз в день”). Во многом исследование ADAGIO стало новаторским. Это было первое клиническое испытание с отложенным стартом при БП. Более того, это было самое крупное клиническое испытание, включившее столь большое число больных с ранней стадией БП. Всего в исследование были включены 1176 ранее не лечившихся пациентов с недавно установленным диагнозом БП из 129 центров 14 стран [2]. К моменту включения в исследование средняя длительность заболевания составила всего 4,5 месяца.
Тяжесть симптомов заболевания, как и в других клинических испытаниях при БП, оценивалась по Унифицированной шкале оценки БП (Unified Parkinson Disease Rating Scale – UPDRS). Максимальная оценка по шкале UPDRS достигает 176 пунктов, при этом ее более высокие значения соответствуют большей выраженности симптомов заболевания. У включенных в исследование пациентов средняя оценка по UPDRS составила всего чуть более 20 баллов.
Чтобы оценить эффект разагилина (Азилекта) в дозах 1 и 2 мг, все больные, включенные в исследование, были рандомизированы в 4 примерно равные группы: в двух группах пациентам сразу же был назначен разагилин в дозах соответственно 1 и 2 мг, который пациенты принимали в течение всех 18 месяцев исследования.
Пациентам, попавшим в две другие группы, в первые 9 месяцев было назначено плацебо, а в последующие 9 месяцев они получали Азилект в дозах 1 или 2 мг (рис. 3). Исходно между группами не было существенных различий ни в демографических показателях, не в выраженности симптомов паркинсонизма, ни в длительности заболевания.
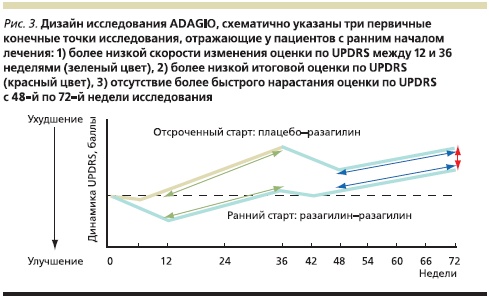
Длительность первой фазы исследования (9 месяцев) определялась необходимостью полностью выявить терапевтический эффект препарата – с тем, чтобы добиться максимальных различий между группами больных, принимавших активный препарат и плацебо. А с другой стороны, она была ограничена этическими соображениями – вряд ли пациентам даже с ранней стадией БП этично в течение более длительного срока назначать плацебо. В ходе второй фазы исследования, когда все включенные в него пациенты принимали разагилин, проводилось сравнение состояния больных, получавших препарат с самого начала или только во второй фазе исследования. Сравнение проводилось попарно для групп пациентов, принимавших в последние 9 месяцев исследования разагилин в дозах 1 и 2 мг.
Для того чтобы отличить влияние на течение заболевания от чисто симптоматического эффекта, показатели пациентов сравнивались в трех ключевых точках исследования.
При этом было важно сравнить не только и не столько абсолютные значения этих показателей, сколько их динамику – с тем, чтобы доказать, что преимущество в состоянии пациентов с ранним началом лечения, полученное в первые 9 месяцев, сохраняется до конца исследования. Важно подчеркнуть, что до самого завершения исследование носило слепой характер, что придает его результатам особую достоверность.
Основные результаты исследования ADAGIO
Всего исследование завершили 996 пациентов, при этом процент выхода из исследования был сопоставимым во всех 4 группах. Наиболее четкие различия в динамике показателя UPDRS между группами с ранним и отсроченным началом лечения проявились при приеме более низкой дозы разагилина – 1 мг. В первые 12 недель, как и ожидалось, у пациентов, принимавших разагилин, отмечено снижение оценки по UPDRS, отражающее уменьшение выраженности основных симптомов заболевания, тогда как у пациентов, принимавших плацебо, симптомы, а вместе с ними и оценка UPDRS продолжали нарастать (рис. 4).
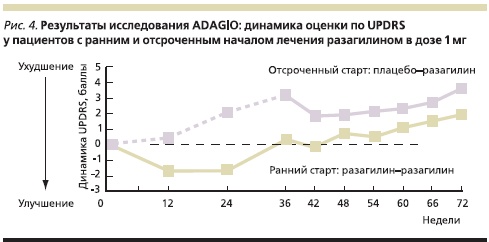
Более того, различие между группами продолжало неуклонно увеличиваться не только в первые 3 месяца, но и на отрезке между 12-й и 24-й неделями исследования, когда потенциал симптоматического действия разагилина должен был проявиться уже в полной мере и скорость нарастания симптомов в обеих группах должна была сравняться [3].
Различия между группами увеличивались прежде всего за счет того, что состояние пациентов, принимавших разагилин, было в тот период относительно стабильным, а состояние больных, принимавших плацебо, продолжало ухудшаться. В период между 12-й и 36-й неделями исследования скорость увеличения оценки по UPDRS на фоне приема разагилина составила 0,02 балла в неделю, тогда как на фоне приема плацебо – 0,09 балла. В результате за первые 9 месяцев исследования на фоне приема плацебо оценка по UPDRS увеличилась на 4,27 балла, тогда как фоне приема разагилина – всего на 1,26.
С началом второй фазы исследования, когда пациентам, ранее принимавшим плацебо, был назначен разагилин в дозе 1 мг, различия между группами с 36-й по 48-ю неделю сократились за счет симптоматического эффекта препарата у пациентов, ранее принимавших плацебо. Однако если бы эффект разагилина был только симптоматическим, показатель UPDRS в обеих группах рано или поздно сравнялся бы или по меньшей мере кривые, отражающие его динамику в последние недели исследования, имели бы тенденцию к конвергенции. В противоположность этому в последние 6 месяцев исследования оценка по UPDRS в группах с ранним и отсроченным стартом менялась “параллельным курсом”, а к концу 18-месячного исследования, несмотря на то что пациенты уже 9 месяцев принимали одно и то же лечение, различие между группами сохранилось и, что особенно важно, не имело тенденции к уменьшению (динамика оценки UPDRS c 48-й по 72-ю неделю исследования в обеих группах была одинаковой –оценка увеличивалась на 0,085 балла в неделю).
Итоговая оценка UPDRS к концу 18-го месяца в группе пациентов, принимавших 1 мг разагилина с самого начала исследования, оказалась выше исходной всего на 2,8 балла, тогда как в группе с отсроченным стартом – на 4,5.
Таким образом, статистически значимый эффект при приеме 1 мг разагилина был достигнут по всем трем исходно запланированным первичным конечным точкам исследования:
1) у пациентов с ранним стартом отмечена более низкая динамика оценки по UPDRS между 12-й и 36-й неделями, чем при отсроченном старте;
2) у пациентов с ранним стартом отмечен меньший прирост оценки по UPDRS к концу 72-й недели по сравнению с исходным уровнем, чем при отсроченном старте;
3) у пациентов с отсроченным стартом не выявлено более медленного нарастания симптомов паркинсонизма между 48-й и 72-й неделями, чем у пациентов с ранним стартом.
Если бы эффект разагилина имел чисто симптоматическую природу, следовало бы ожидать, что степень уменьшения симптомов под влиянием равной дозы препарата у больных с разными сроками заболевания и разной длительностью его лечения была бы сопоставимой. Данные исследования ADAGIO свидетельствуют, что эффект разагилина –нечто большее, чем просто симптоматическое действие. Раннее начало лечения разагилином в дозе 1 мг оказывает долгосрочный эффект, в результате которого за 9 месяцев у заболевания было “отвоевано” 1,7 балла (такой была разница в конце исследования между пациентами с ранним и отсроченным началом лечения). За этой внешне небольшой цифрой скрывается 38 %-ное замедление скорости нарастания симптомов.
Достоверность полученным данным придает не только абсолютная строгость в проведении исследования, до конца сохранявшего “слепой” характер, и статистической обработке полученных результатов, но и близость полученных данных к результатам ранее проведенного исследования TEMPO, что указывает на их воспроизводимость. Наконец, важно подчеркнуть безопасность применения разагилина, подтвержденную в исследовании ADAGIO: переносимость препарата была сопоставимой с таковой плацебо.
Почему не получено доказательств долгосрочного эффекта разагилина в дозе 2 мг?
В отличие от дозы 1 мг на фоне приема дозы 2 мг оценка UPDRS у пациентов с ранним и отсроченным началом приема препарата к концу исследования почти сравнялась. К концу 18-го месяца у пациентов, принимавших 2 мг разагилина, прирост оценки UPDRS по сравнению с исходным уровнем при раннем начале лечения составил 3,1, а при отсроченном – 3,5 балла [3].
Почему для дозы 1 мг долгосрочный эффект продемонстрировать удалось, а для дозы 2 мг – нет? Исходно между группами не было статистически значимых различий, не повлиял на результаты и выход некоторой части пациентов из исследования, который был примерно одинаковым в обеих группах. Как показывают экспериментальные данные, нейропротекторный эффект пропаргиламинов описывается U-образной кривой, при этом более высокая и более низкая концентрации пропаргиламина приводят к снижению эффективности.
Однако более вероятное объяснение заключается в том, что доза 2 мг оказывает более выраженный симптоматический эффект, маскирующий дополнительное действие, связанное с более ранним началом лечения, причем этот маскирующий эффект более отчетлив у пациентов с более легкой симптоматикой, составивших большинство в исследовании ADAGIO. Специальный ретроспективный анализ показал, что у пациентов с более высокой исходной оценкой по UPDRS (превысившей 25 баллов) модифицирующее течение заболевания действие разагалина проявлялось и на фоне приема препарата в дозе 2 мг. Различия в темпе увеличения оценки UPDRS между пациентами с ранним и отсроченным стартом лечения были достоверно выше у пациентов с более тяжелыми симптомами, чем у больных с исходно меньшей тяжестью заболевания.
Это соответствует результатам более раннего исследования TEMPO, в которое были включены пациенты с более выраженной симптоматикой (средняя оценка по UPDRS в этом исследовании составила 25 баллов, тогда как в ADAGIO – около 20) и в котором, как уже упоминалось, на фоне приема разагилина в дозе 2 мг показано преимущество раннего начала приема препарата.
Оказывает ли разагилин клинически значимый нейропротекторный эффект?
Можем ли мы на основании полученных результатов говорить о клиническом подтверждении нейропротекторного действия разагилина, т. е. о его способности предотвращать или замедлять процесс гибели нейронов? Безусловно это одно из объяснений результатов ADAGIO, к тому же опирающееся на большой массив экспериментальных данных.
Вместе с тем, строго говоря, нельзя исключать и альтернативных объяснений. Согласно одному из них, более раннее начало терапии разагилином способствует поддержанию внутренних компенсаторных механизмов, реализующихся в мозге у больных с ранней стадией БП. О том, что такие механизмы существуют, свидетельствуют хорошо известные данные, согласно которым первые моторные проявления заболевания возникают лишь после того, как доля погибших клеток черной субстанции достигнет 50 %, а концентрация дофамина в стриатуме снизится более чем на 80 %.
Возможно, именно благодаря компенсаторным механизмам на ранней стадии БП симптоматика нарастает сравнительно медленнее, несмотря на то что процесс гибели нейронов протекает более бурно по сравнению с последующими стадиями развития заболевания.
Утраченные возможности компенсации не могут быть восстановлены при последующем развитии заболевания. Можно полагать, что более ранняя коррекция нейрохимического дисбаланса при БП может влиять на компенсаторные механизмы и способствовать достижению не только краткосрочного, но и долгосрочного результата. Нельзя также исключать, что восстановление нейрохимического баланса предотвращает развитие патологических компенсаторных реакций, способствующих нарастанию тяжести клинических проявлений.
Для подтверждения нейропротекторной активности препарата необходимо дополнительно показать, что он замедляет развитие инвалидизации, позволяет отсрочить момент развития флуктуаций и дискинезий, застываний, выраженной постуральной неустойчивости, деменции и т. д. В идеале нейропротекторный эффект должен быть подтвержден с помощью биомаркеров заболевания, однако в настоящее время надежных биомаркеров прогрессирования БП, которые бы отражали все аспекты заболевания, как моторные, так и немоторные, не разработано [3].
Поскольку на данный момент невозможно четко дифференцировать истинный нейропротекторный эффект препарата и его способность усиливать адаптивные компенсаторные механизмы, корректнее говорить о том, что данные исследования ADAGIO свидетельствуют о способности разагилина модифицировать течение БП (оказывать нозомодифицирующий эффект). В любом случае для клинической практики полученные результаты означают необходимость максимально раннего (немедленно после установления диагноза БП) назначения разагилина.
Что запомнить для клинической практики?
ADAGIO – единственное на сегодняшний день исследование, в котором благодаря особому дизайну (отсроченный старт) удалось показать модифицирующее течение заболевания действие разагилина. Уникальность исследования в масштабности, строгом отборе случаев с недавним дебютом заболевания, длительности наблюдения при сохранении строгой контролируемости в дизайне. Важность ADAGIO столь же несомненна, как, вероятно, и то, что в ближайшем будущем оно вряд ли будет повторено в отношении другого препарата.
Результаты исследования открывают дорогу для широкого применения разагилина у пациентов с ранней стадией БП. Отсутствие необходимости в титровании дозы, безопасность препарата, возможность приема 1 раз в день резко повышают его привлекательность, прежде всего для этой категории пациентов. Соответственно, разагилин имеет смысл назначать каждому пациенту сразу после установления диагноза БП. На ранней стадии заболевания разагилин можно применять в качестве монотерапии. В дальнейшем к нему могут быть добавлены агонисты дофаминовых рецепторов, амантадин или другие препараты.
С другой стороны, исследование ADAGIO подчеркивает исключительную актуальность ранней диагностика БП, в идеале – на премоторной (т. е. до появления основных двигательных симптомов) и даже преклинической стадиях заболевания (до появления любых, в т. ч. немоторных, симптомов). В последние годы ведутся интенсивные исследования, призванные разработать подходы к максимально ранней и в то же время надежной диагностике БП, основанные на применении генетических, лабораторных, инструментальных методик. Но уже сегодня не вызывает сомнений, что существуют резервы более ранней диагностики БП, опирающейся на ее классические клинические проявления.
Опыт показывает, что от появления ранних моторных проявлений заболевания до установления диагноза зачастую проходит несколько лет, в течение которых больные могут не обращаться за медицинской помощью, считая появившийся у них дискомфорт несущественным или преходящим, а врачи неправильно интерпретируют жалобы пациентов и минимальные моторные признаки заболевания. Появление новых эффективных подходов к лечению БП, наиболее действенных на ее ранней стадии, требует от врача глубоких знаний и ответственности.
Информация об авторе:
Левин Олег Семенович – доктор медицинских наук, профессор кафедры неврологии РМАПО.
Тел. 8 (495) 252-93-03



