Согласно последним исследованиям, число людей с хронической болезнью почек (ХБП) в мире превышает 843 млн и около 4 млн получают заместительную почечную терапию (ЗПТ) [1]. Ведущими факторами риска развития ХБП считаются сахарный диабет (СД) и артериальная гипертензия (АГ). В период с 1980 по 2014 г. число лиц с СД в мире увеличилось в 4 раза – со 108 млн в 1980 г. до 422 млн в 2014 г. [2]. По данным Международной федерации диабета (IDF) за 2019 г., число людей, страдающих СД, составляет 463 млн [3]. Число лиц с повышенным артериальным давлением увеличилось с 594 млн в 1975 г. до 1,13 млрд в 2015 г. [4]. В странах с низким и средним уровнем дохода отмечался более быстрый рост СД и АГ, чем в развитых странах [5].
В российском исследовании ХРОНОГРАФ у 1600 пациентов с АГ и СД 2 типа изучали наличие признаков и симптомов ХБП. У 49,4% пациентов выявили снижение скорости клубочковой фильтрации (СКФ) менее чем до 60 мл/мин/1,73 м2 и/или альбумин-креатининовое соотношение (АКС) более 30 мг/г. СКФ менее 60 мл/мин/1,73 м2 обнаружена у 34,8% пациентов, альбуминурия выше 30 мг/г – у 32,6% пациентов. У 18% наблюдалось сочетание сниженной СКФ и высокой или очень высокой альбуминурии. У 28,5% пациентов отмечен высокий или очень высокий уровень комбинированного риска прогрессирования ХБП и сердечно-сосудистых осложнений [6].
ХБП – один из факторов риска сердечно-сосудистых заболеваний [7]. ХБП многократно повышает риск кардиоваскулярной смерти у пациентов с АГ и СД [8].
Раннее выявление и лечение ХБП возможны с помощью относительно простых и доступных методов. Своевременно проведенная диагностика и правильно назначенные диета и лечение снижают вероятность неблагоприятных почечных и сердечно-сосудистых исходов, замедляют или предотвращают прогрессирование ХБП до терминальной стадии, требующей ЗПТ [9]. Проблема диагностики и лечения ХБП и управления связанными с ней факторами риска, особенно на этапе первичной медико-санитарной помощи (ПМСП), требует повышенного внимания. Даже в странах, где проводятся крупные популяционные исследования, осведомленность о заболеваниях почек среди населения и органов здравоохранения низкая [10]. По данным программы NHANES (National Health and Nutrition Examination Survey), показатель осведомленности населения США о наличии ХБП в 2003–2006 гг. составлял 7,2% и за десять лет (к 2015–2018 гг.) вырос несущественно – до 12,1%. У пациентов с СД, АГ или их сочетанием осведомленность была существенно выше (10,4%, 13,8 и 20,0% соответственно) по сравнению с теми, кто не страдал такими заболеваниями (4,5%). Даже при ХБП С3 осведомленность была крайне низкой (16,9%) по сравнению с 61,9% при ХБП С4 и 86,3% при ХБП С5 [11]. При других неинфекционных хронических заболеваниях (АГ, СД) более 70% пациентов знают о своем заболевании и находятся под наблюдением специалистов [10]. С учетом вышеприведенной статистики можно предположить, что у пациентов с СД и АГ не проводится адекватного скрининга ХБП. Это в полной мере относится и к российской медицинской практике.
Таким образом, в большинстве случаев ХБП – это «безмолвное» заболевание (которое иногда называют «тихим убийцей»): отсутствие клинических симптомов на ранних стадиях становится причиной поздней диагностики и несвоевременного начала диеты и терапии. В российском здравоохранении отмечается нехватка врачей-нефрологов в системе ПМСП. Поэтому основное бремя своевременной диагностики ХБП ложится на плечи врачей первичного звена. У многих пациентов ХБП своевременно не диагностируется из-за отсутствия настороженности у медицинских специалистов (врачей общей практики, терапевтов, кардиологов, эндокринологов) в отношении заболеваний почек. Информированность врачей первичного звена о широкой распространенности ХБП, обучение методам ранней диагностики и нефропротекции позволят улучшить качество медицинской помощи пациентам с ХБП и избежать ЗПТ или отдалить ее начало. Учитывая важность проблемы, нами было выполнено проспективное неинтервенционное наблюдательное исследование в обычной клинической практике в 12 регионах Российской Федерации (табл. 1). Название проекта – «Ранняя диагностика хронической болезни почек в учреждениях ПМСП» («ХБП-скрининг»).
Цель исследования: установить долю пациентов с наличием факторов риска, признаками и симптомами ХБП, посещающих врачей ПМСП, которые не наблюдаются у нефролога.
На основании полученных данных предполагается разработать рекомендации по ранней диагностике ХБП и маршрутизации пациентов с ХБП в учреждениях ПМСП.
Материалы и методы
Проведено проспективное неинтервенционное наблюдательное исследование в обычной клинической практике.
Исследуемая популяция была сформирована на основании данных российских и международных исследований, подтверждающих широкую распространённость сердечно-сосудистых заболеваний и диабета, а также их существенную роль в развитии ХБП.
Критерии включения: мужчины и женщины в возрасте 18 лет и старше, пациенты, обратившиеся в учреждение ПМСП, имеющие один или несколько диагнозов в соответствии с Международной классификацией болезней 10-го пересмотра (МКБ-10), указанных в табл. 2, наличие хотя бы одного фактора риска, признака или симптома ХБП, указанного в табл. 4.
Критерии невключения: отсутствие информированного согласия на обработку персональных данных, пациент уже имеет диагноз ХБП и наблюдается у нефролога.
Все пациенты, посетившие участвовавших в проекте врачей ПСМП в период проведения проекта, соответствовавшие критериям включения в проект и имевшие хотя бы один признак, симптом или фактор риска ХБП, были обследованы для целей настоящего исследования. Врачи ПМСП оценивали факторы риска, признаки и симптомы возможной ХБП с использованием вопросника, разработанного авторами исследования (табл. 4). Вопросник для выявления ХБП разработан на основании клинических рекомендаций «Сердечно-сосудистый риск и хроническая болезнь почек», раздел 5 [16] и «Clinical Practice Guidelines for Chronic Kidney Disease: Evaluation, Classification and Stratification» [9]. Пациентам с подозрением на ХБП рекомендовалось посетить нефролога. В исследовании были получены данные, необходимые для планирования дальнейшего изучения специфичности и чувствительности вопросника.
Результаты
Число пациентов, обратившихся к участвующим в проекте врачам ПМСП во время проведения проекта и имевших представляющие интерес диагнозы (табл. 2), составило 13 968. Все эти пациенты были обследованы для целей данного проекта. По результатам обследования 1124 (8%) пациента были направлены врачом ПСМП к врачу-нефрологу, поскольку пациент либо имел хотя бы один из следующих симптомов:
- СКФ ниже 60 мл/мин /1,73 м2;
- альбуминурия ≥30 мг/24 ч;
- АКС >30 мг/г (или >3 мг/ммоль);
- ПКС>150 мг/г или тест-полоска (положительный тест);
- либо сумма оценки присутствовавших у пациента факторов риска, признаков или симптомов ХБП была 5 баллов и более в соответствии с вопросником (табл. 4).

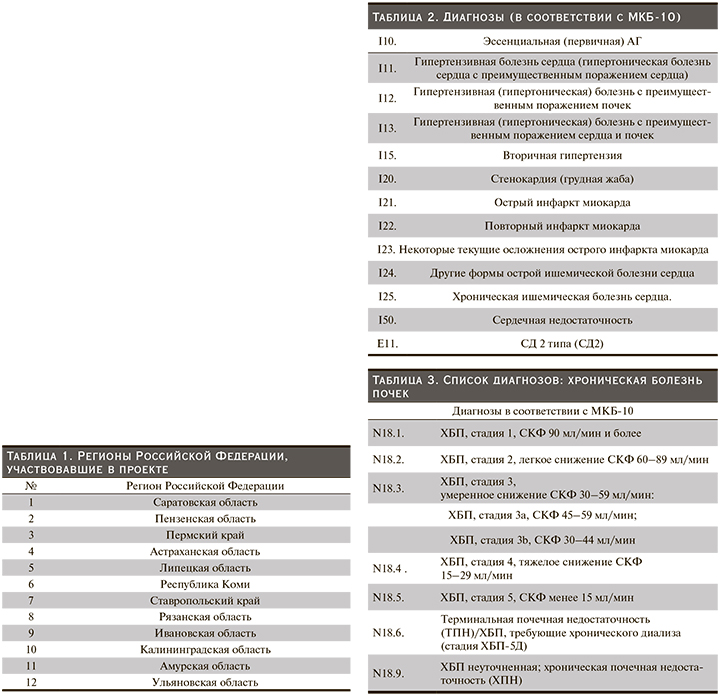
Врачами-нефрологами обследованы 1026 (91%) пациентов из 1124 направленных. У 927 (90%) пациентов присутствовали симптомы, наличие хотя бы одного из которых служило основанием для направления к врачу-нефрологу (табл. 6).
У 718 (70%) пациентов сумма оценки факторов риска, признаков или симптомов ХБП была 5 баллов и более (табл. 7, 8).
У одного пациента могли присутствовать как симптомы, наличие хотя бы одного из которых служило основанием для направления к врачу-нефрологу, так и сумма оценки факторов риска, признаков или симптомов ХБП могла быть 5 баллов и более. Распределение пациентов по регионам представлено в табл. 5.
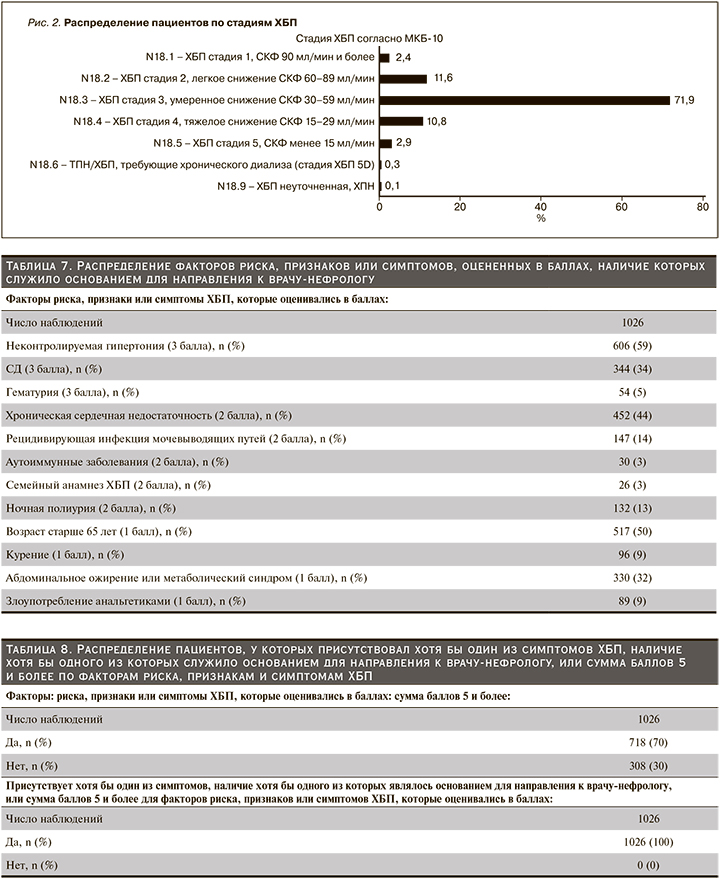
Диагноз ХБП (МКБ-10: N18) был подтвержден нефрологом у 973 из 1026 пациентов, что составило 95%; диагноз ХБП не был подтвержден у 53 (5%) пациентов. Распределение пациентов с подтвержденным диагнозом ХБП по стадиям ХБП представлено в табл. 9 и рис. 2. Наиболее представительной оказалась группа пациентов с ХБП С3 (СКФ 59–30 мл/мин/1,73 м2) таких пациентов было 71,9%. Подстадии С3а и С3б распределились почти поровну (33,4 и 30,7% соответственно). Далее по частоте шли ХБП С2 (11,6%) и ХБП С4 (10,8%). Лабораторные данные пациентов, у которых диагноз ХБП подтвержден нефрологом, представлены в табл. 10. Данные по наличию факторов риска, признаков и симптомов ХБП в зависимости от стадии ХБП для 973 пациентов, у которых диагноз ХБП подтверждён нефрологом, представлены в табл. 11. Процедуры для лечения ХБП, назначенные нефрологом пациентам с подтвержденным диагнозом ХБП, представлены в табл. 12.


В табл. 13 более подробно представлены данные по процедурам, назначенным нефрологом, в зависимости от стадии ХБП (табл. 3).
Обсуждение
Появление ЗПТ в 60-х годах прошлого века сделало возможным долгосрочное применение жизнеспасающих, но дорогостоящих методов лечения пациентов с терминальной стадией ХБП. Во многих странах, в т.ч. в России, основные ресурсы направляются на ЗПТ, ранним стадиям ХБП уделяется недостаточно внимания. Одной из причин является низкая осведомленность врачей и пациентов о распространенности и рисках «скрытой» ХБП. Особенно важно, чтобы организаторы здравоохранения, зная об угрозах здоровью населения вследствие широкой распространенности ХБП, уделяли достаточно внимания своевременной диагностике ХБП и понимали необходимость раннего начала нефро- и кардиопротекции. Данные о распространенности маркеров ХБП в российской популяции ограничены. В исследовании ЭССЕ-РФ, посвященном распространенности нарушения функции почек в популяции лиц с АГ, снижение СКФ значительно чаще обнаруживалось у пациентов с АГ, а также у пациентов с АГ и СД2 [12]. Возрастной диапазон включенных в исследование пациентов ограничивался 25–64 годами, хотя риск развития ХБП существенно выше у лиц старше 65 лет. В исследовании ЭССЕ-РФ не оценивали важнейший маркер ХБП – альбуминурию.
В упомянутом выше исследовании ХРОНОГРАФ обследовали только пациентов с СД2 и АГ, что ограничило популяцию пациентов, возможно, страдавших ХБП.
Интересной представляется работа московской группы исследователей, которые оценили результаты 5-летнего опыта тестирования лабораторией ИНВИТРО СКФ на территории РФ [13]. За 5 лет наблюдений у 32 235 (50,5%) из 63 920 пациентов СКФ было ниже 90 мл/мин/1,73 м2, у 6 866 (10,8%) пациентов отмечено снижение СКФ до <60 мл/мин/1,73 м2, т.е. ХБП С3–С5. Однако дизайн исследования не предусматривал определения альбуминурии.
Проект «ХБП-скрининг», вероятно, первое в России исследование, в котором приняли участие пациенты, имеющие практически все известные факторы риска развития почечной дисфункции. В течение исследования общий поток пациентов во всех участвовавших в проекте учреждениях ПМСП составил 1 028 865 человек. Число пациентов с диагнозами, являющимися предметом изучения в данном проекте (табл. 2), составило 140 022, или 13,6% от общего числа лиц, посетивших учреждения ПСМП, 13 968 пациентов с представляющими интерес диагнозами посетили врачей, участвующих в проекте (не все врачи ПМСП в конкретном ЛПУ принимали участие в данном исследовании). Пациент включался в программу, если ранее ему не диагностировали ХБП и он не наблюдался у нефролога. Полученные результаты согласуются с данными ряда крупных популяционных исследований: наибольшее число пациентов (71,9%) имели ХБП С3 (СКФ – 59–30 мл/мин/1,73 м2). Далее по частоте шли ХБП С2 (11,6%) и ХБП-С4 (10,8%). Подстадии ХБП С3а и С3б распределились почти поровну (33,4 и 30,7% соответственно). Считается, что у лиц с ХБП С3а более высок риск погибнуть от сердечно-сосудистых осложнений, нежели дожить до начала ЗПТ, тогда как у пациентов с СКФ 30–44 мл/мин/1,73 м2 (ХБП С3б) существенно выше шансы дожития до терминальной стадии ХБП [7–9]. Таким образом, половина из включенных в исследование пациентов с ХБП С3 имеют больший риск погибнуть от кардиоваскулярных осложнений, вторая половина имеют больший риск того, что им потребуется ЗПТ.
Из факторов риска, признаков или симптомов ХБП наиболее часто отмечена неконтролируемая АГ (59%), далее по убывающей: возраст старше 65 лет (50%), хроническая сердечная недостаточность (44%) и только затем – СД (34%) и абдоминальное ожирение (32%). Считается, что именно СД вносит наибольшую лепту в развитие ХБП. Пациенты с СД и уже установленным диагнозом ХБП не участвовали в проекте (подтвержденная ХБП являлась критерием невключения), что, возможно, повлияло на описанную выше статистику – врачи, наблюдающие пациентов с СД, более насторожены в отношении ХБП и своевременно устанавливают диагноз. В то же время настораживает, что 34% пациентам с СД диагноз ХБП был впервые установлен только в ходе проекта. Среди пациентов с впервые установленным диагнозом ХБП СД присутствовал у 37% пациентов стадии С4 и у 18% стадии С5, т.е. многие пациенты с СД на преддиализной и диализной стадиях, к сожалению, не имели диагноза ХБП!
Частота хронической сердечной недостаточности нарастала, достигая пика при ХБП С3а, с последующим убыванием среди пациентов с более высокой стадией ХБП, а частота рецидивирующей инфекции мочевыводящих путей убывала с нарастанием степени почечной дисфункции.
Диагноз ХБП был подтвержден у 95% пациентов, направленных врачами ПМСП к нефрологу на основании результатов оценки возможного наличия ХБП. Таким образом, способ выявления ХБП по общепринятым маркерам (СКФ<60 мл/мин/1,73 м2 и/или альбуминурия >30 мг/сут.) в сочетании с предложенной нами балльной оценкой (табл. 4) вполне себя оправдал и может быть рекомендован к использованию в первичном звене здравоохранения. Планируется дальнейшая работа по изучению специфичности и чувствительности предложенного метода.
Части пациентов с подтвержденным диагнозом ХБП нефролог назначал диету с ограничением потребления белка: 39% пациентов уже с ХБП С1 и 80% с С2, 78–99% с ХБП С3–5. Согласно обновленным рекомендациям по питанию пациентов с ХБП [14], ограничение потребления белка (0,55–0,60 г/кг/сут.) рекомендуется пациентам при ХБП С3–С5 (не находящимся на диализе), что позволяет существенно замедлить темпы прогрессирования ХБП. Еще более впечатляющие результаты по замедлению прогрессирования ХБП у пациентов с ХБП С3–С5 (не находящихся на диализе) дает строгое ограничение потребляемого белка (0,28–0,43 мг/кг/сут.) с применением кетоаналогов незаменимых аминокислот [15]. Пациентам с СД и ХБП С3–С5 целесообразно назначать потребление белка 0,6–0,8 г/кг/сут. для поддержания стабильного нутриционного статуса, также необходим контроль гликемии на фоне тщательного клинического наблюдения. Условием диетотерапии является обеспечение энергетической ценности 25–35 ккал/кг/сут. Необходимо более активно информировать нефрологов и врачей первичного звена о современных принципах диетотерапии, построения лечебного рациона и назначения медикаментозной терапии у пациентов с ХБП с учетом стадии ХБП.
Заключение
Среди пациентов с сердечно-сосудистыми заболеваниями и СД, обратившихся в учреждения ПСМП, не имевших диагноза ХБП и не наблюдавшихся у нефролога, 1124 (8%) имели факторы риска, признаки и симптомы ХБП в объеме, требующем направления к нефрологу. Среди пациентов с ХБП преобладает стадия С3 – 71,9%, при этом ХБП С3а встречается у 33,4% пациентов, а С3б – у 30,7%; относительно реже выявляются ХБП С2 (11,6%) и ХБП С4 (10,8%). Наиболее высокая частота ХБП выявляется у пациентов с неконтролируемой АГ (59%), у лиц в возрасте старше 65 лет (50%), хронической сердечной недостаточностью (44%), СД (34%) и абдоминальным ожирением (32%); этот контингент нуждается в обязательном скрининге по ХБП. Балльная система оценки рисков ХБП наряду с традиционной оценкой СКФ и альбуминурии – хороший инструмент для раннего выявления дисфункции почек. Диагноз ХБП был подтвержден у 95% от общего числа пациентов, у которых вопросник выявил подозрение на ХБП. Необходимо более активно информировать нефрологов и врачей первичного звена о современных принципах диетотерапии, построения лечебного рациона у пациентов с ХБП, медикаментозной терапии с учетом стадии ХБП. На основании полученных данных предполагается разработать рекомендации по ранней диагностике ХБП и маршрутизации пациентов с ХБП в учреждениях первичной медико-санитарной помощи.



