Наружный генитальный эндометриоз (НГЭ) представляет собой распространенное эстроген-зависимое хроническое воспалительное заболевание, которым страдают 5-10% женщин репродуктивного возраста [1-3]. Эндометриоз наблюдается у 50-80% женщин с тазовой болью и до 50% у женщин с бесплодием [3]. Для НГЭ характерно доброкачественное разрастание подобной эндометрию функциональной ткани вне полости матки. Однако инфильтративный рост и метастазирование эндометриоидных гетеротопий могут приводить к разрушению окружающих тканей. Течение эндоме-триоза имеет прогрессирующий и рецидивирующий характер.
Наиболее распространенные симптомы НГЭ включают хроническую тазовую боль, дисменорею, бесплодие и диспареунию, которые оказывают серьезное влияние на качество жизни женщин [1-3]. Однако эндометриоз не имеет патогномоничных признаков и симптомов. Кроме того, у многих женщин отмечается бессимптомное течение эндометриоза на протяжении всей жизни. Женщины без клинических проявлений заболевания составляют 45-50% больных эндометриозом [3]. Вследствие этого распознавание эндометриоза является неадекватным; при этом 65% женщин изначально ставится неправильный диагноз [4]. Постановка диагноза может задерживаться в среднем на 7-10 лет, что приводит к прогрессированию заболевания и тяжелым последствиям [5, 6].
Эндометриоз имеет многофакторный этиопатогенез и гетерогенные проявления заболевания [7, 8]. Развитию эндометриоза способствуют нарушения функции эндокринной системы и регуляции иммунного ответа, затрагивающие функциональную активность NK-клеток, фагоцитоз, экспрессию факторов роста, цитокиновый профиль и образование аутоантител [2, 9]. В ряде исследований предполагается участие B-лимфоцитов в патогенезе эндометриоза путем образования антиэндометриальных (АЭА), антифосфолипидных (аФЛ), антинуклеарных аутоантител и антител к ДНК, типичных для других аутоиммунных заболеваний [10]. В последнее время эндометриоз рассматривается как аутоиммунное заболевание в связи с повышенным образованием аутоантител, высокими уровнями цитокинов, терапевтическим ответом на иммуномодуляторы, клеточноопосредованными нарушениями и сопутствующей аутоиммунной патологией [11, 12].
Золотым стандартом диагностики НГЭ до настоя-щего времени остается хирургический метод, главным образом, лапароскопия, несмотря на риск возможных осложнений и смертности [3, 6]. К достоинствам лапароскопии относятся визуализация очагов эндометриоза и возможность проведения гистологического исследования эктопической эндометриоидной ткани. Однако диагностическая лапароскопия не всегда точна и может пропустить заболевание. Такие методы неинвазивной диагностики, как ультразвуковое и магнитно-резонансное исследования, применяются ограниченно лишь при некоторых формах эндометриоза.
В настоящее время продолжается поиск наиболее специфических и чувствительных биомаркеров, пригодных для неинвазивной диагностики эндо-метриоза на ранних стадиях, оценки эффективности лечения, мониторинга течения и рецидивиро- вания заболевания. По данным систематического обзора, из 97 исследованных биомаркеров только АЭА, CA-19.9, CA-125 и интерлейкин-6 ассоциируются с эндометриозом; однако их определение не имеет достаточной диагностической точности [13]. Использование CA для неинвазивной диагностики эндометриоза ограничивается из-за недостаточной чувствительности и специфичности для выявления ранних форм заболевания. Особый интерес представляют результаты исследований по изучению аутоантител, специфических к антигенам эндометрия (тропомиозину 3 (аТПМ), тропомо- дулину 3 (аТМОД)), гликолитическому ферменту а-енолазе (аЕНО), гликопротеину ламинину-1, мембранному белку синтаксину 5, как возможных биомаркеров для неинвазивной диагностики эндометриоза [14—16]. Следует отметить, что эти белки участвуют в процессах, играющих важную роль в патогенезе эндометриоза, включая миграцию, адгезию, инвазию, пролиферацию и апоптоз эндометриоидных клеток.
В связи с вышеизложенным, цель настоящего исследования: изучить профиль и диагностическое значение сывороточных аутоантител у женщин с НГЭ.
Материалы и методы
Исследуемую группу составили женщины с распространенным НГЭ III-IV стадии (группа 1, n=74), средний возраст 31,5 (4,3) года, проходившие хирургическое лечение в Национальном медицинском исследовательском центре акушерства, гинекологии и перинатологии им. академика В.И. Кулакова (НМИЦ АГП им. В.И. Кулакова). Диагноз эндометриоза был поставлен во время проведения оперативного вмешательства в соответствии с классификацией Американского общества по репродуктивной медицине (ASRM). У 53 (71,6%) женщин был диагностирован эндометриоз яичников. Пациентки исследуемой группы в течение 3 месяцев до оперативного вмешательства не применяли гормональные, контрацептивные и проти-вовоспалительные препараты. В группу сравнения (n=27) вошли относительно здоровые женщины (средний возраст 30,6 (3,7) года) без эндометриоза на протяжении жизни. Исследовали образцы сыворотки крови, полученные у женщин в фолликулярную фазу менструального цикла на 10,2 (3,2) день.
С помощью иммуноферментного анализа (ИФА) проводили исследование спектра аутоантител, включающего антитела к гормонам (эстрадиолу (аЭ), прогестерону (аПГ), хорионическому гонадотропину человека (аХГЧ)), к специфическим эндометриальным антигенам (аТПМ, аТМОД), аЕНО, антинуклеарные и аФЛ (к кардиолипину (аКЛ), в2-гликопротеину-1 (аР2-ГП-1), фосфати- дилсерину (аФС), протромбину (аПТ), аннексину V (аАн V)), антитела к компоненту комплемента C1q (аС1ц) и мембранному гликопротеину ламинину-1.
Определение аФЛ (IgM, IgG), IgG-антител к компоненту комплемента C1q и антинуклеар- ных антител проводили с использованием имму- ноферментных наборов ORGENTEC Diagnostika (Германия), IgG-антитела к ламинину-1 определяли с применением иммуноферментного набора IBL INTERNATIONAL (Германия).
Определение антител к эндометриальным антигенам проводили с использованием рекомбинантных белков ТПМ и ТМОД (Abcam, Великобритания), иммобилизованных на микропланшетах MaxiSorp (Thermo Scientific Nunc, Дания), и моноклональных антител против IgM, IgG человека, конъюгированных с пероксидазой хрена (ООО ХЕМА, Россия). Иммобилизацию антигенов на микропланшеты и проведение анализа выполняли по методике ИФА, описанной нами ранее [17].
Определение антител к гормонам проводили с использованием препарата очищенного ХГЧ (Sigma-Aldrich, США) и конъюгатов прогестерон- 3-(0-карбокси-метил)оксим-БСА (ООО «ХЕМА», Россия) и в-эстрадиол-б-(О-карбокси-метил) оксим-БСА (Sigma-Aldrich, США) по описанным ранее модифицированным методикам ИФА [18, 19]. Измерение оптической плотности (ОП) выполняли при длине волны 450 нм на фотометре MULTISKAN EX (Thermo Electron (Shanghai) Instrument Co., Китай). При средней ОП исследуемого образца, превышающей более чем на два стандартных отклонения (26) среднюю ОП отрицательного контроля, результат анализа считали положительным.
Статистический анализ
Статистический анализ полученных данных выпол-няли с помощью пакетов прикладных статистических программ Microsoft Office Excel 2010, MedCalc v. 12. Для оценки нормальности распределения значений в выборках применяли W-тест Шапиро-Уилка и тест Колмогорова—Смирнова. Количественные данные представляли при нормальном распределении средним арифметическим и стандартным отклонением (M (SD)), при отклонении от нормального распределения - медианой (Me) с 95% доверительным интервалом (95% ДИ) и размахом значений от 2,5%с до 97,5%с (Ме (Q1;Q3)). Статистическую значимость различий между частотными показателями оценивали с использованием х2-теста, между непрерывными величинами — U-теста Манна—Уитни. Различия считали значимыми при уровне статистической значимости P<0,05. Наличие связи между независимыми переменными и зависимой бинарной переменной определяли с помощью ROC-анализа (Receiver Operating Characteristics) и логистического регрессионного анализа. Связь между фактором риска и исходом оценивали по величине отношения шансов (ОШ).
Результаты и обсуждение
Проведенный анализ клинико-анамнестических данных показал, что пациентки в группе эндометриоза характеризовались высокой частотой эндо-метриоидных кист яичников, спаечного процесса в малом тазу, аденомиоза и первичного бесплодия (табл. 1); причем эта патология выявлялась значимо чаще, чем в группе сравнения. Реже у больных эндометриозом диагностировались миома матки, хронический эндометрит, хронический сальпин-гоофорит, полипы эндометрия. Обе группы были сравнимы по возрасту женщин.
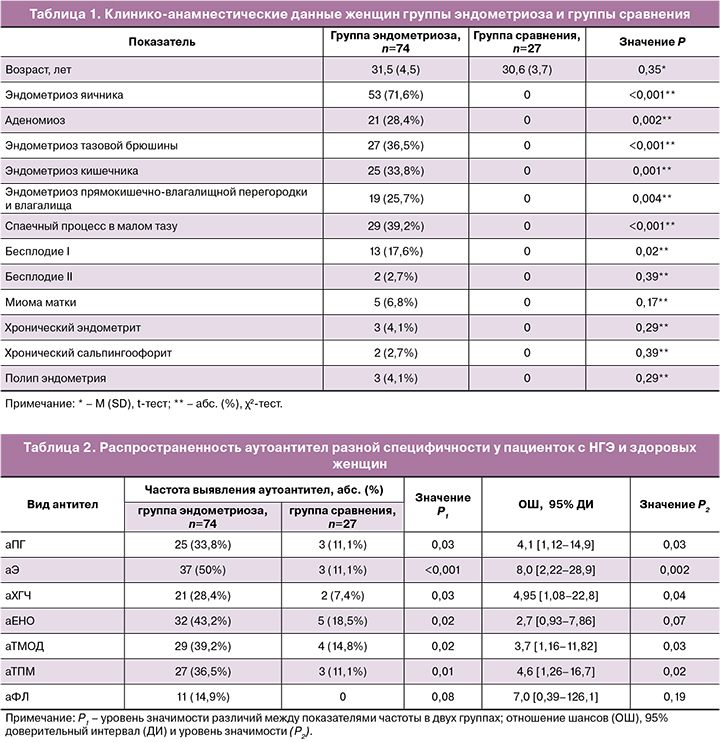
С помощью новых модификаций ИФА у пациенток с распространенным НГЭ был выявлен широкий спектр сывороточных аутоантител разной специфичности (табл. 2), включающий антитела к гормонам (Э, ПГ, ХГЧ), к эндометриальным антигенам (ТПМ, ТМОД), аЕНО и аФЛ. При этом суммарные аФЛ, включая антитела к C1q, выявлялись у больных с НГЭ значимо реже аутоантител к эндометриальным антигенам и гормонам (P<0,05). Антинуклеарные антитела и антитела к ламинину-1 класса G не были найдены у пациентов в исследуемых группах.
У пациенток с эндометриозом статистически зна-чимо чаще обнаруживались антитела к гормонам (Э, ПГ, ХГЧ), эндометриальным антигенам (ТМОД, ТПМ) и аЕНО; при этом вероятность образования данных антител по значениям ОШ была выше в 3,7-8,0 раза, чем в группе сравнения (P<0,05). аФЛ классов M и G суммарно были выявлены у 11 пациенток: IgM-антитела к КЛ, в2-ГП-1 и ФС — У 2/74 (2,7%) пациенток, IgM- и IgG-антитела к Ан V и ПТ - у 1/74 (1,4%) пациентки антитела каждого вида, IgG к C1q - у 3/74 (4,1%) пациенток. Хотя в группе сравнения ни у одной из женщин аФЛ не были найдены, различия между двумя группами по частоте обнаружения аФЛ не были статистически значимыми.
Частота выявления аутоантител классов M и G в сыворотке крови у пациенток с НГЭ и у здоровых женщин представлена в таблице 3. У пациенток с эндометриозом значимо чаще выявлялись IgM- и IgG-антитела к Э и ХГЧ, IgM-антитела к ПГ, IgG- антитела к ТПМ, ТМОД и ЕНО (P<0,05). Наличие различий между группами по частоте выявления данных антител подтверждалось высокими значениями критерия х2 Пирсона, которые составляли от 3,9 до 11,8 (P<0,05). При этом у пациенток с эндометриозом риск образования IgM-антител к Э и ПГ был выше в 16,8 и 11 раз соответственно, а других антител — в 4,2—8,4 раз выше, чем в группе сравнения. Значимых различий в частоте выявления IgM-антител к ЕНО, ТПМ, ТМОД в двух группах не было обнаружено.
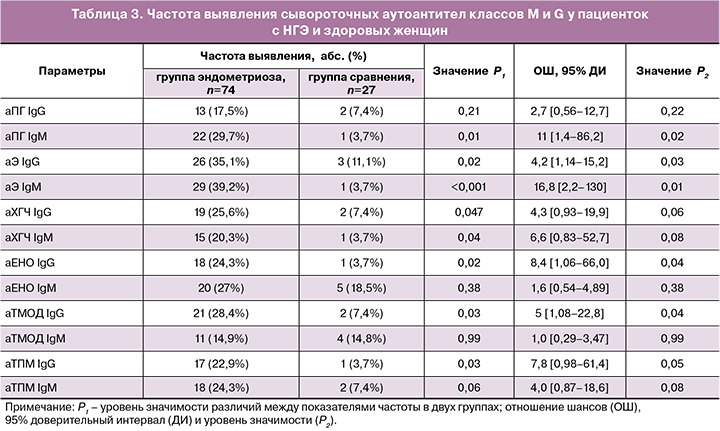
Обращает на себя внимание высокая частота выявления антител, главным образом класса G, к эндометриальным антигенам ТМОД и ТПМ. Полученные результаты согласуются с данными других исследователей о высокой распространенности у пациенток с эндометриозом сывороточных АЭА, реагирующих со многими антигенами эндометрия [20, 21], в частности, с антигенами 30 кДа и 45 кДа, идентифицированными как ТПМ и ТМОД [22]. В многоцентровом проспективном исследовании была показана взаимосвязь между сывороточными АЭА и лапароскопически верифицированным эндометриозом и подтверждена высокая положительная прогностическая ценность теста на АЭА для эндометриоза [23].
Следует отметить повышенную частоту выявления у больных с эндометриозом сывороточных антител к стероидным гормонам; их образование может быть обусловлено эндокринными нарушениями, избыточной секрецией эстрогенов яичниками, синтезом эстрогенов в самой эндометриоидной ткани, в периферической жировой ткани и в коже, а также локальной продукцией больших количеств ПГ эндометриоидными стромальными клетками [1].
Кроме того, отмечается высокая частота выявления антител к ХГЧ, который относится к группе гликопротеиновых гонадотропных гормонов, вклю-чающей также фолликулостимулирующий (ФСГ) и лютеинизирующий (ЛГ) гормоны с близкой антигенной структурой, идентичными а-субъединицами и высокогомологичными в-субъединицами. Так, гомология в-субъединиц ХГЧ и ЛГ составляет 85%, а ХГЧ и ФСГ - 36% [24]. К образованию антител к гонадотропным гормонам может предрасполагать повышение содержания гормонов в крови и нарушение цикличности их образования при эндометриозе [25].
В таблице 4 представлены уровни аутоантител классов G и М в обследованных группах. У пациенток с эндометриозом медианные уровни IgM-антител к Э, ПГ, ХГЧ, ТПМ, а также IgG-антител к Э, ХГЧ, ЕНО и ТМОД были значимо выше, чем у женщин в группе сравнения.
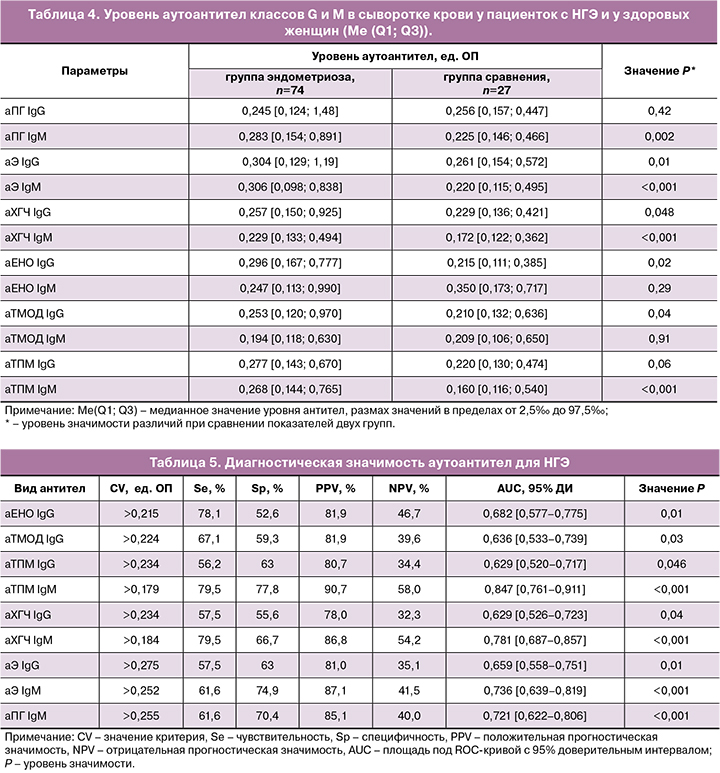
Полученные результаты согласуются с данными недавнего исследования, продемонстрировавшего более высокую эффективность использования антител к отдельным эпитопам ТПМ и ТМОД в качестве биомаркеров для диагностики эндометриоза I-II стадии, по сравнению с CA-125 и CA 19.9 [14]. По-видимому, образованию антител к ТПМ и ТМОД способствует экспрессия этих белков в эндометриоидных клетках, связанная с выполнением важных функций: участием в образовании актиновых филаментов, обеспечением цитоскелет- ной динамики, подвижности, миграции и адгезии клеток, перехода к стационарной морфологии, апоптозу и некрозу [26, 27].
Образованию антител к гликолитическому ферменту ЕНО может способствовать повышенная экспрессия этого фермента на поверхности инвазивных эндометриоидных клеток, способствующая их инвазии, активации плазмина и деградации внеклеточного матрикса [28]. Полученные результаты согласуются с опубликованными данными, которые демонстрируют повышение средних уровней аЕНО в сыворотке крови у пациенток с эндометриозом I— III стадий и позволяют предположить возможность использования этих антител в качестве биомаркера эндометриоза [15].
Как показал ROC-анализ, определение IgM- антител к ТПМ, Э, ПГ и ХГЧ имеет высокую диагностическую значимость для НГЭ и характеризуется высокими значениями AUC (0,721-0,847; P<0,01), чувствительности, специфичности и положительной прогностической значимости (табл. 5).
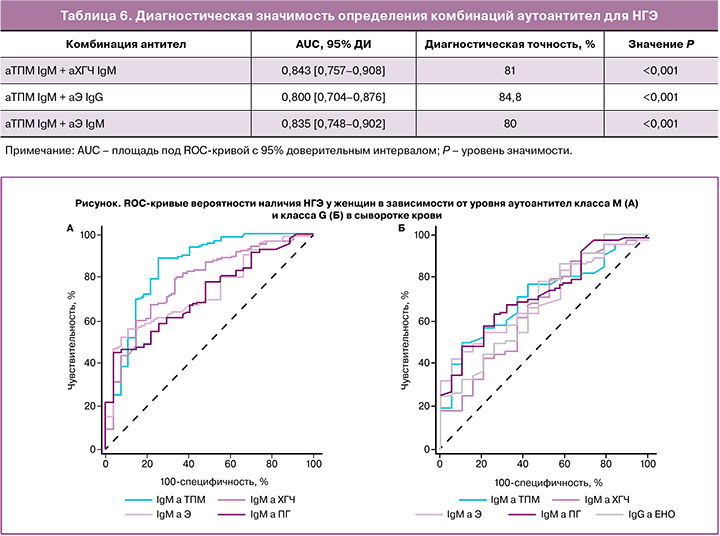
ROC-кривые позволяли эффективно дифферен-цировать пациенток с распространенным НГЭ и здоровых женщин по уровню IgM-антител к ТПМ, Э, ПГ и ХГЧ (рисунок); при этом предсказательная способность модели оценивалась как хорошая, значения AUC превышали 0,7. По данным множе-ственного логистического регрессионного анализа, диагностическая точность определения данных антител при НГЭ составляла 74-84%. Полученные результаты согласуются с данными Gajbhiye R. et al., демонстрирующими высокую диагностическую значимость антител к эпитопам ТМОД и ТПМ для диагностики эндометриоза I-II стадии [14].
Определение комбинаций антител к ТПМ, Э и ХГЧ характеризовалось высокой диагностической значимостью для НГЭ; при этом достигались высокие показатели AUC (0,800-0,843), диагностическая точность тестов составляла 80-84,8% (табл. 6). Полученные результаты демонстрируют пер-спективность создания панели биомаркеров для неинвазивной диагностики эндометриоза на основе АЭА и антител к стероидным и гонадотропным гормонам.
Следует отметить, что обнаруженные при эндоме-триозе антитела к гонадотропным и стероидным гор-монам и эндометриальным антигенам могут иметь патогенетическое значение и рассматриваться как факторы риска развития хронического воспалитель-ного процесса и бесплодия у пациенток с эндоме-триозом. Среди возможных механизмов действия антигормональных антител можно предположить нейтрализацию биологической активности гормонов, нарушение связывания гормонов с рецепторами, повреждение клеток, несущих гормональные рецепторы, развитие резистентности к гормонам. Антитела к эндометриальным антигенам и ЕНО могут способствовать усилению воспалительных реакций в очагах эндометриоза, которые развиваются вследствие интенсивной продукции цитокинов эктопическими эндометриоидными клетками, изменению цитокинового профиля перитонеальной жидкости, а также активации B-клеток в прилежащих периферических лимфоидных органах (узлах) и тем самым дальнейшему усилению образования антител.
Заключение
Таким образом, согласно полученным результатам, у женщин с НГЭ выявляется широкий спектр аутоантител, включающий антитела к эндометриаль-ным антигенам, гликолитическому ферменту аЕНО, к стероидным и гонадотропным гормонам, которые могут иметь патогенетическое значение при эндо-метриозе. У больных с эндометриозом отмечается более высокая частота выявления и уровень антител к Э, ПГ, ХГЧ, ТМОД, ТПМ и аЕНО по сравнению со здоровыми женщинами. Антитела к ТПМ, Э, ПГ и ХГЧ характеризуются наиболее высокой диагностической значимостью для эндометриоза. Антитела к эндометриальным антигенам и гормонам являются перспективными для создания диагностической панели биомаркеров эндометриоза. В дальнейших исследованиях будет продолжено изучение значения предложенных тестов для ранней диагностики эндо-метриоза, мониторинга течения и прогнозирования рецидивов заболевания.



