Инфекции мочевыводящих путей (ИМП) являются одними из самых распространенных заболеваний и встречаются более чем у 50% женщин в течение жизни, причем почти у половины из них наблюдается рецидив ИМП в течение 6–12 месяцев [1]. Рецидивирующие инфекции мочевыводящих путей (РИМП), по данным разных авторов, встречаются в 10–15% случаев у женщин репродуктивного возраста и в 20% случаев у женщин в менопаузе [1, 2]. Общепринятое клиническое определение РИМП включает ≥3 рецидивов заболевания в течение 12 месяцев или ≥2 рецидивов в течение 6 месяцев [3]. Международное общество урогинекологов в 2010 г. внесло коррективы в данное определение: РИМП – это ≥3 случаев ИМП с клинической и лабораторной идентификацией в предыдущие 12 месяцев с подтверждением излеченности до установления диагноза последующей ИМП [3]. Подтверждение излеченности заболевания очень важно, так как предыдущая терапия ИМП может быть неэффективной: пациенты отмечают клиническое улучшение без нормализации лабораторных показателей. Данная концепция является основополагающей в диагностике и ведении больных с РИМП.
Безусловно, основной причиной возникновения острого уретрита или цистита является тот или иной инфекционный агент (Escherichia coli, Enterococcus faecalis, Klebsiella и т.д.), однако переход заболевания в хроническую рецидивирующую форму происходит, как правило, при наличии определенных факторов риска.
Факторы риска
Факторы риска РИМП [4–6]:
- дистопия уретры – это врожденное низкое расположение наружного отверстия уретры (сразу над влагалищем или на передней стенке влагалища), что приводит к обострению уретрита или цистита после полового акта;
- хронический обструктивный синдром, наличие остаточной мочи;
- цисто-, ректоцеле;
- сахарный диабет;
- урогинекологические операции;
- недержание мочи и кала;
- эстрогенный дефицит и развитие атрофических процессов в урогенитальном тракте.
Наиболее частым фактором риска возникновения РИМП у женщин в пери- и постменопаузе является дефицит половых стероидов. Мочевой и генитальный тракты имеют общее эмбриональное происхождение, что объясняет наличие α- и β-эстрогеновых рецепторов, рецепторов к прогестерону и андрогенам во всех структурах урогенитального тракта: нижней трети мочеточников, мочевом пузыре, сосудистых сплетениях, уротелии, мышцах тазового дна, связочном аппарате малого таза. Дефицит эстрогенов приводит к блокаде митотической активности клеток уротелия, прекращению пролиферативных процессов, ишемии органов малого таза и в конечном итоге – к развитию атрофических процессов в уретре и мочевом пузыре и нарушению состава «уробиома», изучению которого в настоящее время уделяется большое внимание [7–9].
Современное представление об уробиоме
Термины «микробиота» и «микробиом» часто используются как идентичные, тем не менее их значения имеют некоторые различия. Микробиом определяется как совокупность всех геномов комменсальных, симбиотических и патогенных микроорганизмов, которые находятся в анатомической нише, тогда как термин «микробиота» описывает непосредственно живые микроорганизмы [10]. В 2007–2010 гг. были опубликованы результаты крупного международного проекта по изучению микробиома человека (HMP – Human Microbiome Project) [10, 11]. Цель данного проекта – определение состава микробных сообществ человеческого организма и их роли в поддержании нормальных физиологических процессов и в развитии различных заболеваний [10]. Первоначально изучались микробиомы желудочно-кишечного тракта, кожи, дыхательных путей, полости рта, полового тракта, глаз и крови [10]. В дальнейшем несколько научных групп с помощью современных методов диагностики исследовали микробиом мочевыводящих путей (МВП) у женщин и мужчин.
Традиционно МВП проксимальнее мочеиспускательного канала считались урологами и урогинекологами средой, свободной от бактерий. Однако проведенные исследования в ходе проекта HMP опровергли догму о том, что мочевые пути «стерильны», показав, что и у здоровых людей данная анатомическая ниша колонизирована уникальной микробной флорой [12].
Рутинные методы микробиологического культивирования непригодны для определения состава микробиоты мочи, так как с помощью данных диагностических тестов невозможно обнаружить анаэробные бактерии или бактерии, имеющие биопленки. Более того, если при посеве мочи обнаруживается рост комменсалов или симбионтов, таких как Corynebacterium spp., Lactobacillus spp. или Ureaplasma spp., они рассматриваются как «загрязняющая флора», попавшая из половых путей [12, 13].
Для определения состава уробиома у женщин исследователи HMP использовали метод секвенирования, в частности, основанный на идентификации последовательности 16S рибосомальной РНК (рРНК). 16S рРНК играет ключевую роль в жизнедеятельности клетки, поэтому этот метод является высокочувствительным. В то же время в данной последовательности имеются гипервариабельные области, которые можно использовать для таксономической идентификации бактерий, сравнивая их с базой данных 16S рРНК [13].
С помощью секвенирования в моче здоровых женщин исследователи HMP наиболее часто определяли: Lactobacillus spp.; различные виды Corynebacterium, Streptococcus, Actinomyces, Staphylococcus, Aerococcus, Gardnerella, Bifidobacterium, Ureaplasma, Actinobaculum [14]. Образцы мочи для секвенирования были получены с помощью трансуретрального катетера и надлобковой аспирации и показали аналогичные результаты. Это доказывает, что обнаруженные виды микроорганизмов действительно представляют резидентный микробиом мочевого пузыря, а не вульвовагинальную флору.
Ограничением метода секвенирования является тот факт, что невозможно различить жизнеспособные и нежизнеспособные бактерии и их генетические фрагменты. В последующем исследовании 2014 г. Hilt et al. применили расширенный количественный протокол культивирования мочи и смогли идентифицировать большое количество микроорганизмов, которые не определялись стандартным культуральным методом. Авторы показали, что большинство бактерий, обнаруженных в микробиоме мочи с помощью техники 16S рРНК, действительно жизнеспособны [15].
Исследования образцов мочи у женщин с помощью высокотехнологичных современных методов показали наличие сложных бактериальных сообществ со значительными различиями по видам и количеству. Льюис и соавт. [16] изучали микробиоту мочи у здоровых мужчин и женщин с помощью метода 16S рРНК и количественной полимеразной цепной реакции (ПЦР), позволяющей оценить бактериальные нагрузки. В образцах женщин идентифицировалось неоднородное сочетание бактериальных родов, но, разделив выборки на три возрастные группы, авторы выделили 23 рода, которые были представлены во всех группах. Таким образом, они предположили наличие «основной» микробиоты, которая может колебаться по численности в зависимости от возраста. Кроме того, авторы показали, что общее количество бактерий с возрастом прогрессивно снижается. Примечательно, что четыре рода: Jonquetella spp., Parvimonas spp., Proteiniphilum spp., Saccharofermentans spp. обнаружены только в возрастной группе 70+, что подтверждает концепцию наличия «возрастных родов» [16]. Значительные изменения выявлены в составе микробиоты у мужчин и женщин, что может быть связано с различиями в анатомии мочевыводящих путей и гормональном статусе [14, 17].
В ходе HMP изучалась микробиота МВП не только у здоровых людей, но и при ряде заболеваний (гиперактивный мочевой пузырь, интерстициальный цистит) [17, 18]. Исследования с применением метода секвенирования мочи не проводились при острых уретритах и циститах, но была обследована группа пациентов с бессимптомной бактериурией [19].
Бессимптомная бактериурия характеризуется обнаружением различных бактерий в моче при отсутствии клинических признаков воспаления. Fouts et al. в 2012 г. [20] техникой 16S рРНК исследовали образцы мочи, полученные у пациентов с нарушениями мочеиспускания на фоне травмы спинного мозга (ТСМ) и здоровых женщин. В группу с ТСМ вошли пациентки с самостоятельным мочеиспусканием и применявшие уретральный катетер. Результаты показали, что у женщин с ТСМ, способных к мочеиспусканию, титр лактобактерий был выше, чем у использовавших самокатетеризацию, но ниже, чем в группе контроля. Причем была выявлена временная составляющая: в течение первых нескольких месяцев после травмы микробиота оставалась схожей по составу с контрольной группой, но уже через 1 год в моче преобладали бактерии рода Enterococcus spp. и резко снижалось количество Lactobacillus spp. Авторы предложили использовать лактобактерии в качестве маркера здорового мочевого пузыря у женщин [20].
Таким образом, масштабные исследования в ходе HMP доказали наличие резидентной микрофлоры в мочевом пузыре и уретре, изменение которой может приводить к снижению локального иммунитета и возникновению патологии.
Диагностика
Диагностика РИМП основывается на совокупности клинических, лабораторных и инструментальных данных [21].
Клинические признаки:
- дизурия;
- частые и ургентные позывы на мочеиспускание;
- боли и дискомфорт в области уретры и надлобковой области;
- чувство неполного опорожнения мочевого пузыря;
- гематурия;
- неприятный запах мочи;
- изменения в психоэмоциональном статусе.
Анамнез: гинекологические и урологические оперативные вмешательства, недержание мочи и кала, опухоли и онкозаболевания в анамнезе,
Осмотр: наличие или отсутствие цисто-, ректоцеле, признаков урогенитальной атрофии, дистопии уретры, наличие свищей и т.д. При подозрении на инфравезикальную обструкцию обязательна оценка остаточной мочи.
Лабораторная диагностика:
- микробиологическое исследование образцов мочи: стандартный метод часто не обнаруживает все уропатогены;
- расширенный количественный культуральный метод подразумевает посевы мочи на различные типы сред при разных температурных условиях, в том числе и в анаэробных условиях. Этот метод по эффективности коррелирует с секвенированием гена 16 рРНК [22]. Показан пациентам с РИМП в случае отрицательных результатов стандартного микробиологического анализа и неэффективности проводимой антибактериальной терапии;
- наличие пиурии (общий анализ мочи и анализ мочи по Нечипоренко). Данные исследования также используются как контроль излеченности.
Инструментальная диагностика:
- УЗИ почек, мочевого пузыря при повышении мочевины, креатинина в крови, необходимости определения остаточной мочи, обструктивном синдроме;
- МРТ или КТ при подозрении на опухоли, онкозаболевания мочеполовой системы, аномалии развития, свищи, дивертикул уретры и т.д. [23];
- Цистоскопия проводится при наличии стойкой гематурии, подозрении на стриктуры уретры, опухоли мочевого пузыря т.д., когда необходимо провести дифференциальную диагностику.
Лечение
Лечение РИМП у женщин, особенно в постменопаузе, требует командного междисциплинарного подхода.
Пациенткам с подтвержденным диагнозом РИМП в острой фазе рекомендовано применение антибактериальной терапии. Выбор препаратов осуществляется на основании результатов посевов с учетом чувствительности уропатогена. При невозможности проведения культурального исследования или при выраженной клинической картине выбор антибиотика проводится эмпирически с учетом наиболее распространенных возбудителей ИМП (табл. 1) [24].
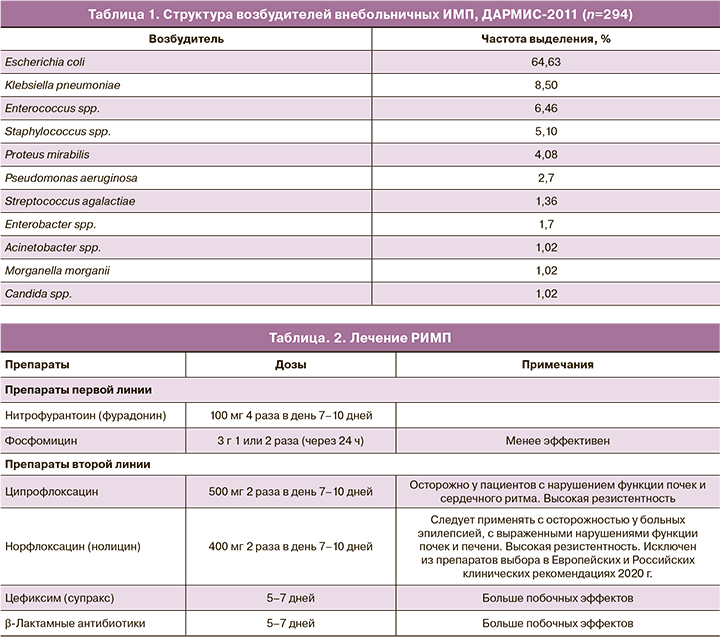
Назначение антибактериального препарата осуществляется не только с точки зрения эффективности, но и с позиции безопасности для данного пациента с учетом сопутствующих заболеваний, возраста. Препаратами первого ряда с доказанной эффективностью и минимальными побочными эффектами являются нитрофурантоин и фосфомицин (табл. 2) [21, 25].
При наличии клинической картины, но отрицательных посевах мочи или незначительном количестве бактериальных колоний (менее 105 КОЕ/мл), ключевой должна быть тактика, направленная на устранение симптомов [26].
При обнаружении «бессимптомной бактериурии» (выделении бактериальных колоний менее 105 КОЕ/мл при отсутствии клинической картины) лечение антибиотиками не проводится. В этом случае рекомендованы адекватная гидратация и фитотерапия [26].
Бессимптомная бактериурия – нередкое явление у женщин в менопаузе, причем с возрастом частота ее увеличивается. В проспективном наблюдательном исследовании, в котором участвовала 61 женщина в постменопаузе (средний возраст 78 лет), показано, что «бессимптомная бактериурия» выявлялась у 1/3 пациенток, не вызывая никаких симптомов [27].
Профилактика рецидивов
Профилактика рецидивов является основной целью в лечении пациентов с РИМП.
Общие меры профилактики [21]:
- ношение свободной одежды, хлопковое белье;
- опорожнение мочевого пузыря сразу после коитуса;
- соблюдение правил личной гигиены, вытирание «спереди назад»;
- использование бесщелочных средств для личной гигиены.
Для профилактики рецидивов ИМП рекомендованы антибактериальные препараты, которые применяются в низких дозах ежедневно или посткоитально в течение 6–12 месяцев [21, 28, 29]. Рандомизированные плацебо-контролируемые исследования показали высокую эффективность длительной антибактериальной терапии низкими дозами (табл. 3).

Однако у длительной антибиотикопрофилактики есть существенные недостатки [26].
Побочные эффекты (гепатотоксичность, нефротоксичность и т.д.).
Развитие дисбактериоза кишечника, влагалища.
Появление резистентных штаммов микроорганизмов.
Для уменьшения риска развития побочных эффектов в настоящее время все чаще прибегают к альтернативным методам профилактики ИМП (табл. 4).
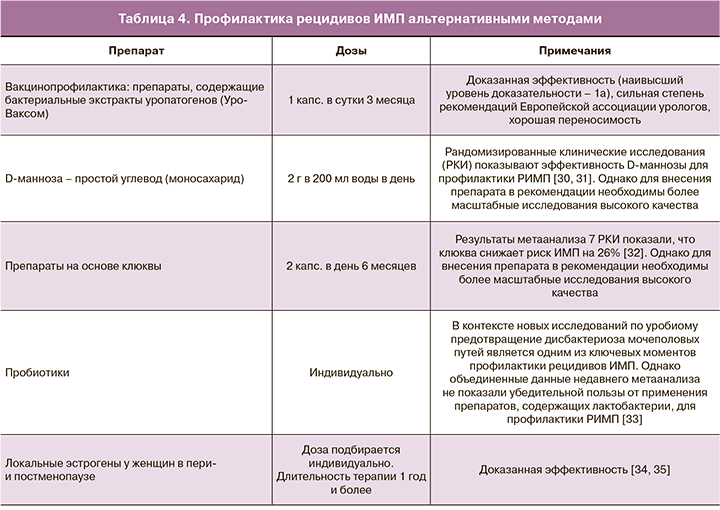
Вакцинопрофилактика является важным направлением в лечении пациенток с РИМП. Цель данной терапии не в уничтожении инфекционных агентов, а в защите организма человека путем стимуляции иммунного ответа в отношении наиболее распространенных уропатогенов [36]. К таким вакцинам относится препарат «Уро-Ваксом» (Vifor Pharma Ltd., OM Pharma, Myerlin, Швейцария). Данное лекарственное средство представляет собой бактериальный экстракт, состоящий из лиофилизированных бактериальных лизатов, полученных из 18 различных штаммов Escherichia coli, которые являются наиболее частыми возбудителями РИМП. Активизация иммунной реакции после приема «Уро-Ваксома» начинается в зоне пейеровых бляшек тонкой кишки, а затем в мочеполовом тракте в двух направлениях:
- Активизация гуморального иммунного ответа (активация Т- и В-лимфоцитов, синтез различных анти-Е. coli-антител, синтез иммуноглобулина класса А);
- Активизация неспецифического иммунного ответа (макрофаги и NK-клеточный фагоцитоз).
Благодаря активизации клеточного и гуморального иммунитета препарат эффективен в отношении не только Е. coli, но и других уропатогенов.
Эффективность «Уро-Ваксома» в качестве профилактики рецидивов ИМП доказана в ходе РКИ.
В исследовании H.-J. Schneider, проведенном в 1990 г., изучалась эффективность препарата «Уро-Ваксом» у 116 пациенток (средний возраст 35,6 года) с неосложненным циститом. Препарат принимали в течение 3 месяцев, затем прерывистым курсом на протяжении первых 10 дней каждого месяца в течение 6 месяцев. Средний показатель частоты РИМП снизился с 3,4 до 1,2 [37, 38].
В 1993 г. проведено исследование при участии 160 пациентов, 82 из которых получали «Уро-Ваксом» (45,3±2,0 года; 84% – женщины) и 78 – плацебо (45,0±1,8 года; 83% –женщины) общее число случаев рецидивирующей бактериурии статистически значимо снизилось в группе, принимавшей «Уро-Ваксом»: 31 против 59 во время лечения (p<0,001); 27 против 55 в течение 3 месяцев наблюдения после лечения (p<0,001) и 58 против 114 в целом (p<0,001). Среднее число случаев возникновения РИМП в течение всего исследования составило 0,7 в группе «Уро-Ваксома» и 1,5 – в группе плацебо. Снижение числа случаев ИМП сопровождалось достоверным сокращением частоты применения антибиотиков в 2 раза через 6 месяцев лечения [39].
В открытом наблюдательном исследовании 1996 г. по оценке эффективности иммунотерапии у женщин в постменопаузе при участии 58 женщин, средний возраст 66,3 года, с рецидивирующими неосложненными ИМП (пациентки получали лечение стандартным курсом «Уро-Ваксома» 3 месяца, реиммунизация через 3 месяца) было выявлено, что препарат «Уро-Ваксом» снижает частоту рецидивов ИМП у женщин в постменопаузе на 65% по сравнению с 6-месячным периодом до исследования [40].
В 2010 г. Kim K.S. и соавт. провели проспективное многоцентровое исследование по изучению эффективности и безопасности вакцинопрофилактики препаратом «Уро-Ваксом» (3-месячный курс лечения по 1 капcуле в сутки) у 42 пациентов с РИМП в возрасте от 34 до 75 лет. Основным критерием эффективности являлось количество рецидивов цистита в течение 6 месяцев после лечения в сравнении с таковым по длительности периодом до начала терапии. Результаты работы показали достоверно значимое снижение рецидивов ИМП после приема вакцины в сравнении с предшествующими терапии 6 месяцами (0,35 против 4,26, р<0,001). Также авторы отметили отсутствие каких-либо серьезных побочных эффектов, связанных с приемом исследуемого препарата [41].
Кульчавеня Е.В. и соавт. продемонстрировали результаты лечения уро-ваксомом 127 пациентов с РИМП (23 мужчин и 104 женщин). По завершении первичного курса лечения (по 1 капсуле в сутки 1 месяц) у всех больных отмечалась положительная клинико-лабораторная динамика, однако длительность безрецидивного периода различалась. У 86,7% пациентов «холодный» период продолжался 6–12 месяцев, у 13,3% отмечались рецидивы ИМП в течение полугода после завершения приема «Уро-Ваксома». При возникновении обострения пациенты получали повторный курс иммунопрофилактики, который закрепил достигнутый эффект. Частота рецидивов ИМТ сократилась с 3±0,8 до 0,4±0,2 раза, т.е. более чем в 8 раз в течение года наблюдения [42].
В систематическом обзоре 2019 г. изучена эффективность трех вакцин: Uro-Vaxom, Urovac и ExPEC4V у 1537 пациентов с РИМП. Анализ 10 РКИ показал, что «Уро-Ваксом» наиболее успешно снижал количество рецидивов в конечной точке исследования по сравнению с плацебо (ОР 0,67; 95% ДИ 0,57–0,78 и ОР 0,78; 95% ДИ 0,69–0,88 соответственно). «Уровак» продемонстрировал достоверное уменьшение рецидивов циститов в сравнении с группой контроля, но уступал по эффективности «Уро-Ваксому» (ОР 0,75; 95% ДИ 0,63–0,89; низкий QOE). На фоне терапии препаратом ExPEC4V не отмечалось достоверного снижения эпизодов ИМП в сравнении с группой плацебо (ОР 0,82; 95% ДИ 0,62–1,10; низкий QOE) [43].
Таким образом, РКИ показали, что бактериальный экстракт E. сoli обеспечивает эффективную профилактику ИМП, достоверно сокращая частоту возникновения рецидивов циститов, снижает необходимость использования антибактериальных препаратов и в связи с этим улучшает качество жизни женщин с РИМП разных возрастных групп, в том числе молодых женщин с посткоитальными циститами на фоне дистопии уретры и у пациенток с рецидивирующими циститами на фоне урогенитальной атрофии в постменопаузе. Кроме того, иммунопрофилактика показана в качестве предгравидарной подготовки у женщин с РИМП для снижения риска рецидива заболевания во время беременности.
Заключение
РИМП является одной из наиболее распространенных патологий у женщин. Частые обострения уретритов и циститов, связанные с половым актом, переохлаждением, уровагинальной атрофией и другими факторами, резко снижают качество жизни пациенток, в том числе их сексуальную активность.
Лечение обострений ИМП заключается в назначении антибактериальной терапии с учетом чувствительности микробного агента. Но основная цель ведения пациенток с РИМП – это профилактика рецидивов. Одним из передовых методов в этом плане является вакцинопрофилактика, направленная на стимуляцию собственных иммунных реакций и поддержание нормального состава уробиома. Препарат «Уро-Ваксом», согласно данным клинических исследований, эффективно снижает частоту рецидивов ИМП и, таким образом, повышает качество жизни женщин с РИМП.



