Инфицированность вирусом папилломы человека (ВПЧ) среди беременных женщин составляет от 5,5 до 65,0% [1] и выше по сравнению с небеременными – 25,0% против 13,0% соответственно [2].
Частота сочетания ВПЧ с другими инфекциями составляет более 70% [3]. Установлена положительная связь между бактериальным вагинозом (БВ) и ВПЧ-инфекцией [4, 5]. Частота вульво-вагинального кандидоза (ВВК) и аэробного вагинита (АВ) выше у женщин с ВПЧ-инфекцией, но их взаимное влияние не установлено [6, 7].
Однако количество исследований распространенности рецидивирующих нарушений дисбиоза влагалища среди беременных женщин с ВПЧ-инфекцией ограничено и требует изучения.
Цель исследования – определить частоту рецидивирующих нарушений биоценоза влагалища, ассоциированных с бактериальным вагинозом, их структуру, особенности клинического течения и лабораторных показателей у беременных женщин с ВПЧ-инфекцией.
Материал и методы исследования
Обследованы 682 беременные женщины в возрасте от 21 до 45 лет во II–III триместрах беременности (18–36 недель), у которых выявлен ВПЧ до начала настоящей беременности (в рамках цервикального скрининга или прегравидарной подготовки) или в I триместре (цервикальный скрининг).
Критерии включения: возраст пациенток 21–45 лет; беременность во II–III триместре (13–36 недель); наличие ВПЧ-инфекции; диагноз, соответствующий коду МКБ-10 N88 – другие невоспалительные болезни женских половых органов (бактериальный вагиноз – БВ), B37.3 – кандидоз вульвы и вагины (вульво-вагинальный кандидоз – ВВК), N76.0 – острый вагинит (неспецифический, или аэробный вагинит – АВ); рецидивирующее течение (повторный эпизод заболевания в течение настоящей беременности); информированное добровольное согласие на участие в исследовании.
Критерии исключения: ИППП без предварительной санации, тяжелые соматические заболевания, резус-отрицательная кровь, преэклампсия, угроза прерывания беременности, отсутствие эффекта при лечении антимикробными препаратами при предыдущем эпизоде дисбиоза, установленная ранее аллергическая реакция и другие побочные эффекты при использовании лекарственных средств.
Для выявления, типирования и количественного определения ВПЧ выполняли ВПЧ-тест квант-21 (ПЦР в режиме реального времени; «ДНК-Технология»). Учет и интерпретация результатов реакции осуществлялась автоматически с помощью программного обеспечения, поставляемого с детектирующим амплификатором. Клинически значимой концентрацией считали не менее 103 копий ДНК ВПЧ на образец, что характеризует высокий уровень инфекции и может привести к развитию неоплазии шейки матки (чувствительность – 98,1%, специфичность – 99,7%). В результатах анализа учитывали значения контроля взятия материала. Его значение меньше четырех интерпретировали как недостаточное. В этом случае выполняли повторное взятие клинического материала.
Оценку клинической картины проводили на основании жалоб и объективного осмотра вульвы, стенок влагалища и шейки матки в зеркалах.
Выполняли рН-метрию содержимого влагалища с помощью индикаторных рН-полосок с шагом деления 0,2–0,3 (чувствительность – 90%, специфичность – 85%). Нормальными считали значения в диапазоне 3,8–4,5.
При микроскопии выделяли 4 типа влагалищных мазков: 1+ (<10 микробных клеток и лейкоцитов в поле зрения), 2+ (11–100 микробных клеток и 11–20 лейкоцитов в поле зрения), 3+ (100–1000 микробных клеток и 21–30 лейкоцитов в поле зрения), 4+ (>1000 микробных клеток и >31 лейкоцитов в поле зрения). Чувствительность метода – на уровне выявления микроорганизмов в количестве 4–5 lg КОЕ/мл и более.
С помощью фемофлор-16 определяли общую бактериальную массу (ОБМ) и наличие микроорганизмов в диагностически значимых количествах (таблица). Интерпретация полученных данных проводилась следующим образом: абсолютный нормоценоз – состояние микрофлоры, при котором доля Lactobacillus spp. составляет более 80% по отношению к общему количеству бактерий, количество Ureaplasma spp., M. hominis – менее 104 ГЭ/мл; условный нормоценоз – доля Lactobacillus spp. в составе общей бактериальной массы более 80%, но количество Ureaplasma spp., M. hominis – более 104 ГЭ/мл; анаэробный и аэробный дисбиоз – дисбаланс микробиоты, обусловленный одним или несколькими условно-патогенными микроорганизмами, в количестве более 10–20% по отношению к ОБМ, и долей Lactobacillus spp. менее 80%; смешанный дисбиоз – сочетание анаэробной и аэробной бактериальной флоры, а также нередко Candida spp. на фоне снижения количества Lactobacillus spp. Наличие Candida spp. может быть на фоне как сохраненной нормофлоры, так и дисбиоза. Чувствительность метода составляет 99%, специфичность – 93%.
Мазки шейки матки для цитологического исследования окрашивали по Папаниколау и оценивали по классификации Бетесда (The Bethesda System). Для выявления HSIL чувствительность теста – 71%, специфичность – 74%.
Статистический анализ данных выполнен с помощью статистических пакетов SAS 9.4, Statistica 12 и IBM-SPSS-24. При анализе количественных признаков проводилась проверка на нормальность распределения, вычисляли среднее арифметическое (М), стандартное отклонение (SD), дисперсию и 95% доверительный интервал (ДИ). При оценке качественных показателей вычислялись фактические и процентные частоты наблюдений (n, %).
Результаты исследования
Возраст обследованных 682 беременных женщин с ВПЧ варьировал от 21,3 до 44,5 года. Средний возраст пациенток составил 29,8±5,21 (95% ДИ: 28,1–31,4) года. Возраст менархе варьировал от 11 до 18 лет и в среднем был 13,1±1,40 (95% ДИ: 12,7–13,6) года. Срок беременности при включении в исследование в среднем составил 28,7±4,00 (95% ДИ: 27,4–29,9).
В данной когорте 45,8% (312/682) пациенток были первородящими, 54,2% (370/682) – повторнородящими. Среднее количество родов в анамнезе на одну беременную составило 0,44±0,55 (95% ДИ: 0,27–0,61). Аборты в прошлом имели 19,7% пациенток, выкидыши – 22,1%, среднее число абортов на одну женщину – 0,27±0,45 (95% ДИ: 0,13-0,41), выкидышей – 0,37±0,70 (95% ДИ: 0,15–0,59).
При включении в исследование у пациенток обнаружены преимущественно высокоонкогенные типы ВПЧ: 16 – у 30,8% (210/682), другие (суммарно) – у 57,5% (392/682). ВПЧ низкого онкогенного риска выявлены у 11,7% (80/682) пациенток.
Из общего числа обследованных у 38,7% (264/682) был дисбиоз влагалища. Его рецидивирующее течение во время настоящей беременности отмечено у 48,1% (127/264), что среди всех обследованных составило 18,6%. До включения в исследование во время настоящей беременности эти пациентки имели 1–2 эпизода дисбиоза и были пролечены антимикробными средствами согласно российским клиническим рекомендациям.
В данной когорте пациенток не имели в прошлом гинекологических заболеваний 42,5% (54/127). На наличие заболеваний шейки матки в анамнезе указали 22,1% (28/127) пациенток, на воспалительные заболевания матки и придатков – 20,5% (26/127), гормонально-зависимые заболевания – 9,5% (12/127). Соматически здоровы были 28,4% (36/127) пациенток, тяжелых экстрагенитальных заболеваний не было отмечено ни у одной.
Большинство пациенток с рецидивирующим течением дисбиоза имели в прошлом ИППП – 59,1% (75/127) и/или неспецифические инфекции – 79,5% (101/127). Рецидивы последних в анамнезе (до настоящей беременности) чаще отмечали пациентки с БВ в сочетании с АВ – 23,8% (24/101), несколько реже – с изолированным БВ – 14,9% (15/101) и в сочетании с ВВК – 11,9% (12/101).
В настоящем исследовании выявлено, что рецидивирующий дисбиоз у беременных женщин с ВПЧ не всегда сопровождался клиническими проявлениями. Жалобы на наличие умеренных или сильных патологических выделений предъявляли 65,4% (83/127) пациенток, в том числе неприятного запаха – 41,7% (53/127), зуда и жжения – 51,2% (65/127). У остальных – дисбиоз имел бессимптомное течение (34,6%). При объективном осмотре воспалительные проявления имели место у трети пациенток – 30,7% (39/127).
У 67,7% (88/127) пациенток значения рН были за пределами нормальных значений (от 2,0 до 8,0) со средним значением 4,53±1,62 (95% ДИ: 4,04–5,02).
В структуре рецидивирующего дисбиоза влагалища у беременных женщин, инфицированных ВПЧ, по данным микроскопии мазка и фемофлор-16 БВ обнаружен у 34,7% (44/127) пациенток, БВ в сочетании с АВ – у 44,1% (56/127), БВ с ВВК – у 18,1% (23/127), БВ, АВ и ВВК – у 3,2% (4/127). Суммарная частота смешанных инфекций составила 65,4% (83/127).
При микроскопии влагалищного мазка количество лейкоцитов колебалось от 8 до 50 в поле зрения, что соответствовало 3+ и 4+ степени. Микроскопия мазков влагалищного секрета показала, что для АВ у беременных было характерно отсутствие базальных и парабазальных клеток.
На этом фоне по данным фемофлор-16 у всех пациенток выявлено преобладание концентрации ДНК G. vaginalis и/или A. vaginae над концентрацией ДНК Lactobacillus spp.
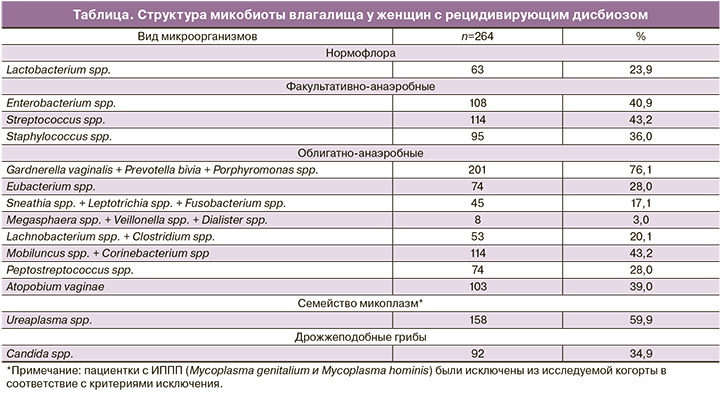
В таблице представлена структура микробиоты влагалища у пациенток исследуемой когорты.
Наиболее частым при БВ было сочетание Gardnerella vaginalis с Atopobium vaginae и Ureaplasma spp., Gardnerella vaginalis и Ureaplasma spp., Gardnerella vaginalis с Mobiluncus spp. и Corinebacterium spp.
При этом при БВ и АВ преобладали Gardnerella vaginalis, Atopobium vaginae, Mobiluncus spp. в сочетании с Streptococcus spp. и Staphylococcus saprophyticus; при БВ и ВВК – Gardnerella vaginalis и Candida spp.; при БВ, АВ и ВВК – Gardnerella vaginalis, Enterobacterium spp., Candida spp.
Цервикальные интраэпителиальные изменения были обнаружены у каждой четвертой пациентки – 25,2% (32/127), при этом клетки плоского эпителия с атипией неясного значения (atypical squamous cells undertermined significance – ASC-US) встречалась с частотой 12,6%, плоскоклеточные интраэпителиальные поражения низкой степени риска (low grade squamous intraepithelial lesion – LSIL) – 11,8%, высокой степени риска (high grade squamous intraepithelial lesion – HSIL) – 0,8%.
Особенности эпителия, обозначаемые ASC-US, свидетельствуют о реактивных изменениях в клетках шейки матки и косвенно – о воспалительной реакции (вызванной аэробной, в том числе – в сочетании с анаэробной инфекцией и/или грибами).
Обсуждение результатов
В настоящее время «дисбиоз» рассматривается как изменение количественного и качественного состава, а также свойств локальной микрофлоры [8] и включает в себя не только БВ, но и другие неспецифические инфекции. Особую актуальность приобретает проблема рецидивирующего течения вагинальных инфекций. Так, в течение первых 3 мес после лечения рецидивы БВ у небеременных возникают у 15–30% пациенток и у 52% – в течение года [9].
Учитывая полимикробный характер заболевания у большинства обследованных женщин в настоящем исследовании, особое значение приобретала оценка микробиоты влагалища и выявление всего спектра условно-патогенных микроорганизмов.
Прежде всего, с помощью микроскопии мазка мы проводили анализ состояния микробиоценоза во влагалище и оценку воспалительной реакции. Однако известно, что этот метод обладает низкой чувствительностью, а результаты его отличаются субъективностью. Возможности световой микроскопии не позволяют выявить большинство морфотипов бактерий и дать им количественную оценку. Кроме того, большое количество клинически значимых факультативно-анаэробных бактерий однотипны, например, такие как колиформные палочки или грамположительные кокки, которые можно принять за «доминирование лактоморфотипов» и которые не могли рассматриваться нами как состояние нормы. Некоторые клинически значимые микроорганизмы, например Atopobium vaginae, способствующие развитию рецидивирующих дисбиотических нарушений, бактериального вагиноза и его осложнений, не имеют специфических микроскопических признаков и выглядят под микроскопом как коринобактерии, часто встречающиеся у здоровых женщин.
Сведения о состоянии микробиоценоза влагалища были получены путем исследований фемофлор-16 – метода ПЦР в реальном времени, одного из самых чувствительных и специфичных [10]. Принципиально, что такое исследование позволило не просто установить факт наличия/отсутствия в клиническом материале возбудителя, а выявить клинически значимые количественные соотношения компонентов нормальной и условно-патогенной микрофлоры. Использование цветовых маркеров и комментариев в форме выдачи результатов позволило быстро и полноценно оценить результаты исследования.
Исследования фемофлор-16 оказались особенно информативны для выявления трудно культивируемых, некультивируемых и персистирующих форм бактерий, которые встречаются при хронических и рецидивирующих инфекциях, что было принципиально в настоящем исследовании.
Так, анаэробный дисбиоз характеризовался доминированием облигатно-анаэробных микроорганизмов, в том числе Atopobium vaginae, который проявляет резистентность к метронидазолу и рассматривается как маркер рецидивирующих процессов. Также характерным было обнаружение клинически значимых количеств Ureaplasma spp. и крайне низкое количество лактобактерий.
Связь между ВПЧ и дисбиозом была показана в исследованиях многих авторов [4, 5, 11–13]. Подчеркивается, что состояние биоценоза влагалища при наличии ВПЧ характеризуется уменьшением численности Lactobacillus spp. и повышенным содержанием анаэробов по сравнению с отсутствием ВПЧ [11], что совпадает с полученными в настоящем исследовании результатами. И наоборот, женщины с микробиотой, в которых доминирует Lactobacillus spp., реже имеют ВПЧ-инфекцию по сравнению с женщинами с более разнообразной микробиотой, состоящей из смесей анаэробов, включая виды родов Gadnerella vaginalis, Atopobium vaginae и Prevotella spp. [12].
Расчет отношения шансов (OШ), выполненный в мета-анализе (12 исследований; 6372 женщин) показал положительную связь между БВ и ВПЧ-инфекцией (ОШ=1,43; 95% доверительный интервал (ДИ) 1,11–1,84) [4]. Хотя механизмы этих ассоциаций не полностью поняты, предполагается, что задействованы вагинальные сообщества бактериальных комменсалов и адаптивные/врожденные иммунные системы хозяина [11, 13].
Мы выявили, что для БВ в сочетании с АВ у беременных характерно отсутствие базальных и парабазальных клеток в вагинальных мазках, что является типичным признаком АВ у небеременных. На эту же особенность обращают внимание G.G. Donders с соавт. и объясняют это высоким содержанием эстрогенов у беременных женщин [14].
В литературе также отмечаются потенциальные механизмы участия вагинальной микробиоты в развитии цервикальной интраэпителиальной неоплазии (LSIL и HSIL) и рака шейки матки [15]. В настоящем исследовании цервикальные интраэпителиальные изменения были обнаружены у каждой четвертой пациентки, при этом ASC-US встречалась с частотой 12,6%, LSIL – 11,8%, HSIL – 0,8%. Для сравнения: из 11 906 беременных женщин с ВПЧ, но без указания на наличие сопутствующих инфекций были обнаружены изменения ASC-US у 9,5%, LSIL – у 1,9% и HSIL – у 0,6% [13]. Установлено, что для пациенток с доброкачественными изменениями эпителия шейки матки характерна исходно высокая частота сопутствующих нарушений биоценоза влагалища, в том числе БВ (44,6%) и вагинита (26,8%) [16]. В настоящем исследовании частота LSIL была выше в 6 раз по сравнению с исследованием P. Mongelos с соавт. [16]. Это указывает на возможное влияние условно-патогенной микрофлоры влагалища на персистенцию ВПЧ в клетках эпителия шейки матки и развитие интраэпителиальных неоплазий низкой степени риска.
Ранее мы показали, что устранение дисбиоза влагалища и восстановление нормальной микрофлоры способствует исчезновению воспалительной реакции шейки матки и редукции ASC-US у 100% пациенток, однако частота интраэпителиальных поражений шейки матки, вызванных персистенцией ВПЧ (LSIL и HSIL), не изменяется под влиянием терапии дисбиоза [17].
Заключение
Таким образом, у ВПЧ-положительных беременных женщин имеет место высокая частота дисбиоза влагалища (38,7%), который характеризуется у большинства из них рецидивирующим течением (48,1%).
У 34,6% беременных женщин с ВПЧ дисбиоз имеет бессимптомное течение. При рецидивах дисбиоза во II и III триместрах средние значения рН составляют 4,53±1,62, наблюдается преимущественно смешанное инфицирование условно-патогенными микроорганизмами в различных сочетаниях (65,4%), с преобладанием анаэробно-аэробных (44,1%). При наличие аэробных микроорганизмов характерно отсутствие базальных и парабазальных клеток. Цервикальные интраэпителиальные изменения имеют место у каждой четвертой пациентки преимущественно низкого риска.



