Частота гестационных гипертензивных расстройств составляет 10% всех беременностей. Ежегодно во всем мире более пятидесяти тысяч женщин погибают в период беременности из-за осложнений, связанных с артериальной гипертензией (АГ). Распространенность таких симптомов, как АГ, отеки, протеинурия среди беременных в Российской Федерации в 2015 году составила 6,91% [1].
Клиницисты выделяют две формы преэклампсии (ПЭ): ранняя и поздняя ПЭ, которые различаются тяжестью течения и исходами для матери и плода [2].
Если при тяжелой поздней ПЭ тактика определена и сводится к незамедлительному родоразрешению, то при раннем течении ПЭ вопрос возможности пролонгирования беременности остается весьма дискуссионным. Для прогнозирования гипертензивных осложнений изучаются предикторы ПЭ, такие как про- и антиангиогенные факторы: эндоглин, плацентарный фактор роста (PlGF), sFlt-1 (растворимая fms-подобная тирозинкиназа 1) [3].
В контексте маркеров и предикторов ПЭ на данный момент остаются неизученными новые иммунологические активаторы, обладающие выраженным провоспалительным действием – митохондриальные молекулы, ассоциированные с повреждением (МАСП), циркулирующие в фетоплацентарном кровотоке, и предположительно влияющие на степень тяжести АГ и ПЭ во время беременности [4].
Митохондрии – это двумембранные органеллы, которые являются энергетическими станциями клетки. Митохондриом клетки является динамичной структурой: слияние и фрагментация митохондрий происходит под воздействием внешних и внутренних сигналов, что помогает поддерживать адекватную их функциональную активность. Из потенциальных митохондриальных МАСП белок ОРА1 является важнейшим участником множества процессов не только в митохондриях, но и в клетке в целом. Главной его функцией является реализация слияния внутренних митохондриальных мембран. Кроме этого, ОРА1 участвует в защите клетки от апоптоза, в регуляции уровня кальция и даже взаимодействии с митохондриальной ДНК (мтДНК) [5–7]. ОРА1 состоит из двух доменов: трансмембранного и внешнего, обращенного в межмембранное пространство митохондрий. При изменении внешних условий или активации внутриклеточного сигналинга может происходить расщепление цельной формы ОРА1 (которую принято обозначать OPA1-L) с образованием водорастворимой короткой формы – OPA1-S. Доказано, что превалирование последней свидетельствует об усилении слияния фрагментации митохондрий, в то время как увеличение содержания OPA1 L-формы говорит об их слиянии. Фрагментация митохондрий часто является следствием ответа на внешние и внутренние сигналы – гипоксию, окислительный стресс – и предшествует элиминации митохондрий [8]. Отношение OPA1-L к OPA1-S является индексом, отражающим превалирование одного из этих процессов.
Другим митохондриальным белком в данной работе является TFAM, важнейший участник репликации и транскрипции мтДНК. В клетке различают две формы белка TFAM: цитоплазматическую (pre-TFAM) и митохондриальную (TFAM). Цитоплазматическая форма является предшествующей зрелой митохондриальной форме, которая выступает функционирующим белком и центральной фигурой молекулярной машинерии митохондрий. После импорта через внешнюю и внутреннюю митохондриальные мембраны происходит образование зрелой формы TFAM. Далее белок оказывается вовлеченным в поддержание структуры мтДНК – привлечение факторов транскрипции и митохондриальной РНК-полимеразы для последующей транскрипции, а также регуляции копийности мтДНК, что особенно важно для поддержания адекватного уровня функциональной активности митохондрий.
Изучение экспрессии митохондриальных белков (ОРА1, VDAC, TFAM) во фракции микровезикул из плазмы крови женщин с синдромами ПЭ и хронической/гестационной АГ поможет не только в поисках прогностических маркеров данных патологий, но и в осознании фундаментальных механизмов течения этих заболеваний.
Материал и методы исследования
Все беременные женщины были разделены на 4 группы – без гипертензивных нарушений (I группа – контроль, n=25), с хронической/гестационной АГ (II группа, n=16), умеренной ПЭ (III группа, n=9) и тяжелой ПЭ (IV группа, n=8). Оценивались анамнестические данные и корреляции лабораторных показателей.
Нами был проведен сравнительный анализ количественного и качественного (TFAM, OPA1, VDAC1) состава митохондриальных белков, возможных МАСП, из плазмы пациенток с ПЭ и хронической/гестационной АГ, а также здоровых женщин. Исследовались также стандартные показатели, такие как печеночные ферменты, лактатдегидрогеназа, креатинин, количество лейкоцитов, а также специфические маркеры, характерные для т.н. «больших акушерских синдромов» – PlGF, sFlt-1.
Для выделения микровезикул венозную кровь центрифугировали при 3000 g в течение 15 минут, плазму отбирали и центрифугировали 30 минут на скорости 10000 g. Осадок ресуспендировали в фосфатном буфере и повторно центрифугировался при тех же условиях. Далее к осадку добавляли буфер для нанесения образцов на гель.
В качестве возможных МАСП при изучении состава микровезикул из плазмы пациенток были выбраны митохондриальные белки ОРА1 (2 формы: ОРА1-L и ОРА1-S), TFAM, а также его цитоплазматический предшественник – pre-TFAM. Исследование проводилось методом Вестерн-блот анализа с дальнейшей детекцией хемилюминесценции, как описано в нашей ранней работе [9]. Нормирование сигнала изучаемых белков проводили на сигнал мажорного белка митохондриальной мембраны – VDAC1. Данные представлены в виде среднего ± стандартная ошибка среднего. Статистический анализ проводили в программе Prism 7.0 (Graph Pad, США) и Statistica 6.0 (StatSoft, США) с использованием теста Колмогорова–Смирнова, теста Манна–Уитни и корреляционного анализа по Пирсону. Различие между группами считали статистически достоверным при уровне значимости p<0,05.
 Результаты исследования и их обсуждение
Результаты исследования и их обсуждение
Тяжелая форма ПЭ развилась у 6 повторно беременных и у 2 первобеременных. В группах с хронической/гестационной АГ, умеренной ПЭ различий в связи с паритетом родов не наблюдалось (хроническая/гестационная АГ развилась у 6 повторно беременных женщин, умеренная ПЭ – у 4 повторно беременных из 9).
Часто встречающимся осложнением беременности была анемия беременных, которая зарегистрирована во всех группах с примерно одинаковой частотой: у 9 женщин (36%) в I группе, у 7 женщин (43%) во II группе, у 5 (55%) женщин во III группе и у 3 (37,5%) женщины в IV группе.
Нарушение ремоделирования спиральных артерий и плацентации вследствие недостаточной инвазии трофобласта приводит к возникновению генерализованной эндотелиальной дисфункции. Вследствие гипоксии плаценты происходит избыточное высвобождение антиангиогенных белков в материнский кровоток, усиливается процесс апоптотической гибели клеток плаценты, что, в свою очередь, приводит к повышению уровней печеночных ферментов, щелочной фосфатазы, лактатдегидрогеназы в кровотоке женщин с тяжелой ПЭ (6 случаев (75%)), тогда как в остальных группах в большинстве случаев эти показатели не превышали нормативных значений. Также в исследуемых группах, помимо гипертензионных осложнений, встречался и синдром задержки роста плода (СЗРП) – в 25% случаев (n=4) в группе с хронической/гестационной АГ, в 11% случаев (n=1) в группе с умеренной ПЭ, и в 37,5% случаев (n=3) в группе с тяжелой ПЭ. В контрольной группе СЗРП не выявился.
При ПЭ повышенный синтез sFlt-1 приводит к снижению уровня свободно циркулирующего PlGF. В норме плацента продуцирует малые количества PlGF и его антагониста sFlt-1, и тем не менее, в контрольной группе в 8 случаях (32%) было отмечено незначительное увеличение соотношения sFlt-1/PLGF, что, однако, не сопровождалось развитием гипертензивных осложнений во время беременности. В группе с хронической/гестационной АГ выявлено 2 случая (12,5%) увеличения соотношения sFlt-1/PLGF, в группе с умеренной ПЭ – 6 случаев (66,6%), в группе с тяжелой ПЭ – 6 случаев (75%).
Нами была обнаружена положительная статистически значимая корреляция sFlt-1/PLGF и уровня печеночных ферментов (аланинаминотрансфераза, аспартатаминотрансфераза) у всех пациенток исследуемых групп: коэффициент корреляции составил r=0,94 (по Пирсону) при р=0,0001, а также корреляция sFlt-1/PLGF и уровня креатинина при рассмотрении всех пациенток исследуемых групп: коэффициент корреляции составил r=0.65 (по Пирсону) при р=0,009.
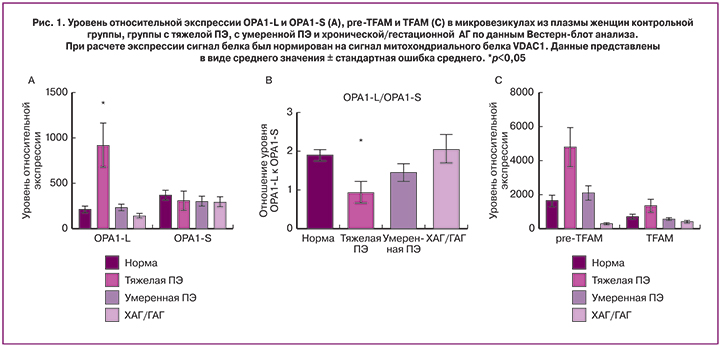
В ходе исследования микровезикулярной фракции, полученной из плазмы крови женщин, мы обнаружили, что экспрессия короткой формы ОРА1-S не имела достоверных отличий во всех группах (рис. 1А). При анализе цельной формы ОРА1-L были обнаружены статистически значимые различия в содержании белка OPA1-L у пациенток с тяжелой ПЭ: уровень OPA1-L в данной группе возрастает четырехкратно по сравнению с контрольной и другими группами (рис. 1А). Это свидетельствует о том, что в микровезикулы оказываются включены митохондрии, которые, возможно, являются частью развитой цельной митохондриальной сети. Это может быть сигналом, как о состоянии плаценты, так и о возможных осложнениях со стороны плода.
Интересно, что при анализе отношение ОРА1-L к ОРА1-S (рис. 1В) мы получили значимое снижение данного индекса в группе тяжелой ПЭ, что говорит о превалировании процесса слияния митохондрий над фрагментаций во фракции микровезикул плазмы крови. Это подтверждает нашу гипотезу о включении в микровезикулы активно объединяющихся митохондрий. В группе тяжелой ПЭ наблюдалось повышение экспрессии обеих форм белка TFAM по сравнению с контрольной группой, однако различия не были не достоверны (рис. 1С).
Группой исследователей из Китая в 2015 году была выдвинута гипотеза о том, что митохондриальные МАСП могут вызвать повреждение почек и протеинурию из-за своей способности стимулировать иммунные клетки для выработки цитокинов, которые способны повреждать клеточные структуры ткани почек. Цитокины могут индуцировать повреждения гломерулярных эндотелиальных клеток, что приводит к увеличению проницаемости клубочков и вызывает протеинурию. Известно, что цитокины обладают повреждающей способностью в отношении подоцитов, что также приводит к появлению белка в моче [10].
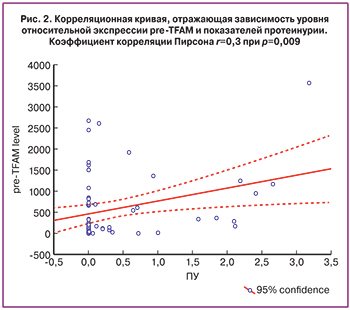
Нами была подтверждена положительная статистически значимая корреляция содержания белка pre-TFAM, который является цитоплазматическим предшественником митохондриального TFAM, и уровня протеинурии при рассмотрении всех пациенток из исследуемых групп: коэффициент корреляции составил r=0,3 (по Пирсону) при р=0,009 (рис. 2). Таким образом, учитывая важность протеинурии при диагностике ПЭ, можно сделать вывод, что определение содержания pre-TFAM в микровезикулах плазмы крови может стать диагностически значимым при лечении тяжелой ПЭ.
Достоверное повышение ОРА1-L и pre-TFAM в группе пациенток с тяжелой ПЭ дает основание отнести данные молекулы к группе МАСП, ассоциированных с ПЭ, что открывает возможности дальнейшего изучения патогенеза ПЭ.



