Комменсальные генитальные микоплазмы, к числу которых относятся Mycoplasma hominis (M. hominis), Ureaplasma parvum (U. рarvum) и Ureaplasma urealyticum (U. urealyticum), часто колонизируют урогенитальный тракт женщины и, как правило, не ассоциированы с инфекциями урогенитального тракта у небеременных женщин [1, 2]. Распространенность M. hominis, U. urealyticum и U. parvum среди небеременных женщин связана с сексуальной активностью и варьирует в пределах 3–15, 5–20 и 20–90% соответственно [1, 2]. На сегодняшний день в международном научном сообществе в отношении небеременных женщин сформировался консенсус: ввиду отсутствия доказательств роли комменсальных микоплазм в развитии урогенитальных инфекций и их осложнений тестирование и, соответственно, лечение в данной популяции не рекомендуются [1, 2]. Недавнее крупное исследование среди небеременных женщин, направленное на анализ связи между комменсальными микоплазмами и урогенитальными симптомами и проведенное с учетом сопутствующих урогенитальных инфекций, таких как бактериальный вагиноз (БВ), кандидозный вульвовагинит и инфекции, передаваемые половым путем (ИППП), убедительно показало, что M. hominis ассоциирована с урогенитальными симптомами только у женщин с БВ, тогда как U. urealyticum и U. parvum не связаны с какими-либо урогенитальными симптомами, вне зависимости от БВ [2]. Таким образом, данное исследование еще раз подчеркнуло, что клиническую значимость комменсальных генитальных микоплазм необходимо рассматривать только в контексте сопутствующих урогенитальных инфекций, в первую очередь БВ [1, 2].
В то же время в популяции беременных женщин комменсальные генитальные микоплазмы предположительно имеют этиологическую связь с некоторыми неблагоприятными перинатальными исходами. Основаны эти предположения главным образом на том, что микоплазмы (в первую очередь уреаплазмы) являются самыми часто выявляемыми микроорганизмами в амниотической полости женщин с внутриамниотической инфекцией (ВАИ) [3, 4]. ВАИ ассоциирована с рядом осложнений беременности, таких как преждевременные роды (ПР) [5, 6], преждевременное излитие околоплодных вод (ПИОВ) [7], истмико-цервикальная недостаточность (ИЦН) [8], клинически выраженный хориоамнионит [3]. Далее накапливаются данные, свидетельствующие о значительном вкладе ВАИ в развитие бронхолегочной дисплазии у новорожденных (главным образом недоношенных) [9, 10]. В то же время многочисленные клинические исследования ассоциации комменсальных микоплазм с неблагоприятными перинатальными исходами, суммированные недавно в ряде метаанализов [11–14], не дают однозначного ответа на вопрос о независимой связи комменсальных микоплазм с осложнениями беременности. В условиях такой неопределенности российские и международные профессиональные сообщества демонстрируют разнонаправленность рекомендаций. Согласно российской нормативной базе (Клинические рекомендации Российского общества дерматовенерологов и косметологов и Российского общества акушеров-гинекологов, 2016), тестирование на Ureaplasma spp. и M. hominis рекомендуется при наличии признаков воспаления в урогенитальном тракте и дисбиотических нарушений вагинальной микробиоты в отсутствие патогенных возбудителей [15]. Показаниями к лечению являются выявление микоплазм/уреаплазм в количестве >104 КОЕ (ГЭ)/мл и наличие клинико-лабораторных признаков инфекции в отсутствие ИППП. Женщины с бесплодием и невынашиванием беременности в анамнезе подлежат обследованию и лечению вне зависимости от симптомов. Для лечения применяют доксициклин (не используют при беременности) или джозамицин [15]. Международные клинические рекомендации не рассматривают вопрос о скрининге/тестировании на комменсальные генитальные микоплазмы во время беременности ввиду недостаточности и противоречивости доказательной базы. Тестирование и лечение небеременных женщин не рекомендуются [1].
В последние годы дискуссия о целесообразности эрадикации уреаплазм с целью профилактики ассоциированных с ВАИ осложнений беременности получила новый импульс. Связано это с получением новых данных экспериментальных и клинических исследований. Более того, в ряде работ было показано, что включение препаратов, активных в отношении уреаплазм и обладающих хорошей способностью проникать через плаценту, в схемы терапии ассоциированных с ВАИ осложнений беременности приводит к улучшению перинатальных исходов [16–18].
Целью данной работы был анализ результатов исследований последних лет о роли комменсальных микоплазм в индукции неблагоприятных исходов беременности с фокусом на роли уреаплазм в развитии ВАИ. В обзоре суммированы результаты метаанализов ассоциации комменсальных микоплазм с неблагоприятными перинатальными исходами, проанализированы данные экспериментальных и клинических исследований, посвященных вопросам патогенеза и лечения ассоциированной с уреаплазмами ВАИ.
Результаты метаанализов исследований ассоциации комменсальных генитальных микоплазм с неблагоприятными перинатальными исходами
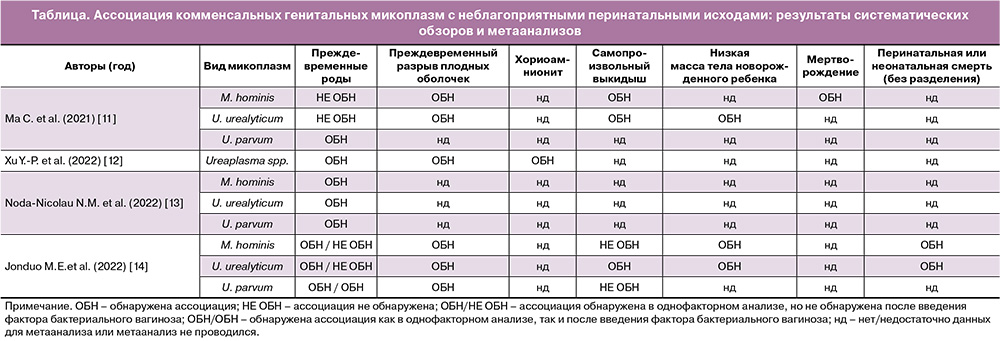
В последние несколько лет был опубликован ряд метаанализов относительно ассоциации между комменсальными генитальными микоплазмами и неблагоприятными исходами беременности, такими как ПР, ПИОВ, хориоамнионит, низкая масса тела новорожденного ребенка, самопроизвольный выкидыш, перинатальная или неонатальная смерть [11–14] (табл. 1). Анализ Ма С. et al. (2021) не выявил связи между M. hominis и U. urealyticum и ПР; тогда как U. parvum были ассоциированы с ПР [11]. Авторы также показали, что M. hominis и U. urealyticum являются потенциальными факторами риска самопроизвольного выкидыша и ПИОВ. Кроме того, M. hominis были связаны с мертворождением, а U. urealyticum – низкой массой тела новорожденного ребенка. Xu Y.-P. et al. (2022) обнаружили связь уреаплазм (без видовой дифференциации) с ПР, преждевременным разрывом плодных оболочек и хориоамнионитом [12]. Noda-Nicolau N.M. et al. (2022) также обнаружили связь между всеми тремя видами комменсальных микоплазм и ПР [13]. Наиболее масштабное исследование было выполнено Jonduo M.E. et al. (2022) [14]. Метаанализ включил 57 прошедших оценку качества исследований, проведенных в последние 50 лет, и обнаружил связь комменсальных микоплазм с рядом неблагоприятных исходов беременности (таблица). Для ПР был проведен дополнительный анализ, учитывающий фактор БВ, и в этом анализе только U. parvum показали независимую от БВ связь с ПР (для остальных неблагоприятных исходов анализ с учетом фактора БВ не проводился ввиду отсутствия таких исследований). Авторы подчеркнули, что имеющиеся на сегодняшний день данные не позволяют сделать однозначные выводы о роли комменсальных микоплазм, отдельно или в сочетании с БВ, в неблагоприятных исходах беременности и родов, и необходимы дальнейшие исследования, в которых неблагоприятное влияние микоплазм на течение и исходы беременности должно рассматриваться в контексте вагинальной микробиоты.
Уреаплазмы и внутриамниотическая инфекция
Факторы риска внутриамниотической инфекции, ассоциированной с Ureaplasma spp.
Уреаплазмы являются самыми часто выявляемыми микроорганизмами в амниотической полости женщин с ВАИ [3, 4]. Первое исследование, выявившее связь между обнаружением уреаплазм во влагалище и хориоамнионитом, было опубликовано около полувека назад [19]. Впоследствии в целом ряде работ исследования образцов плаценты показали, что в большинстве случаев (до 100% в некоторых исследованиях) плаценты, колонизированные Ureaplasma spp., имели гистологические признаки хориоамнионита [20]. В то же время уреаплазмы выявляются, хотя и значительно реже, в плацентах без гистологических признаков хориоамнионита, а также в амниотической жидкости в отсутствие признаков ВАИ, что усложняет установление этиологической вовлеченности этих бактерий в ВАИ. Хотя исторически уреаплазмы рассматривались как слабые иммуногены, измерение маркеров иммунного ответа на инфекцию, обусловленную уреаплазмами, в амниотической жидкости у женщин с ВАИ [21] или в эксплантах хориодецидуальной ткани [22] свидетельствует об их способности индуцировать в некоторых случаях сильный иммунный ответ в плаценте. Проблемы с установлением независимой этиологической роли уреаплазм в развитии ВАИ связаны также с рядом других факторов, к наиболее важным из которых относится частый полимикробный характер этой инфекции [3].
Результаты большинства исследований свидетельствуют, что сама по себе колонизация влагалища уреаплазмами не является предиктором неблагоприятных исходов беременности. На сегодняшний день остается неясным, почему у одних женщин, колонизированных Ureaplasma spp., беременность сопровождается осложнениями, а у других – нет. Ввиду высокой клинической актуальности вопрос о роли Ureaplasma spp. в развитии ВАИ и ассоциированных осложнений беременности вызывал и вызывает неизменный интерес исследователей. В качестве возможных причин различий в перинатальных исходах изучались вирулентные свойства разных видов/серотипов уреаплазм (U. parvum включает серовары 1, 3, 6 и 14, U. urealyticum – серовары 2, 4, 5, 7–13) [23–25]), бактериальная нагрузка микроорганизма в амниотической жидкости или влагалище [26, 27], сопутствующие микроорганизмы в плаценте и влагалище [28], и результаты исследований зачастую противоречили друг другу. Так, в недавних исследованиях группы ученых из Австрии было показано, что колонизация влагалища на ранних сроках беременности U. parvum была значимым фактором риска ПР, тогда как колонизация U. urealyticum – нет [24]; при этом колонизация серотипом 3 U. parvum, но не серотипами 1 и 6, была достоверно связана с ПР на раннем и экстремально раннем сроке гестации [23]. В то же время в одном из ранних исследований связи между видами уреаплазм и неблагоприятными перинатальными исходами не выявили [25].
Еще более противоречивы результаты исследований о клинической значимости определения количества уреаплазм для прогнозирования осложнений беременности. Так, в работе Kasper D.C. et al. (2010) повышенное количество U. parvum в амниотической жидкости было ассоциировано с гистологическими признаками хориоамнионита, ПИОВ при ПР, ранним сепсисом и бронхолегочной дисплазией у ребенка; кроме того, наблюдалась положительная корреляция между количеством U. parvum и степенью воспалительной реакции внутри амниотической полости [26]. Количество ДНК U. urealyticum также коррелировало с уровнем воспалительного цитокина TNF-α в исследовании Jacobsson B. et al. (2010) [27]. В то же время в исследовании Kacerovsky M. et al. (2014) высокая концентрация ДНК Ureaplasma spp. и M. hominis в пуповинной крови при беременности, осложненной ПИОВ, не была связана с сильной воспалительной реакцией плода [29]. В недавнем исследовании Oliveira C. et al. (2020) были проанализированы цервикальные образцы и образцы плаценты у женщин с самопроизвольным выкидышем, обнаружена связь между U. parvum (но не U. urealyticum и M. hominis) в плаценте и выкидышем; в то время как выявление этих трех видов в цервикальном канале не предсказывало выкидыш [30]. Далее, концентрации U. parvum, U. urealyticum и M. hominis в плаценте женщин с выкидышем были значительно выше, чем в контрольной группе, однако подобная закономерность для цервикальных образцов была выявлена только для U. parvum [30]. Kacerovsky M. et al. (2022) не выявили различий в количестве ДНК Ureaplasma spp. в цервикальных образцах у женщин с ВАИ, без ВАИ и со стерильным внутриамниотическим воспалением [31]. Исследование Sweeney E.L. et al. (2017) показало, что обнаружение Ureaplasma spp. как в недоношенных, так и в доношенных плацентах было связано с гистологическими признаками хориоамнионита в любом сроке гестации; при этом авторы не выявили связи между частотой или тяжестью гистологических признаков хориоамнионита и количеством уреаплазм в плаценте, их видом/сероваром, этнической принадлежностью женщин [32].
Уреаплазмы, как и все представители класса Mollicutes, не имеют клеточной стенки и связанных с ней факторов вирулентности, таких как липополисахариды у грамотрицательных бактерий. Несмотря на это, уреаплазмы обладают несколькими специфическими факторами вирулентности, наиболее важными из которых на сегодняшний день считаются уреаза и описанный относительно недавно липопротеин MBA (multiple banded antigen) [20].
Уреаза является ключевым фактором вирулентности многих бактерий, утилизирующих мочевину, среди которых Escherichia coli, Proteus mirabilis, Klebsiella pneumoniae и Klebsiella aerogenes. Однако Ureaplasma spp. – один из немногих видов бактерий, которые продуцируют уреазу, но лишены способности ассимилировать аммоний в глутамин или глутамат, что потенциально объясняет очень высокую внутриклеточную концентрацию аммония у этих микроорганизмов [33]. В опытах на овцах было показано увеличение концентрации аммония во время уреаплазменной инфекции, приводящее к повышению рН в амниотической жидкости и легочной жидкости плода, что даже в отсутствие воспаления может приводить к поражению легких [34]. Наблюдение за пациентами, у которых после трансплантации легких развилась гипераммониемия, выявило системную уреаплазменную инфекцию (уреаплазмы в крови или бронхоальвеолярной жидкости); при этом у пациентов с нормальным уровнем аммония уреаплазмы не выявлялись [33]. После направленной на эрадикацию уреаплазм антибиотикотерапии их синдромы разрешились [33]. В совокупности эти данные свидетельствуют о том, что такие же механизмы могут быть задействованы в поражении тканей легких плода при бронхолегочной дисплазии [9].
MBA – иммунодоминантный антиген уреаплазм и, как полагают, один из основных факторов вирулентности микроорганизма. MBA уникален для уреаплазм и не имеет гомологов среди других прокариот. Во время инфекции белок MBA распознается клетками хозяина и индуцирует выработку цитокинов, активируя фактор транскрипции NF-κB через Toll-подобные рецепторы 1, 2 и 6 [35]. Для MBA характерна вариабельность размера и фазы [35, 36]. Полагают, что вариации белка MBA уреаплазм могут играть важную роль в способности этих микроорганизмов модулировать иммунный ответ хозяина и быть фактором, способствующим установлению хронической бессимптомной внутриутробной инфекции, что подчеркивает необходимость дальнейшего изучения данного вопроса.
Результаты экспериментальных и клинических исследований
Роль уреаплазм в развитии ВАИ изучалась в многочисленных исследованиях: в in vitro моделях, в экспериментах на животных, в клинических работах. Среди исследований in vitro особого внимания заслуживает недавняя работа Tantengco O.A. et al. (2022) с использованием внедряемой в последние годы технологии «орган-на-чипе», которая представляет собой устройство из микроконтейнеров для выращивания различных клеточных культур: микроконтейнеры соединены микроканалами, и все вместе это может симулировать работу отдельных органов или систем органов [37]. Авторы установили модель восходящей инфекции U. parvum путем соединения в таком устройстве клеток эпителия влагалища, эктоцервикса, зоны трансформации, стромы цервикса, эндоцервикса и децидуальной оболочки. Инокуляция U. parvum в культуры клеток и измерение ряда маркеров цитотоксичности и иммунного ответа показали, что микроорганизм сам по себе не вызывает гибели клеток и массивного воспаления в клетках влагалища, шейки матки и децидуальной оболочки. Однако внесение в культуры клеток смеси уреаплазм и очищенного липополисахарида с целью мимикрии полимикробной инфекции приводило к повышению экспрессии некоторых маркеров. В дополнение к in vitro модели авторы провели эксперименты на беременных мышах. Инокуляция влагалища низкой дозой U. parvum не приводила ни к ПР, ни к гибели потомства, однако частота ПР и гибели потомства возрастала при повышении дозы микроорганизма (до 20 и 14% соответственно) или сочетании его с E. coli (до 25 и 53% соответственно). В то же время внутриамниотическая инъекция даже низкой дозы U. parvum увеличивала показатель ПР до 67% и гибели потомства – до 42% (в качестве контроля использовался фосфатно-солевой буфер, его введение в амниотическую полость не привело к неблагоприятным исходам ни в одном случае) [37]. Таким образом, если шейка матки сохраняет свою функциональную протективную роль, U. parvum сама по себе не способствует воспалению, приводящему к ПР, если только она не достигает амниотической полости, или если другие, более вирулентные микроорганизмы, например E. coli, не колонизируют влагалище [37].
Результаты данного исследования согласовались с данными Pavlidis I. et al. (2020), показавших в опытах на мышах, что инокуляция уреаплазмами здоровой шейки матки/влагалища приводила к ПР лишь в небольшом числе случаев (13%) [38]. Однако частота ПР увеличивалась до 28% при повреждении эпителия шейки матки (с этой целью использовали спермицид ноноксинол-9) или после прямой инокуляции уреаплазм внутрь амниотической полости.
Motomura K. et al. (2020) в опытах на мышах установили причинно-следственную связь между внутриамниотической инокуляцией уреаплазмами и ПР [18]. Были выявлены высокие показатели смертности новорожденных животных как у недоношенных, так и у доношенных. Геномный анализ штаммов уреаплазм не выявил связи между способностью вызывать ПР и известными факторами вирулентности микроорганизма. Все изоляты уреаплазм были способны индуцировать внутриамниотический воспалительный ответ, независимо от вводимой дозы, проникать в разные ткани плода, прежде всего в легкие, и вызывать синдром воспалительной реакции плода. Далее авторы провели эксперимент, нацеленный на оценку эффективности кларитромицина – макролида, недавно предложенного для лечения ВАИ [39, 40]. В качестве контроля использовали диметилсульфоксид (применялся как растворитель кларитромицина в опытной группе). Подкожное введение антибиотика привело к значительному повышению срока родоразрешения и снижению неонатальной смертности [18].
Большинство исследований на животных демонстрируют, что уреаплазмы обладают способностью индуцировать ВАИ и/или воспаление (ВАИ/В)после внутриутробной инокуляции возбудителя. В исследованиях на овцах тяжесть хориоамнионита, ассоциированного с уреаплазмами, варьировала в широких пределах и не зависела от количества уреаплазм в хориоамнионе во время родов; но при этом отмечалась некоторая связь с длительностью внутриамниотического воздействия уреаплазм [34, 41]. В попытке объяснить различия в тяжести хориоамнионита и выяснить, являются ли одни изоляты уреаплазм по своей природе более вирулентными, чем другие, амниотическую полость беременных овец инокулировали изолятами уреаплазм, выделенными из плацент других овец, как с гистологическими признаками тяжелого хориоамнионита («вирулентные» штаммы), так и без хориоамнионита («невирулентные» штаммы) [35, 41]. У всех животных, независимо от того, «вирулентными» или «невирулентными» штаммами они были инфицированы, развился хориоамнионит средней и тяжелой степени, и между животными не наблюдалось различий в экспрессии TLR-1, -2, -6, IL-1, -6, -8, IL-10 и TNF-α. Также было отмечено, что только часть инфицированных овец из каждой группы продуцировали сывороточный IgG в ответ на внутриутробную инфекцию уреаплазмами. Сравнение экспрессии цитокинов между животными с IgG и без IgG против уреаплазм показало значительно повышенный уровень IL-1, -6 и-8 в хориоамнионе животных с IgG к уреаплазмам. Кроме того, у животных с IgG амниотическая жидкость значительно чаще была окрашена меконием [35]. Это наблюдение согласовалось с ранними клиническими исследованиями, которые продемонстрировали, что пациенты с антителами к уреаплазмам имеют более высокий риск неблагоприятных исходов беременности и новорожденных, чем те, у кого не развивается гуморальный иммунный ответ [42]. В совокупности эти данные могут говорить о том, что штаммы уреаплазм, вероятно, не являются по своей природе вирулентными или невирулентными, а патогенез хориоамнионита в значительной степени определяется иммунным ответом хозяина.
Важной особенностью патогенеза ВАИ, связанной с уреаплазмами, является ее частое хроническое течение. В экспериментах на овцах было показано, что введенные внутриамниотически клинические изоляты U. parvum способны в течение длительного времени колонизировать околоплодные воды и плод; полагают, что амниотическая жидкость, богатый источник мочевины, способствует длительному росту этих микроорганизмов [35, 41].
Таким образом, на сегодняшний день накоплен большой массив данных в пользу этиологической вовлеченности уреаплазм в развитие ВАИ. Очевидно, что для реализации уреаплазмами их патогенного потенциала необходим ряд факторов, и важность установления этих факторов не вызывает сомнений. Факторы реализации патогенного потенциала уреаплазм можно условно разделить на непосредственно факторы патогенеза ВАИ в хориоамнионе и факторы, способствующие преодолению уреаплазмами защитного цервиковагинального барьера с последующей инвазией амниотической полости. Факторы нарушения защитных свойств цервиковагинального барьера в значительной степени определяются физико-химическими и антимикробными свойствами цервикальной слизи и не являются специфическими для уреаплазм, поэтому выходят за рамки данного обзора. Тем не менее хотелось бы привести результаты недавней работы Zierden H.C. et al. (2023) [43], показавшие, что проницаемость цервиковагинальной слизи, которую измеряли по мобильности в слизи наночастиц разного размера, практически не зависела от срока беременности и определялась составом вагинальной микробиоты. Самой низкой проницаемостью обладали образцы с преобладанием Lactobacillus crispatus, самой высокой – образцы из кластера с разнообразием микроорганизмов, который в работах на основе секвенирования 16S рРНК иногда определяют как «молекулярный БВ». Эти данные еще раз подчеркивают важность учета структуры и свойств вагинальной микробиоты при изучении восходящей инфекции.
Антибактериальная терапия внутриамниотической инфекции с учетом активности против уреаплазм
ВАИ играет существенную роль в индукции ПР (оценки варьируют от 10% до 50% в зависимости от применяемых методов детекции микроорганизмов, срока гестации и других факторов [5, 44]). Несмотря на это, в крупных рандомизированных контролируемых испытаниях было показано, что применение антибиотиков для профилактики ПР не приводит к пролонгированию беременности или улучшению неонатального исхода и даже может оказывать неблагоприятное воздействие на плод, такое как развитие некротизирующего энтероколита [45]. По этой причине применение антибактериальной терапии для профилактики ПР у женщин с интактными плодными оболочками в отсутствие выраженных признаков инфекции не рекомендуется. Применение антибиотиков предусмотрено как в международных, так и в российских рекомендациях только в случаях ПИОВ при ПР и для профилактики неонатальных инфекций, вызываемых стрептококками группы В [46–49]. Помимо этого, антибактериальная терапия используется для лечения клинически выраженного хориоамнионита (или ВАИ, подтвержденной анализом амниотической жидкости) [46, 50].
Для профилактики и лечения ВАИ при ПИОВ применяется несколько схем антибиотикотерапии; однако наиболее широко используется комбинация ампициллина или амоксициллина с эритромицином [7, 47]. В случае выявления стрептококков группы В применяют ампициллин или амоксициллин (при умеренной аллергии на пенициллин используют цефазолин, при сильной – клиндамицин или ванкомицин) [48]; такие же схемы (дополненные гентамицином) используют для лечения хориоамнионита [46, 50].
Микоплазмы обладают природной устойчивостью к бета-лактамам, аминогликозидам, линкозамидам, гликопептидам. Антимикробной активностью в отношении микоплазм обладают тетрациклины, фторхинолоны и макролиды; при этом во время беременности разрешены только макролиды. Наиболее часто применяемыми во время беременности макролидами являются эритромицин и азитромицин. Недавний метаанализ эффективности этих двух макролидов при ПИОВ показал, что применение азитромицина было связано с аналогичным периодом пролонгирования беременности, но с более низкой частотой клинического хориоамнионита, чем применение эритромицина [51]. В то же время в недавнем крупном сравнительном исследовании эффективности разных режимов и способов применения этих двух макролидов не было выявлено различий в длительности латентного периода до родов, частоте хориоамнионита или неонатальных исходах, за исключением респираторного дистресс-синдрома, который чаще встречался в группе 5-дневного азитромицина [52]. В настоящее время остается не ясным, эффективны ли эритромицин и азитромицин против уже установленной ВАИ. Так как введение антибиотиков рекомендуется женщинам с ПИОВ при ПР до родов для предотвращения восходящей инфекции, время введения может быть слишком поздним, чтобы иметь положительный эффект против хронических инфекций, вызванных уреаплазмой, которые были установлены в ранние/средние сроки беременности [53]. Было высказано предположение, что введение соответствующих антибиотиков до 22 недель беременности (или до запуска воспалительных процессов в хориоамнионе) может значительно снизить частоту ПР. Отчасти рациональность этого подхода подтверждается метаанализом, который показал, что назначение макролидов и клиндамицина во II триместре беременности связано со снижением риска ПР [54]. Однако из-за опасений по поводу развития устойчивости к антибиотикам широкое применение противомикробных препаратов не рекомендуется, если нет признаков ВАИ.
Одна из основных проблем с лечением ВАИ заключается в том, что очень часто ВАИ не имеет выраженных клинических проявлений и не диагностируется до ретроспективного гистологического анализа плаценты и плодных оболочек. В первую очередь это относится к ВАИ, связанной с уреаплазмами, которые часто вызывают хроническую бессимптомную ВАИ, модулируя иммунный ответ хозяина для предотвращения серьезных патологических событий (но при этом риск неблагоприятных исходов сохраняется). По мере получения новых знаний о роли уреаплазм в развитии ВАИ встал вопрос о том, что применяемые схемы терапии имеют неоптимальную эффективность для лечения ВАИ и ассоциированных осложнений беременности. Показано, что эритромицин и азитромицин имеют ограниченную способность проникать через плаценту (около 3% [55]). Кроме этого, на животных было показано, что лечение эритромицином (однократное внутриамниотическое введение и многократное внутримышечное) не приводило к полной эрадикации уреаплазм, но в ряде случаев вело к селекции резистентных штаммов [56]. В качестве альтернативы эритромицину и азитромицину рассматривается кларитромицин – полусинтетический макролид с выраженным иммуномодулирующим и иммуносупрессивным действием и более высоким показателем трансплацентарного переноса (примерно 8% [57]). Кроме того, уровень резистентности уреаплазм к кларитромицину в большинстве регионов и популяций ниже, чем к азитромицину, и намного ниже, чем к эритромицину [58]. Учитывая, что в развитие ВАИ, помимо уреаплазм, могут быть вовлечены другие бактерии, предлагается наряду с кларитромицином включение метронидазола (против анаэробных бактерий) и цефтриаксона (против грамотрицательных бактерий) [39, 40]. Данная схема многие годы применяется в клинической практике госпиталя национального университета Сеула в случаях ПИОВ при ПР [39, 40]. Помимо этого, всем пациенткам с ПР, ИЦН и повышенной сократимостью матки (даже в отсутствие изменений шейки матки) рутинно предлагается амниоцентез для микробиологического и иммунологического исследования амниотической жидкости и оценки зрелости легких плода [59]. Обоснованием такой практики является то, что ВАИ/В имеет место у части пациентов при каждом из этих акушерских синдромов, и установление точного диагноза является ключом к успеху лечения. Данные, полученные за несколько лет применения этих практик, позволили ученым из университета Сеула провести целую серию ретроспективных исследований относительно роли ВАИ/В в развитии осложнений беременности и их профилактики. Так, было показано, что ВАИ/В выявляется в 80% случаев острой ИЦН с интактными мембранами; при этом 50% женщин рожают в течение недели, а 84% – в срок <34 недель [8]. Далее ретроспективный анализ клинических случаев ПИОВ при ПР показал более высокую эффективность комбинированной терапии кларитромицином, метронидазолом и цефтриаксоном в лечении ВАИ/В по сравнению с терапией ампициллином и/или цефалоспоринами, в ряде случаев дополненной эритромицином или азитромицином или метронидазолом [39, 40]. Кроме того, применение данной схемы увеличивало латентный период, снижало частоту выявления гистологических признаков острого хориоамнионита/фунисита и улучшало неонатальные исходы [39, 40]. В последующем Yoon B.H. et al. (2019) также ретроспективно с применением данной схемы продемонстрировали успешную терапию ВАИ/В, определяемую как отрицательные результаты микробиологического и иммунологического исследований амниотической жидкости или роды в срок, у 84% пациенток с ПР и интактными плодными оболочками [16]. Далее Oh K.J. et al. (2019) исследовали 22 случая ИЦН, сопровождаемой ВАИ/В [17]. Для микробиологического исследования использовался культуральный метод; у части пациенток были доступны результаты полимеразной цепной реакции (ПЦР) на уреаплазмы. У 3 из 22 (14%) пациенток с ИЦН и ВАИ/В в амниотической жидкости были обнаружены микроорганизмы, в одном случае были выявлены уреаплазмы. Всем пациенткам была назначена терапия кларитромицином, метронидазолом и цефтриаксоном, при этом части пациентов производили также цервикальный церкляж. Успех терапии, суммарно определяемый как микробиологически/иммунологически подтвержденное разрешение ВАИ/В или роды на сроке ≥34 недель, наблюдали в 59% (13/22) случаев. Учитывая, что прогноз при ИЦН, осложненной ВАИ/В, как правило, неблагоприятный [8], такие результаты заслуживают большого внимания.
Хотя данные, полученные в этой серии исследований, обнадеживают, необходимо отметить несколько серьезных ограничений. Во-первых, это были ретроспективные исследования случаев, которые собирались в университетском госпитале Сеула в течение нескольких лет, и ведение пациентов осуществлялось не по единому стандартному протоколу, а индивидуализировалось каждым врачом. Во-вторых, микробиологические исследования амниотической жидкости проводились культуральным методом, и хотя культуральное исследование на уреаплазмы осуществлялось с учетом их специфических питательных требований, большое число случаев инфицирования уреаплазмами могло быть пропущено, так как ПЦР на уреаплазмы применялась не всегда. Кроме того, некоторые трудно культивируемые облигатно анаэробные бактерии (например, Sneathia spp.), которые также могут играть роль в развитии ВАИ [60], можно обнаружить только молекулярными методами. Тем не менее полученные результаты – это веское основание для проведения крупных рандомизированных контролируемых клинических испытаний со стандартизированными протоколами диагностики и ведения пациентов, а также разработки новых схем терапии ВАИ/В, учитывающих микробный спектр и профили антибиотикорезистентности возбудителей.
Отдельного внимания заслуживает вопрос об использовании амниоцентеза для исследования амниотической жидкости с целью точной диагностики ВАИ/В. Амниоцентез – инвазивная, сопряженная с определенными рисками процедура; в настоящее время для диагностики ВАИ/В рутинно не применяется, и ВАИ/В диагностируется, как правило, уже после родов посредством гистологического исследования плаценты. Полагают, что получение убедительной доказательной базы относительно возможности эффективного лечения и профилактики синдромов, ассоциированных с ВАИ/В, позволит по-новому оценивать риски амниоцентеза в свете потенциальных преимуществ успешной терапии [61]. Еще одними перспективными направлениями исследований являются разработка и валидация неинвазивных биомаркеров ВАИ/В. Результаты исследований указывают на удовлетворительную диагностическую точность таких тестов, как уровень IL-6 в цервиковагинальной слизи [62] или композитный критерий, включающий уровень цервикального фибронектина и сывороточного С-реактивного белка, а также раскрытие шейки матки и гестационный возраст [63]; однако их клиническая эффективность должна быть верифицирована в проспективных исследованиях.
Заключение
Большинство клинических исследований констатирует наличие связи между комменсальными генитальными микоплазмами и неблагоприятными исходами беременности, однако вопрос о независимой этиологической роли этих бактерий на сегодняшний день остается открытым.
Большой массив экспериментальных и клинических данных свидетельствует об этиологической вовлеченности уреаплазм в развитие ВАИ. Очевидно, что для реализации уреаплазмами их патогенного потенциала необходим ряд факторов, и определение этих факторов является важной задачей. В настоящее время ни принадлежность к определенному виду/серотипу, ни высокая бактериальная нагрузка, ни определенные факторы вирулентности уреаплазм не могут использоваться в качестве прогностических маркеров неблагоприятного течения и исхода беременности.
Продемонстрированная недавно эффективность кларитромицина – макролида с высокой активностью в отношении уреаплазм – в терапии ВАИ и ассоциированных осложнений беременности свидетельствует о необходимости учета микробного спектра и профилей антибиотикорезистентности возбудителей в эмпирических схемах.
Разработка чувствительных и специфичных биомаркеров ВАИ, предпочтительно неинвазивных, с высокой прогностической значимостью на ранних стадиях, когда антибактериальная терапия особенно эффективна, была бы значительным прогрессом в профилактике ПР и других ассоциированных с ВАИ осложнений беременности.



