За последние десятилетия большую озабоченность медицинских работников и населения вызывает проблема апноэ во время сна (СОАС – синдром обструктивного апноэ сна). Значение проблемы СОАС
определяется его весьма широкой распространенностью, высокой частотой тяжелых осложнений и значительной летальностью. Так, в США нарушениями сна, в т. ч. дневной сонливостью, СОАС и бессонницей, страдают более 40 млн человек, причем у четверти из них наблюдается СОАС.
Наиболее частая форма этого синдрома – обструктивное апноэ, регистрируется у 5–10 % взрослых мужчин; 20 % из которых предъявляют типичные жалобы [1]. СОАС характеризуется наличием храпа, периодически повторяющимся частичным или полным прекращением дыхания во время сна, достаточно продолжительным, чтобы привести к снижению уровня кислорода в крови, грубой фрагментацией сна [2] и избыточной дневной сонливостью [3]. Для установления диагноза СОАС эпизоды апноэ должны длиться не менее 10 секунд и возникать не реже 5 раз в час.
Повторные гипоксемия и гиперкапния нередко вызывают легочную и системную гипертензию, нарушение ритма и проводимости сердца, что ведет к уменьшению продолжительности жизни [4]. Значительно реже во время сна наблюдается апноэ центрального происхождения. Эта форма известна со времени описания дыхания Чейн–Стокса и обусловлена поражением дыхательного центра гипоксического, токсического или циркуляторного происхождения. Предварительный диагноз СОАС устанавливают на основании жалоб, анамнеза и физикального исследования [5, 6].
Предложена схема сканирующего обследования [5], включающая семь признаков:
1. Указания на остановки дыхания во сне.
2. Громкий или прерывистый ночной храп.
3. Учащенное ночное мочеиспускание;
4. Длительное (> 6 месяцев) нарушение ночного сна.
5. Дневную сонливость.
6. Ожирение.
7. Артериальную гипертензию (АГ), особенно ночную или утреннюю.
Наличие по меньшей мере трех из этих признаков требует проведения более детального, в т. ч. ринологического, обследования. Однако окончательный диагноз устанавливают по данным полисомнографии (ПСГ). Используемые для этого приборы различаются по точности и чувствительности; неодинаковы и диагностические критерии самого патологического состояния [1]. Отмечается несоответствие между распространенностью СОАС, пониманием врачами и населением его влияния на медицинское состояние популяции [7, 8].
Главными факторами риска развития СОАС являются возраст, принадлежность к мужскому полу и семейный анамнез СОАС. К второстепенным факторам относятся ожирение, злоупотребление алкоголем, курение, привычный храп, дневная сонливость, малая жизненная емкость легких, принадлежность к черной расе и применение ряда препаратов (в частности, снотворных, транквилизаторов и миорелаксантов) [2].
Этиология и патогенез
Храп возникает вследствие изменения конфигурации и свойств верхних дыхательных путей (ВДП) во время сна [11]. Нестабильность ДП может вести к их сужению или закрытию; места обструкции определяются фоновым нервно-мышечным тонусом и стадией сна, преимущественно REM (rapid eye movements) сна с быстрыми движениями глазных яблок и гипотонией мышц ВДП [2, 4, 12]. К храпу
предрасполагают также анатомические особенности ВДП, генетические факторы и влияние окружающей среды [2, 4, 13, 14]. Он вызывается вибрацией мягких тканей глотки, неба и язычка
во время вдоха и выдоха и может возникать при чисто носовом дыхании. Нестабильность стенок ДП, ее транзиторный или постоянный (как при апноэ) характер определяются объемной скоростью воздушного потока, геометрией и резистентностью ДП [8].
Вопросы этиологии и патогенеза СОАС в современном понимании подробно изложены в аналитическом обзоре [5]. По данным литературы, проходимость ВДП определяется диаметром их просвета, тонусом гладких мышц, величиной отрицательного давления в трахее и бронхах во время вдоха. На
все эти показатели влияют на факторы, затрудняющие носовое дыхание и уменьшающие объемную скорость или увеличивающие турбулентность воздушного потока, в частности гипертрофию и рыхлость тканей носоглотки, искривление носовой перегородки и т. п. Те же факторы ведут к появлению храпа, а со временем – к коллапсу стенок глотки, способствующему дальнейшей обструкции ДП.
Действие СОАС на сердечно-сосудистую систему (ССС) носит мно-гофакторный характер. Осложнения
с ее стороны, вероятно, опосредованы взаимодействиями между механическими, химическими (гипоксия, гиперкапния) факторами и влиянием повторной обструкции ДП на вегетативную нервную систему. Некоторые острые изменения при СОАС напоминают рефлексы при произвольной задержке дыхания или нырянии, но модифицированы механическим действием колебаний внутригрудного дав-
ления вследствие обструкции ДП [15].
Состояние сна изменяет реакции центральных и периферических хеморецепторов на гипоксию и гиперкапнию, а также влияет на центральные регуляторные механизмы. Во время сна в нормальных условиях повышается тонус парасимпатической нервной системы, что сопровождается выраженным повышением уровня катехоламинов плазмы и выраженной периферической вазоконстрикцией. В результате гипоксии и гиперкапнии, наблюдаемых при СОАС, возникает выраженный ацидоз сосудистой стенки с высвобождением таких вазоактивных веществ, как простациклин, тромбоксан, эндотелин и аденозинвазопрессин [10, 15–17]. Все эти факторы увеличивают посленагрузку на левый желудочек, что может привести к его гипертрофии. За приступом апноэ следует период гипервентиляции с характерным для него нарастанием отрицательного давления в грудной клетке, что ведет к усилению венозного притока, растяжению правого предсердия, повышению активности предсердного натрийуретического гормона и в конечном счете – ночному диурезу [16]. Возможно, это играет роль в развитии таких изменений циркуляции, как АГ или нарушения ритма сердца [2, 4, 9, 15–17]. Хроническая нехватка и фрагментация сна, обусловленные полными и частичными пробуждениями, способствуют дневной сонливости, постоянному чувству утомления, раздражительности; снижаются концентрация внимания и интеллект, наблюдаются изменения личности [17, 18].
Диагностика
Наиболее частыми жалобами пациентов с СОАС являются громкий храп, указания на остановки дыхания во сне (о чем больные обычно знают со слов родственников), беспокойный сон, не приносящий отдыха, дневная сонливость, раздражительность и снижение памяти. Менее характерны ночные приступы удушья, ночные поты, головная боль при утреннем пробуждении и снижение потенции. В число редких проявлений входят повторные пробуждения, бессонница, ночной кашель.
Местные структурные изменения и функциональные нарушения со стороны ВДП выявляет врачоториноларинголог. К ним относятся искривление перегородки носа, гипертрофия носовых раковин, хронический полипозный синусит, гипертрофия небных, трубных, глоточных и язычной
миндалин, врожденная узость просвета глотки, кисты, гиперплазия тканей мягкого неба, пороки развития костей лицевого скелета, отечный ларингит, паралич голосовых связок, папилломатоз гортани, добро- и злокачественные новообразования. Внимание интерниста должны привлекать миодистрофии, миастении, церебральный паралич, гипотиреоидизм, которые также могут быть этиологическими факторами СОАС [5].
Оториноларингологическое исследование обычно дополняется эндоскопией полости носа, глотки и гортани с помощью гибкого фиброоптического эндоскопа.
Чтобы выявить тенденцию к коллапсу ДП во сне, проводят пробу Мюллера. Во время эндоскопического исследования больному предлагают сделать форсированный вдох, закрыв при этом нос и рот. Пробу проводят при разных положениях больного и различной глубине введения эндоскопа, иногда под наркозом.
Наиболее ценную диагностическую информацию позволяют получить данные ПСГ, которая представляет собой продолжающуюся в течение всей ночи регистрацию ряда электрофизиологических показателей: электроэнцефалограммы (ЭЭГ), электромиограммы (ЭМГ), электроокулограммы (ЭОГ); объемной скорости потока воздуха через нос, объемной скорости потока
воздуха через рот, движения грудной клетки, движения брюшной стенки и SaO2. Анализ ЭЭГ, ЭМГ и ЭОГ позволяет изучить структуру сна.
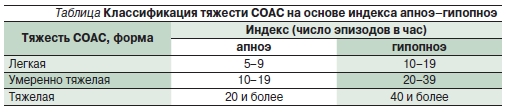
Степень тяжести СОАС устанавливают на основе данных ПСГ. Критериями степени тяжести служат число и длительность эпизодов апноэ и гипопноэ за час ночного сна. Принято выделять три степени тяжести течения СОАС: 1) нетяжелое (менее 15 эпизодов); 2) средней тяжести (от 15 до 30 эпизодов) и 3) тяжелое (более 30 эпизодов). Кроме того, на степень тяжести СОАС влияют выраженность и продолжительность снижения насыщения крови кислородом, а также продолжительность самих приступов и степень выраженности нарушений структуры сна.
Существует и другая классификация степени тяжести СОАС, приведенная в таблице.
Связь синдрома обструктивного апноэ во время сна с сердечно-
сосудистыми заболеваниями
Артериальная гипертензия. У лиц с СОАС суточная динамика артериального давления (АД), как правило, нарушена (“нон-диперы”). Этот феномен большинство исследователей расценивают как фактор риска повышенной заболеваемости и смертности от сердечно-сосудистых заболеваний.
В случаях умеренного и тяжелого СОАС систолическое и диастолическое АД во время сна повышается примерно на 25 %. Возникает обусловленная частыми пробуждениями (по окончании приступа апноэ) выраженная активация симпатоадреналовых механизмов, сопровождаемая периферической
вазоконстрикцией и резким повышением уровня катехоламинов плазмы. Гипоксемия и гиперкапния приводят к локальному ацидозу сосудистой стенки, который сопровождается высвобождением многих вазоактивных веществ, в т. ч. тромбоксана, эндотелина и аргининвазопрессина [4, 16, 17]. Теорию о роли катехоламинов в возникновении АГ у пациентов с СОАС подтверждают исследования [19], в которых сравнивали результаты применения с лечебной целью у подобных больных атенолола (50 мг/сут), эналаприла (20 мг/сут), гидрохлоротиазида (25 мг/сут) и лозартана (50 мг/сут). Наиболее
выраженное гипотензивное действие оказывали β-адреноблокаторы. В то же время β-адреноблокаторы иногда ведут к ухудшению состояния больных, по-видимому, при наличии у них обструктивных заболеваний легких [20].
Большинство исследователей сообщают не только о повышении АД в ночное время, но и о значительной распространенности АГ среди больных СОАС в период бодрствования. Высокая (до 50 %) распространенность АГ среди больных СОАС, по данным многих авторов, существенно уменьшается под влиянием эффективного лечения этого синдрома, что дает основание считать СОАС ответственным за развитие АГ [11, 21, 22].
Нарушение мозгового кровообращения. Многочисленные исследования показали, что у лиц с СОАС частота нарушений мозгового кровообращения значительно выше, чем у здоровых людей [23, 24]. Нарушения мозгового кровообращения у больных с СОАС наблюдаются в три–шесть раз чаще, чем у других жителей США [25]. По данным допплерографии, отмечено выраженное снижение кровотока по
средней мозговой артерии в периоды ночного апноэ и гипопноэ у больных с СОАС, что играет существенную патогенетическую роль в снижении мозгового кровообращения у подобных больных [26].
Кроме того, было проведено перекрестное исследование больных, перенесших первое в жизни нарушение мозгового кровообращения и находящихся в реабилитационных центрах [26], в ходе которого обнаружили, что среди этих больных очень высока частота нарушений дыхания во сне.
Так, при индексе нарушений дыхания, равном 5, частота нарушений мозгового кровообращения во сне составляла 61 %. Антропометрические данные и постоянный ночной храп позволили предположить, что обструктивные нарушения дыхания предшествовали инсульту. Авторы считают, что у всех больных с нарушением мозгового кровообращения необходимо проводить скрининг, направленный на выявле-
ние синдромов нарушения дыхания во время сна [27].
В обзорной статье, посвященной лечению ожирения, указывается, что именно ожирение служит общим этиопатогенетическим фактором развития как СОАС, так и нарушений мозгового кровообращения [28].
В специальном исследовании [29] попытались расшифровать патогенетические механизмы нарушений мозгового кровообращения у больных с СОАС, находящихся в состоянии бодрствования, использовав для этого транскраниальную допплерографию и определение газов крови трижды в день. Была изучена, в частности, сосудистая реакция на гиперкапнию с использованием индекса задержки дыхания. Полученные данные свидетельствуют о статистически значимом снижении адаптивных возможностей сосудистой реакции вазодилатации на стресс, связанный с гиперкапнией, у больных с
СОАС. Аналогичные данные приводят и ряд других исследователей.
Легочная гипертензия. В целом можно считать твердоустановленным только тот факт, что у больных с СОАС повышается давление в легочной артерии в период и REM, и не-REM сна. Весьма вероятно, что больные СОАС подвержены высокому риску развития и прогрессирования легочной гипертензией, если они страдают обструктивными заболеваниями легких. Возможность развития легочной
гипертензии у больных СОАС без сопутствующих заболеваний легких требует уточнения.
Атеросклероз и его осложнения. До настоящего времени дискутируется вопрос о том, являются атеросклероз, ИБС и ее осложнения просто сопутствующими СОАС заболеваниями, или между этими состояниями существует этиопатогенетическая связь. Некоторые авторы четкой связи между ИБС и СОАС не выявили [31].
Если вопрос о развитии острых ишемических осложнений во время приступов апноэ представляется достаточно ясным и, по мнению практически всех исследователей, эти осложнения связаны с возникающей во время остановки дыхания острой гипоксией и снижением насыщения крови кислородом, то причины ускоренного развития атеросклероза и его осложнений у больных СОАС еще требуют углубленного изучения. Так, по данным исследования Y. Peker и соавт., СОАС является независимым фактором риска инфаркта миокарда [30].
Лечение СОАС
Поскольку, как было показано выше, существует тесная связь между СОАС и храпом, значительная часть лечебных мероприятий направлена на борьбу с последним. В случаях неосложненного храпа и нетяжелого течения СОАС следует прежде всего устранить факторы, провоцирующие нарушения дыхания во сне.
Существуют следующие методы, направленные на устранение СОАС:
1. Обеспечение оптимального положения головы и тела во время сна. Нарушения дыхания резко усиливаются, если больной спит, лежа наспине, поскольку при этом мягкое небо, корень языка и язычок смещаются кзади, приближаясь или прилегая к задней стенке глотки. Усиление храпа и учащение приступов апноэ в положении на спине можно выявить в беседе с родственниками больно-
го или по данным ПСГ. Простой и эффективный способ отучить больного спать на спине – пришить к
спинке ночного нательного белья специальный карман и вложить в него теннисный мяч. Правда, в первые недели больной, ложась на спину, просыпается, зато примерно через месяц у него вырабатывается стойкая привычка спать, лежа на боку. Западению языка препятствует и приподнятое положение головы, а еще лучше – всего тела. Чтобы создать такое положение, если нет возможности использовать функциональную кровать, под ножки головного конца обычной кровати подкладывают деревянные бруски толщиной 10–15 мм.
2. Борьба с ожирением. Установлено, что у больных с ожирением и синдромом СОАС уменьшение массы тела на 10 % ведет к 50 %-ному улучшению основных параметров дыхания во время сна. Безвредных лекарственных средств для борьбы с ожирением пока не существует. Далеко не всегда удается уменьшить массу тела с помощью физических упражнений, которые обычно вызывают повышение аппетита. Поэтому единственное надежное средство борьбы с ожирением – соблюдение низкокалорийной, богатой витаминами диеты со значительным ограничением содержания жиров и углеводов. Простой и надежный способ похудеть – полный отказ от хлеба и мучных продуктов.
3. Отказ от приема веществ, способных вызывать миорелаксацию. К таким веществам относятся в первую очередь снотворные средства, транквилизаторы и алкоголь. Если больной не может отказаться от приема алкоголя, он во всяком случае не должен употреблять его в течение нескольких часов до
отхода к ночному сну.
4. Отказ от курения. Почти у всех курильщиков наблюдается развитие хронического фарингита и ларинготрахеита, для которых характерна отечность слизистых оболочек, способствующая сужению дыхательных путей.
5. Обеспечение свободного носового дыхания. Постоянное закапывание в нос средств, содержащих сосудосуживающие компоненты, невозможно, прежде всего в связи с тем, что ко всем подобным средствам быстро развивается рефрактерность. Поэтому для обеспечения свободного носонические приспособления. Наиболее хорошо проверенное и эффективное из подобных приспособлений – нозовент (Nozovent), эластичная пластинка, закрепляемая на внутренних поверхностях ноздрей и расширяющая их. При использовании нозовента у больных с СОАС индекс апноэ–гипопноэ уменьшался в среднем на 47 %, а сатурация крови кислородом увеличивалась в среднем на 10 %. Применение подобных приспособлений у больных с органическими заболеваниями полости носа неэффективно, и подобным больным показано хирургическое лечение.
С той же целью на протяжении многих десятилетий пытались применять и механические приспособления, препятствующие коллапсу дыхательных путей (назофарингеальная воздуховодная трубка, внутриротовые языкодержатели и т. п.), но все эти приспособления оказались или труднопереносимыми больным, или малоэффективными.
Попытки лечения СОАС медикаментозными средствами (трициклическими антидепрессантами, гестагенами, кислородом) не позволили получить стабильного и надежного эффекта. Оксигенотерапия иногда позволяет получать хороший эффект, но ее применение при наличии у больного гиперкапнии может дать противоположный результат.
Одновременно с лечением СОАС проводят патогенетическую и симптоматическую терапию связанных с ним заболеваний.
6. Лечение постоянным положительным давлением в дыхательных путях. Метод лечения СОАС, основанный на создании положительного давления воздуха в дыхательных путях, был предложен в 1981 г. C.E. Sullivan и соавт.; он заключался в подаче через специальный наконечник, фиксируемый в ноздрях больного, воздуха под давлением 4,5–10,0 мм вод. ст. [32]. В 1983 г. метод был модифицирован:подача воздуха производилась через маску. Принцип метода сводится к расширению воздухоносных путей под давлением нагнетаемого воздуха, препятствующего их спадению.
Применение постоянного повышенного давления в дыхательных путях в настоящее время – CPAP (Continuous Positive Airways Pressure)-терапия – является наиболее распространенным методом лечения больных с синдромом СОАС и эффективна у больных с СОАС любой степени тяжести.
Подбор режима работы аппарата должен проводить квалифицированный специалист (по возможности в области патологии сна). Эффективность лечения контролируют повторной регистрацией ПСГ. Частота развития сердечно-сосудистых осложнений и летальность у больных с СОАС при проведении данного вида лечения значительно (статистически высокозначимо) снижается [31, 33, 34].
Основное препятствие для максимально широкого применения CPAP-терапии – неудобства, которые она причиняет больным. По данным разных исследований, постоянно используют этот вид лечения в домашних условиях 55–65 % больных, у которых она оказалась высокоэффективной при использовании в условиях стационара.
7. Хирургическое лечение храпа и синдрома обструктивного апноэ во время сна. Хирургическое лечение показано больным, у которых привычный храп или СОАС обусловлен анатомическими дефектами полости носа и глотки, гиперплазией мягких тканей (заднего неба, язычка, миндалин),
искривлением носовой перегородки и т. п. Критерием непосредственной эффективности хирургического лечения считают снижение индекса апноэ–гипопноэ по меньшей мере на 50 %. По данным различных исследований после наиболее распространенной операции – увулопалатофарингопластики – индекс апноэ–гипопноэ снижается на 36–85 % (в среднем на 49 %). Однако эффект далеко не всегда
оказывается стойким. Поэтому многие хирурги предпочитают применять менее травматичные операции с использованием лазерных или радиохирургических методов.
8. Кардиостимуляция. Совсем недавно было установлено, что имплантация кардиостимулятора благоприятно влияет на течение СОАС. Механизм этого влияния не выяснен, но автор предполагает, что имплантированный стимулятор противодействует “замедляющей” части центральной нервной
системы. Возможно, что дальнейшее изучение проблемы позволит решить вопрос о целесообразности применения кардиостимуляции в тяжелых случаях СОАС в сочетании с брадикардией [35].
Заключение
Актуальность проблемы СОАС была доказана результатами популяционных эпидемиологических исследований. Весьма существенно, что СОАС способствует развитию ряда заболеваний и патологических состояний ССС, прежде всего АГ. Принципиально важно, что даже при легкой степени
нарушений дыхания во сне резко снижается качество жизни. Взаимосвязь между нарушениями дыхания во время сна и заболеваниями ССС достаточно сложна, но углубление ее понимания имеет большое значение для лечения многочисленных больных, у которых сочетаются эти патологические состояния. Хотя исследования последних лет значительно расширили наши познания в этой области, многие аспекты проблемы требуют дальнейшего изучения.



