Обусловленные в последние годы процессами глобализации острые проблемы распространения и лечения инфекционных заболеваний были восприняты мировым сообществом как существенная угроза, для ликвидации которой были приняты положения «Политической декларации заседания высокого уровня Генеральной Ассамблеи по проблеме устойчивости к противомикробным препаратам» [1].
В соответствии с этими положениями проводится поиск способов сохранения эффективности имеющихся антибиотиков, в том числе путем создания условий повышения чувствительности патогенов к антимикробным веществам [2].
Это и данные о том, что дефицит нормальной микрофлоры обуславливает низкую результативность антимикробной терапии [3], стали причиной изучения влияния лактобацилл, как представителей нормальной микрофлоры женского репродуктивного тракта на антибиотикорезистентность. При этом был обнаружен феномен потенцирования действия антибиотиков метаболитами не только нормальной микрофлоры, но и пробиотического штамма Lactobacillus casei subsp. rhamnosus LCR35 [4, 5].
Это открывает перспективы повышения эффективности терапии воспалительных заболеваний за счет временного выполнения функции нормальной флоры пробиотиками на момент применения антимикробных веществ.
Однако для проверки этого предположения необходимы дальнейшие клинические исследования в условиях in vivo в отношении конкретных инфекций и конкретных антимикробных веществ, что и послужило побудительным мотивом настоящего исследования.
В качестве модели был выбран трихомониаз, протекающий на фоне бактериального вагиноза, потому что при этом сочетании нормофлора влагалища практически отсутствует [6, 7]. Клиническую значимость выбора этой модели определила высокая частота встречаемости этой нозологии [8] и трудности ее терапии [9].
Цель исследования: оценка клинической эффективности совместного применения антимикробных и пробиотических препаратов у пациенток с бактериальным вагинозом и трихомониазом.
Материал и методы исследования
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинской Декларации, с одобрения ЛЭК ФГБОУ ВО ОрГМУ Минздрава России (протокол №165 от 10.03.2017).
Тип исследования – открытое рандомизированное наблюдательное.
Критерии включения: женщины в возрасте 20–30 лет с регулярным менструальным циклом; подтвержденный диагноз трихомониаза и бактериального вагиноза; наличие информированного согласия пациентки на участие в исследовании; желание и способность пациентки выполнять требования лечения на протяжении всего исследования; согласие полностью воздерживаться от половых контактов, или использовать пероральные гормональные методы контрацепции в течение всего периода исследования. Критерии исключения: беременность; лактация; повышенная чувствительность к используемым препаратам; менструация в ожидаемые сроки лечения; использование антимикробных препаратов или спермицидов в период 30 дней, иммуномодулирующих средств в период 3 месяцев, предшествующих скринингу; вульвовагинальный кандидоз; наличие иных инфекций, передающихся половым путем; приверженность к интравагинальным гигиеническим практикам; курение.
По результатам предварительного скрининга 40 участниц были рандомизированы в две группы. Для терапии использовали метронидазол, согласно международным рекомендациям и пробиотический препарат лактожиналь. Лактожиналь был выбран, так как штамм Lactobacillus casei subsp. rhamnosus LCR35, входящий в его состав обладает множественной устойчивостью к антибиотикам и способен потенцировать активность антимикробных веществ [4].
Терапия проводилась в 2 этапа. На первом этапе в течение 7 дней пациентки I группы получали метронидазол 500 мг 2 раза в сутки внутрь и лактожиналь вагинально по 1 капсуле 2 раза в сутки, пациентки II группы – только метронидазол. На втором этапе пациентки обоих групп получали лактожиналь вагинально по 1 капсуле 2 раза в день в течение 7 дней.
При каждом посещении (до лечения, на 4, 8 и 15-й день терапии) проводилось клиническое, бактериологическое, микроскопическое, молекулярно-генетическое исследование.
Критерием эффективности проводимой терапии являлась частота излечения, определяемая как отношение количества пациенток, у которых к 15-му дню терапии достигалось и клиническое и лабораторное излечение к общему числу пациенток в каждой группе.
Выраженность клинических проявлений оценивали при осмотре и на основании дневников самонаблюдения пациентов по 4-балльной системе, где 0 баллов – отсутствие признаков/симптомов, а 3 балла – тяжелая степень выраженности.
Наличие и выраженность бактериального вагиноза оценивали по критериям Амселя и количеству копий ДНК Atopobium vaginae и Gardnerella vaginalis (набор реагентов для полимеразной цепной реакции (ПЦР) в режиме реального времени производства ООО «Литех»). Количество ключевых клеток оценивали, как долю от общего числа эпителиальных клеток. Значения вагинального рН определяли с использованием бумажных тест-полосок с ограниченным диапазоном рН.
Для обнаружения Trichomonas vaginalis использовали культивирование в среде Kupferberg Trichomonas Broth Base (HiMedia), содержащей 5% лошадиной сыворотки и хлорамфеникол. Наличие трихомонад в среде культивирования подтверждали микроскопически и с помощью ПЦР (ООО «Литех»).
Оценку состояния нормальной микрофлоры проводили по микроскопическим критериям Nugent, Hay-Ison и численности бактерий рода Lactobacillus, определяемой путем высева на агар MRS с последующим культивированием в атмосфере с 5% содержанием СО2 в течение 48 часов. Принадлежность микроорганизмов к роду подтверждали с помощью комплекса морфологических, культуральных, биохимических свойств [10].
Данные представлены в виде частот или процентного отношения, или при помощи среднего значения и стандартного отклонения. Для оценки достоверности различий между группами использовался критерии Манна-Уитни и согласия Пирсона (χ2). Во всех процедурах статистического анализа уровень значимости p принимался равным 0,05.
 Результаты исследования
Результаты исследования
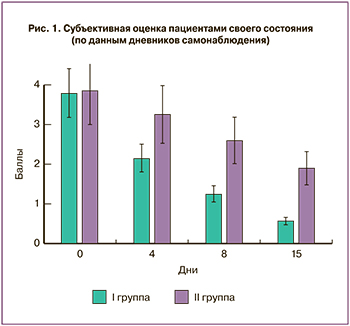
Анализ, основанный на субъективной оценке пациентами своего состояния (по данным дневников самонаблюдения) показал, что у получавших пробиотик одновременно с антимикробной терапией (I группа) динамика улучшения была более выраженной, чем у пациенток, получавших пробиотик только на втором этапе (II группа) (рис. 1).
Так, к завершению первого этапа терапии выраженность жалоб пациенток I группы была более чем в два раза ниже, чем во II (1,25 и 2,6 балла соответственно, р=0,032). К завершению лечения эта разница была еще более выраженной – 0,58 и 1,9 балла (р=0,012) соответственно. Клиническая оценка по шкале вульвовагинальных признаков/симптомов отражала аналогичную тенденцию.
Объективная оценка проводилась по трем направлениям – элиминация Trichomonas vaginalis, купирование проявлений бактериального вагиноза и динамика параметров микроэкологического состояния влагалища.
К четвертому дню терапии была выявлена статистически значимая разница в обнаружении трихомонад (χ2=13,3; p<0,001): Trichomonas vaginalis была выявлена у 5% пациенток I группы и у 65% пациенток II группы (рис. 2а). К завершению терапии Trichomonas vaginalis была выявлена у 10% пациенток I группы и у 80% пациенток II группы (χ2=22,5; p<0,001). Уменьшение численности ассоциированных с бактериальным вагинозом бактерий в I группе пациенток было более выраженным (рис. 2в, г). Так, различие в количестве обнаруживаемых копий ДНК A. vaginae и G. vaginalis у пациенток I группы к 4-му дню было в десять раз меньше чем у II (р<0,01), а к завершению терапии эта разница была почти стократной (р<0,001).
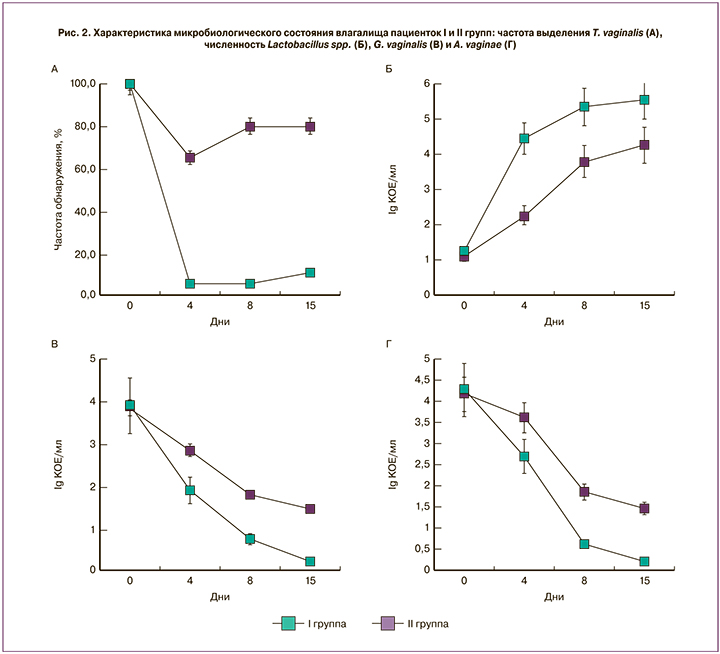
К завершению первого этапа терапии ключевые клетки отсутствовали у 40% пациенток I группы и только у 5% – II группы (χ2=5,16; p=0,023), а к концу второго этапа – у 75 и 30% (χ2=6,42; p=0,011) соответственно. В целом, бактериальный вагиноз удалось купировать к завершению первого этапа у 55% пациенток I группы и только у 20% – II (χ2=2,6; p=0,11), к завершению второго этапа – у 85 и 45% (χ2=5,38; p=0,02) соответственно.
При оценке микроэкологического состояния мы отметили, что если пробиотик применялся с началом антимикробной терапии, то нормализация параметров происходила более интенсивно и выраженно.
Так, значение рН вагинальной жидкости у пациенток I группы нормализовалось уже на первом этапе терапии, тогда как подобный результат во II группе был достигнут после 8-го дня терапии, то есть с началом применения пробиотиков (рис. 3а).
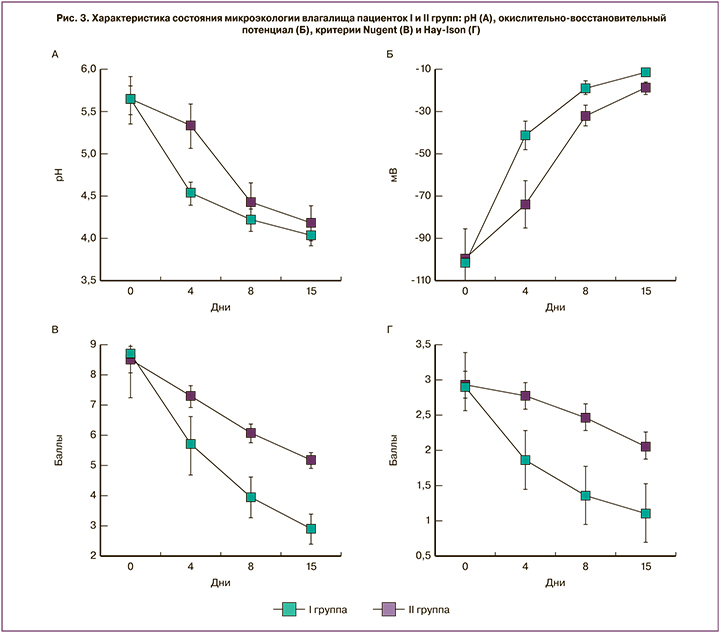
Смещение редокс-потенциала в окислительную область также происходило более интенсивно в первой группе (рис. 3б). Происходящее одновременно с изменением физико-химических параметров улучшение микробного пейзажа на фоне ранней пробиотической терапии было более выраженным (рис. 3в, г). Результатом этого явилось приближение значений критериев Nugent и Hay-Ison к моменту завершения терапии в I группе к нормальным, тогда как во II группе в большинстве случаев микроэкологическое состояние улучшилось, но не достигло нормы (рис. 3в, г). Следует отметить, что количество лактобацилл (рис. 2б) в конце терапии в I группе на порядок превышало таковое во второй – 5,55±0,34 и 4,26±0,17 КОЕ/мл, соответственно (р<0,01). Таким образом, антимикробная терапия, проводимая на фоне пробиотической, была более эффективной и позволила излечить 80% пациенток, тогда как при традиционной схеме терапии эффективность составила 20%.
Оценивая результаты настоящего исследования в целом, хотелось бы отметить, что совместное применения метронидазола и пробиотика лактожиналь оказалось более эффективным в терапии трихомониаза, протекающего на фоне бактериального вагиноза, чем последовательный режим.
Обсуждение
Ранее нами в условиях in vitro был обнаружен феномен потенцирования действия антибиотиков метаболитами вагинальных лактобацилл и пробиотического штамма LCR35 [4, 5]. Наиболее эффективными в повышении чувствительности бактерий к антибиотикам были перекись водорода и сурфактанты. Метаболиты пробиотического штамма LCR35 повышали чувствительность к антибиотикам всех тест-штаммов, в большей мере – G. vaginalis, E. coli и Klebsiella spp.. Настоящее исследование позволило подтвердить реальность существования этого феномена в условиях in vivo.
Полученные данные объясняют хорошо известный факт зависимости успешности терапии инфекций, передающихся половым путем от наличия или отсутствия нормальной флоры влагалища [3]. С другой стороны, эти результаты открывают пути повышения эффективности антимикробной терапии для пациентов с дефицитом нормальной микрофлоры. По-видимому, пробиотики, вне зависимости от того, произойдет ли их интродукция в вагинальный микробиоценоз, хотя бы на момент антимикробной терапии исполняют функции нормальной микрофлоры. В результате этого в группе пациенток с ранним применением препарата, содержащего пробиотический штамм Lactobacillus casei subsp. rhamnosus LCR35, на момент проведения антимикробной терапии достоверно отличались показатели кислотно-основного состояния и редокс-потенциала. Возможно, именно эти различия физико-химических показателей среды создали условия для оптимальной реализации антимикробного потенциала метронидазола [9]. Все выше изложенное диктует необходимость учета состояния нормальной микрофлоры на момент применения антибиотиков, при необходимости восполняя ее дефицит пробиотическими штаммами, способными к продукции «ассистентов антибиотиков». Для этого требуется новое показание для применения пробиотических препаратов – с целью повышения эффективности антимикробной терапии. Пока неясно, все ли известные пробиотические штаммы подходят для применения по этому показанию. С нашей точки зрения, эти штаммы должны быть, как минимум, устойчивы к антибактериальным препаратам и в тоже время продуцировать вещества, способные повышать чувствительность патогенов к антибиотикам. Это целесообразно учитывать при создании новых пробиотических препаратов.
Полученные результаты, несомненно, вдохновляют, однако нужно учитывать, что данные, полученные при изучении одного антимикробного вещества на одной нозологии, нельзя экстраполировать на другие инфекции и биотопы. На данный момент неясно, будет ли обнаруженная нами закономерность соблюдаться в отношении вирусных и грибковых поражений.
Заключение
В заключении стоит отметить, что наше исследование, несмотря на его кажущийся прикладной характер, позволило впервые в мировой практике получить данные о возможности влияния пробиотических лактобацилл на устойчивость патологического микробного сообщества влагалища к неблагоприятным факторам, что, в свою очередь, расширяет наше понимание роли нормальной микрофлоры в исходе взаимодействий «паразит-хозяин».



