Поражение периферической нервной системы при сахарном диабете (СД) может проявляться различными клиническими формами, при этом около 70% всех форм приходится на диабетическую полиневропатию (ДПН) [1]. Распространенность ДПН варьируется в широких пределах, что связано с методами и критериями, которые используются при постановке диагноза. Так, частота выявления ДПН при клиническом обследовании составляет 20%, а при проведении электромиографии (ЭМГ) – 80%. В клинической практике СД 2 типа (СД2) в половине случаев ДПН выявляется на 5–7-м году его течения, при этом к моменту установления диагноза СД 20–30% пациентов уже имеют ДПН [2]. Трофические язвы кожи, или диабетическая стопа, – одно из серьезных осложнений ДПН, которое может приводить к ампутации стопы [3]. Невропатическая боль развивается у 13–34% пациентов с СД [4, 5]. Боль приводит к нарушению сна, тревожным и депрессивным расстройствам, снижению активности пациентов [4]. Невропатическая боль и сенсорный дефицит у пациентов с СД – факторы риска развития инфаркта миокарда и сердечной смерти [6].
На сегодняшний день принято выделять генерализованные, фокальные и полифокальные формы диабетической невропатии [7, 8], при этом группу генерализованных форм ДПН разделяют на две подгруппы: типичную и атипичную ДПН [9]. К типичной относится ДСПН, которая встречается примерно в 50% всех случаев ДПН [9, 10]. ДСПН – самая распространенная и наиболее изученная форма ДПН [9]. Основу патогенеза ДСПН составляют нарушения метаболизма и микроцикуляции.
К атипичной ДПН относят острую болевую невропатию Элленберга, острую болевую невропатию, связанную с нормализацией углеводного обмена [9]. Предполагают, что в основе развития атипичной ДПН лежат другие, в т.ч. дизиммунные, патогенетические механизмы [11]. Распространенный, но редко диагностируемый тип ДПН – диабетическая автономная невропатия (ДАН) [12]. Заболевание длительное время может протекать бессимптомно и определяться только по результатам специальных тестов на вегетативную дисфункцию [9]. ДАН может быть единственным неврологическим проявлением СД, но, как правило, сочетается с поражением соматической нервной системы [13].
В настоящей статье представлен современный взгляд на патогенез и тактику ведения пациентов с типичной ДПН – ДСПН.
Патогенез типичной ДПН
Отечественный врач и ученый Владимир Михайлович Прихожан активно изучал вопросы клинических проявлений и патогенеза неврологических осложнений СД. В своей книге «Поражение нервной системы при сахарном диабете» (1981) он объединил сосудистую и метаболическую теорию развития ДПН, тем самым предвосхитив современные представления о патогенезе ДПН [14]. И лишь в 2001 г. американский ученый Майкл Браунли опубликовал статью в журнале «Nature», в которой объединил экспериментальные и клинические данные о биохимических основах патогенеза ДПН и указал на конкретные механизмы нарушения метаболизма, лежащие в основе поражения микроциркуляторного сосудистого русла и нервных волокон [15]. В дальнейшем коллектив американских и немецких ученых развили теорию М. Браунли, опубликовав в 2003 г. результаты экспериментальных исследований, после чего теория патогенеза ДПН приняла свою структурированную современную форму [16].
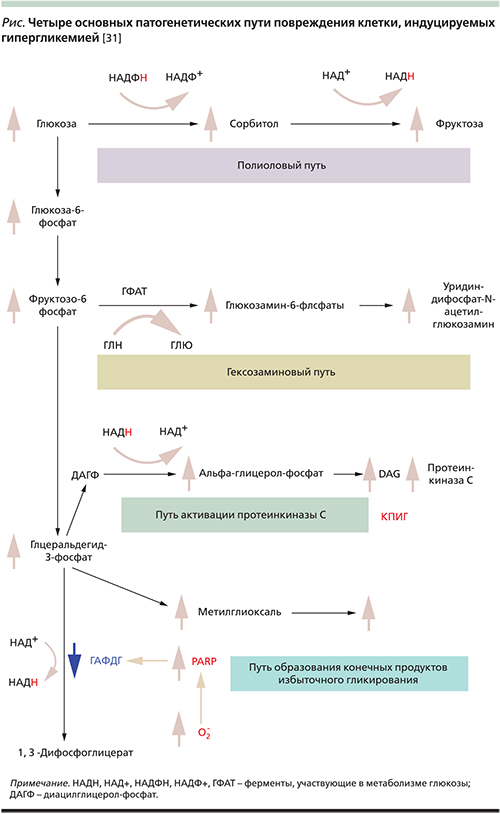
Этиология ДПН гетерогенна [10]. Хроническая гипергликемия и общее гипергликемическое воздействие – самое важное пусковое звено развития ДПН. К другим значимым патогенетическим механизмам, способствующим формированию ДПН, относятся оксидативный стресс, блокада гексозаминового пути утилизации глюкозы, активация полиолового пути в метаболизме глюкозы, образование массы конечных продуктов избыточного гликирования (КПИГ) и их накопление в нервных волокнах, недостаточность эндоневрального кровотока [9, 14].
Выделяют четыре основных патогенетических пути повреждения клетки, индуцируемых гипергликемией: полиоловый, гексозаминовый, путь активации протеинкиназы С и путь образования КПИГ (см. рисунок). Хроническая гипергликемия внутри клеток, нейронах и в эндотелиоцитах приводит к нарушению энергетического обмена, повышенной продукции активных свободных радикалов (супероксидов), которые повреждают митохондриальную ДНК. В свою очередь это активирует специальные полимеразы PARP (Poly[ADP-ribose] polymerase), которые уменьшают активность ключевого фермента гликолиза – глицеральдегид-3-фосфат дегидрогеназы (ГАФДГ). В этих условиях утилизация глюкозы становится невозможной, происходит накопление глицеральдегид-3-фосфата и его предшествующих метаболитов, активируются четыре вышеуказанных альтернативных пути метаболизма глюкозы [13]. Промежуточные продукты метаболизма глюкозы токсичны. Их накопление в нейронах и эндотелиоцитах приводит к развитию невропатии и ангиопатии. Оксидативный стресс, вызванный избыточным образованием свободных радикалов, ответствен за нарушение обмена глюкозы [14].
По данным различных исследований, к факторам, способствующим развитию ДПН, относятся возраст, продолжительность течения СД, уровень гликированного гемоглобина в крови (HbA1c) [9].
Диагностика типичной ДПН
К характерным клиническим проявлениям ДСПН относятся симметричные нарушения поверхностной чувствительности в ногах, начинающиеся со стоп, в виде онемения, парестезий, боли, жжения. При прогрессировании ДСПН могут присоединяться чувствительные нарушения в кистях. За счет повреждения волокон глубокой чувствительности возникает снижение или исчезновение ахилловых, а при прогрессировании процесса – и коленных рефлексов [10]. Нарушение проприоцептивной чувствительности в ногах может приводить к неустойчивости при ходьбе, что также рассматривается как признак ДСПН [10, 17]. Мышечная слабость и гипотрофия мышц при ДСПН минимальны или отсутствуют.
Скринингововое обследование на наличие ДСПН рекомендуется проводить всем пациентам с СД: сразу после установки диагноза СД2, через 5 лет после установки диагноза СД1, а затем – ежегодно [10]. Данное обследование включает набор тестов, оценивающих поверхностную и глубокую чувствительность: исследование болевой чувствительности (с помощью неврологической иглы), температурной (с помощью термоэстезиометра или пробирок с холодной и теплой водой), вибрационной (с помощью камертона в 128 Гц), тактильной (при использовании 10-граммового монофиламента), коленных и ахилловых рефлексов [8]. Выявление симметричных чувствительных нарушений в ногах по результатам более чем 1 теста у пациента с длительно текущим СД свидетельствует о вероятности наличия ДСПН в 87% случаев [8, 10].
Диагноз ДСПН считается достоверным только при наличии данных электронейромиограмии (ЭНМГ), подтверждающих повреждение чувствительных и в меньшей степени двигательных волокон в дистальных сегментах нервов конечностей [9]. ДПН может дебютировать с поражения тонких волокон, которое не выявляется при ЭНМГ. В этом случае полезным оказывается проведение ортостатической пробы или количественного вегетативного тестирования (исследования функции вегетативных волокон), а также количественного сенсорного тестирования (исследование тонких волокон, проводящих болевую и температурную чувствительность) [9].
К информативным методам диагностики повреждения и утраты нервных волокон периферических нервов относятся исследование плотности внутрикожных нервных волокон и корнеальная конфокальная микроскопия [9, 10].
Выяснено, что в 10% случаев у пациентов с СД наблюдаются полиневропатии недиабетической природы – воспалительные дизиммунные, дистиреоидные, В12-дефицитные, наследственные [18]. Диагноз ДПН может быть поставлен после исключения других причин поражения периферических нервов.
Терапевтическая тактика ведения пациентов с типичной ДПН
Контроль уровня гликемии. Первый этап лечения пациентов с ДПН – достижение показателей гликемии, близких к норме. Нормализация уровня HbA1c должна предшествовать медикаментозной терапии ДПН [10]. Поддержание нормального уровня гликемии у пациентов с СД1 предупреждает развитие как невропатии, так и других микроваскулярных осложнений – ретинопатии и нефропатии [25].
В отношении пациентов с СД2 и прогнозом развития ДПН выводы неоднозначны [9, 10, 20]. Результаты одних исследований поддерживают гипотезу о том, что контроль уровня гликемии предупреждает развитие ДСПН, но большинство других свидетельствует о несостоятельности этой гипотезы. Однако, по мнению Dan Ziegler и соавт., отрицательные результаты исследований связаны с погрешностями в их дизайне [26]. Так, в отличие от крупного исследования по контролю СД1 и его осложнений (Diabetes Control and Complications Trial, DCCT) [27] в 6 рандомизированных контролируемых исследованиях по СД2, включенных в последний мета-анализ [28], отмечается более ограниченная оценка ДСПН, а в дизайне ни одного из них не была поставлена задача оценить влияние усиленного контроля гликемии на вероятность развития ДСПН [26]. Превосходство усиленного контроля уровня гликемии над обычным было выявлено в проспективном исследовании по СД2 в Великобритании (UK Prospective Diabetes Study, UKPDS), однако достоверные положительные результаты отмечены только через 15 лет от начала наблюдения за пациентами [29].
Недостаточный гликемический контроль, гипергликемия – предикторы возникновения невропатической боли [30], однако для предупреждения развития и прогрессирования ДСПН только контроля уровня гликемии недостаточно [27].
Образ жизни. Соблюдение диеты, поддержание или достижение нормальной массы тела, занятия лечебной гимнастикой, повседневная активность – базовые нелекарственные методы лечения СД, предупреждения развития и прогрессирования его осложнений, в частности ДСПН [20]. Данные ряда исследований свидетельствуют, что для предупреждения осложнений СД целесообразен контроль липидного профиля, массы тела, значений артериального давления, прекращение курения и употребления алкоголя [31].
Фармакотерапия боли. Для лечения болевой ДПН используются антидепрессанты (амитриптилин, дулоксетин, венлафаксин), антиконвульсанты (прегабалин, габапентин, вальпроат), опиоиды и крем с капсаицином [19, 20]. Перечисленные препараты достоверно эффективны в облегчении невропатической боли, но, оказывая лишь симптоматическое действие, не замедляют процесса повреждения нервных волокон [19, 20].
Фармакотерапия, направленная на изменение течения типичной ДПН. Лекарственная терапия, направленная на изменение течения ДСПН, продолжает активно обсуждаться. В России в качестве возможной патогенетической терапии ДСПН обсуждаются препараты α-липоевой кислоты (АЛК), витаминов группы В и комплексы витаминов группы В, метаболически активных веществ [21, 22].
К препаратам с антиоксидантной активностью принято относить АЛК, которая при введении в организм восстанавливается до дигидролипоевой кислоты и нейтрализует свободные радикалы, супероксиды [22]. Результаты мета-анализов клинических исследований подтвердили эффективность АЛК в дозе 600 мг/сут в виде внутривенных введений в течение 3 недель при лечении ДПН [32, 33]. Эффективность таблетированной формы АЛК также доказана в ряде зарубежных и российских исследований [32, 34, 35]. Однако продолжительность приема этой формы препарата и необходимость повторных курсов лечения продолжают обсуждаться [19, 20, 32]. Отмечается необходимость проведения большого рандомизированного плацебо-контролируемого исследования эффективности таблетированных форм АЛК при ДПН с длительным наблюдением за пациентами [22].
Можно сказать, что назначение витаминов группы В, комплексных препаратов витаминов группы В и метаболически активных веществ при ДПН стало уже традицией. Но каковы же реальные возможности указанных групп препаратов в терапии ДПН?
Витамины группы В выполняют ряд важных для нервной ткани функций [21]. Тиамин (витамин В1) участвует в процессах регенерации поврежденных нервных волокон и обеспечивает энергией аксональный транспорт. Активная форма тиамина – тиаминдифосфат – кофактор фермента транскетолазы. При СД снижается активность транскетолазы, что приводит к накоплению промежуточных продуктов метаболизма глюкозы. Терапевтические дозы водорастворимого тиамина обладают низкой биодоступностью из-за разрушения ее в кишечнике под действием тиаминаз [21]. Бенфотиамин – жирорастворимая форма тиамина, устойчивая к действию кишечных тиаминаз и обладающая высокой биодоступностью [21]. Пиридоксин (витамин В6) участвует в синтезе транспортных белков нервных волокон. Цианокобаламин (витамин В12) участвует в формировании структурных компонентов клеточных мембран.
Результаты трехнедельного рандомизированного контролируемого исследования BEDIP продемонстрировали, что прием 400 мг бенфотиамина приводит к значительному уменьшению интенсивности боли, но не улучшает вибрационную чувствительность, что, по заключению авторов, может быть связано с недостаточной продолжительностью терапии [36]. В последующем был доказан дозозависимый эффект препарата. Так, в рандомизированном двойном слепом плацебо-контролируемом исследовании BENDIP лечение пациентов с ДПН бенфотиамином в дозе 600 мг/сут в течение 6 недель привело к клинически значимому улучшению, по данным шкалы NSS (Neuropathy Symptom Score), по сравнению с пациентами, получающими бенфотиамин в дозе 300 мг и плацебо [37].
В 2008 г. опубликован Кокрановский систематический обзор результатов исследований, посвященных эффективности терапии ДПН и алкогольной полиневропатии (АПН) витаминами группы В [38], которые сравнивались с плацебо и другими препаратами (антиоксидантами). В обзор вошли 30 исследований, в целом – 741 пациент с ДПН или АПН. В двух небольших исследованиях витамины группы В не оказали значимого влияния на уменьшение боли. В одном исследовании показана эффективность витамина В1 в улучшении вибрационной чувствительности. По результатам двух крупных исследований, более высокие, чем обычные дозы комплекса витаминов группы В, приводят к значимому, но кратковременному уменьшению интенсивности боли и выраженности парестезий. Был сделан вывод, что количество рандомизированных исследований эффективности терапии ДПН и АПН витаминами группы В ограничено, недостаточно данных для того, чтобы сделать вывод об их эффективности или неэффективности. Доказан факт хорошей переносимости пациентами с ДПН и АПН витаминов группы В.
Полагают, что нейротропные витамины и метаболически активные вещества дополняют действие друг друга в биохимических процессах, происходящих в нервной ткани [39, 40]. Для лечения ДПН разработаны препараты, представляющие собой комплекс витаминов и метаболически активных веществ. К таким лекарственным средствам относится Кокарнит, в состав которого входят трифосаденин, кокарбоксилаза, цианокобаламин и никотинамид [40]. Каждый из указанных компонентов Кокарнита выполняет определенную функцию в процессах метаболизма. Трифосаденин – производное аденозина, один из ключевых компонентов физиологического процесса энергообеспечения клеток. Кокарбоксилаза – кофермент, образующийся в организме из поступающего извне тиамина (витамина В1). Кокарбоксилаза входит в состав фермента карбоксилазы, катализирующего карбоксилирование и декарбоксилирование α-кетокислот, участвует в синтезе нуклеиновых кислот, белков и липидов, в процессах усвоения глюкозы. Цианокобаламин (витамин В12) при введении в организм превращается в метилкобаламин и 5-дезоксиаденозилкобаламин. Метилкобаламин участвует в реакциях превращения гомоцистеина в метионин и S-аденозилметионин – ключевых реакциях метаболизма пиримидиновых и пуриновых оснований; 5-дезоксиаденозилкобаламин служит кофактором при изомеризации L-метилмалонила-КоА в сукцинил-КоА – важной реакции метаболизма углеводов и липидов. Дефицит витамина В12 приводит к нарушению образования миелиновой оболочки нейронов. Никотинамид – одна из форм витамина РР, участвует в окислительно-восстановительных процессах в клетке, тканевом дыхании.
Авторы нескольких клинических исследований продемонстрировали эффективность и безопасность Кокарнита в лечении пациентов с ДСПН [40]. По данным открытого исследования, включившего 36 пациентов с СД1, СД2 и ДСПН, через месяц от начала лечения Кокарнитом у 21 (58,6%) пациента отмечен регресс болей и парестезий в стопах, у всех пациентов было отмечено улучшение показателей функции проведения чувствительных и моторных волокон, по данным ЭНМГ (скорости распространения возбуждения, амплитуды M-ответов) [41]. Авторы другого открытого исследования, включившего 30 пациентов с СД1, СД2 и ДСПН, также указывают на уменьшение выраженности клинических проявлений невропатии и улучшение показателей ЭНМГ с периферических нервов ног у всех пациентов, получавших терапию Кокарнитом [42]. Добавление Кокарнита к стандартной терапии СД и ДСПН повышает эффективность проводимого лечения. На это указывают результаты сравнительного исследования, включившего 45 пациентов с СД1 и СД2 [40]. Уменьшение выраженности клинических проявлений ДСПН (боли, онемения, парестезии) отмечено у 88,9% пациентов на 6–7-й дни лечения Кокарнитом. При этом наибольшая эффективность терапии наблюдалась у пациентов с наименьшей длительностью течения ДСПН (средняя длительность=2,3±0,7 года). Планируется проведение более крупных исследований эффективности терапии Кокарнитом с более длительным периодом наблюдения.
Кокарнит выпускается в форме лиофилизата для приготовления раствора. Упаковка препарата содержит ампулы с лекарственным средством и ампулы с растворителем – раствором лидокаина (10 мг на 2 мл физиологического раствора). Приготовленный раствор вводится внутримышечно. Рекомендуемый курс лечения – 2 мл (1 ампула) раствора Кокарнита в течение 9 дней.
Психологическая помощь пациентам с СД и ДПН. При развитии психологических проблем, связанных с трудностями принятия пациентом диагноза СД, психических расстройств (депрессия, тревожное расстройство), нарушений сна и наличии невропатической боли при болевой форме ДСПН целесообразно применение когнитивно-поведенческой терапии (КПТ) [23, 24] – самого изученного вида психотерапии [43]. КПТ обладает большой базой доказательной эффективности в лечении ряда психических, неврологических, терапевтических заболеваний и широко применяется в клинической практике [44]. Опубликованы результаты свыше 300 контролируемых рандомизированных исследований эффективности КПТ при распространенных психических, неврологических и терапевтических расстройствах [45].
КПТ рекомендуется для лечения депрессии (уровень рекомендаций А) [46, 47], тревожных расстройств (уровень рекомендаций А) [47], обсессивно-компульсивного расстройства (уровень рекомендаций А) [48], хронического посттравматического стрессового расстройства (уровень рекомендаций А) [49], фибромиалгии (уровень рекомендаций А) [50, 51], хронической неспецифической боли в нижней части спины (уровень рекомендаций А) [52], мигрени (уровень рекомендаций А) [53], головной боли напряжения (уровень рекомендаций С) [54], инсомнии (уровень рекомендаций В) [55, 56] и других заболеваний.
В соответствии с результатами крупного статистического исследования, проведенного на базе междисциплинарной клиники лечения болевой ДПН, у 2/3 пациентов диагностируются тревожные и/или депрессивные расстройства, 95% пациентов страдают нарушениями сна [20]. Указанные коморбидные расстройства ухудшают течение болевой ДПН, снижают функциональную активность пациентов. Очевидна практическая значимость применения КПТ в ведении пациентов с болевой ДПН и коморбидными расстройствами.
В соответствии с последними рекомендациями Национального руководства США по лечению СД КПТ – эффективный поведенческий метод лечения пациентов с СД, который помогает им принять болезнь без формирования психологических и психических проблем и следовать рекомендациям врача в отношении образа жизни (уровень рекомендаций А) [57]. С помощью метода КПТ врач мотивирует пациентов на лечение и поддержание повседневной активности, что улучшает течение СД.
Обсуждается эффективность КПТ в лечении невропатической боли при ДСПН. Опубликованы результаты американского пилотного рандомизированного контролируемого исследования, проведенного под руководством известного когнитивно-поведенческого терапевта J.D. Otis [24]. В исследование были включены 20 пациентов с болевой ДСПН, созданы две группы сравнения: 1) стандартная терапия ДСПН; 2) комбинированная терапия – стандартная терапия ДСПН и КПТ. Период наблюдения за пациентами составил 4 месяца. Авторы сделали вывод, согласно которому добавление КПТ к стандартной терапии ДСПН повышает эффективность проводимого лечения: у пациентов, получающих комбинированное лечение, более существенно уменьшается интенсивность боли и ее негативное влияние на повседневную активность.
Таким образом, интерес к изучению патогенеза, способов ранней диагностики и эффективных методов лечения ДПН продолжает расти. Диагностика ДСПН основывается на клинической картине заболевания, результатах неврологического осмотра и данных ЭНМГ периферических нервов. Количественное сенсорное и вегетативное тестирование – чувствительные методы диагностики повреждения тонких чувствительных и вегетативных волокон периферических нервов. К современным методам диагностики повреждения и утраты нервных волокон периферических нервов относятся исследование плотности внутрикожных нервных волокон и корнеальная конфокальная микроскопия. Оптимальный контроль уровня гликемии, образовательная программа, образ жизни (диета, отказ от курения, поддержание или достижение нормальной массы тела, лечебная гимнастика, поддержание повседневной активности) и при наличии показаний когнитивно-поведенческая терапия – эффективные способы улучшения течения СД и ДСПН.
В фармакотерапии невропатической боли при ДПН достигнуты значительные успехи, однако данная терапия не предупреждает и не замедляет процессы повреждения нервных волокон. На сегодняшний день особое внимание уделяется поиску патогенетических лекарственных препаратов, которые изменяют течение ДПН. К препаратам с возможной патогенетической активностью относятся АЛК, витамины группы В, комплексы витаминов группы В и метаболически активных веществ. Кокарнит – комплексный препарат, содержащий трифосаденин, кокарбоксилазу, цианокобаламин и никотинамид, которые участвуют в энергообеспечении клеток и синтезе миелина нервных волокон. Результаты нескольких отечественных исследований показали эффективность и безопасность применения Кокарнита в лечении ДСПН.



