Обоснование
Микроскопический полиангиит (МПА) относится к группе системных васкулитов, ассоциированных с антителами к цитоплазме нейтрофилов (АНЦА) и представляет собой некротизирующий васкулит с минимальными иммунными депозитами, поражающий мелкие сосуды (капилляры, артериолы, венулы), реже – артерии малого и среднего калибра [1]. Некротизирующий васкулит при МПА имеет распространенный характер, но наиболее выраженные изменения наблюдаются в легких и почках. Чаще при МПА выявляют АНЦА к миелопероксидазе, реже – к протеиназе-3. Ранняя диагностика МПА по-прежнему вызывает затруднения в связи с разнообразием клинических проявлений и отсутствием классификационных критериев заболевания. Чаще всего приходится дифференцировать МПА с узелковым полиартериитом и с другими АНЦА-ассоциированными васкулитами. В отличие от гранулематоза с полиангиитом (ПА) при МПА не наблюдается формирования гранулем и деструкции тканей. В отличие от эозинофильного гранулематоза с ПА для МПА нехарактерна эозинофилия и бронхиальная астма. В отличие от узелкового полиартериита при МПА реже поражаются сосуды среднего калибра и не наблюдается образования аневризм. Начальные признаки заболевания неспецифичны и включают синдромы для большинства воспалительных заболеваний: лихорадка, слабость, похудание, миалгии, артралгии или артриты [2]. Возможно поражение кожи в виде пальпируемой пурпуры, язв, некрозов; патология верхних дыхательный путей в виде атрофии слизистой оболочки носа и некротизирующего ринита, эписклерит, боли в животе, периферическая полиневропатия [2–5]. Перечисленные симптомы выражены неярко и, как правило, развиваются на фоне тяжелой патологии почек и легких [2]. Поражение легких наблюдается у 12–29% больных МПА и морфологически представлено некротизирующим альвеолитом и капилляритами [2]. Поражение почек возникает у большинства больных [2–5] и представлено фокальным сегментарным некротизирующим экстракапиллярным гломерулонефритом с «полулуниями», часто приобретающим быстропрогрессирующее течение с развитием тяжелой почечной недостаточности и плохим прогнозом в отсутствие своевременного адекватного лечения [3].
Цель описания клинического случая – демонстрация сложности ранней верификации диагноза МПА.
Клинический случай
Пациент Д 26.05.1958 г.р. В июне 2019 г. появились повышение температуры до 38 ºС, боли в голеностопных и плечевых суставах, миалгии, похудание на 5 кг за месяц, отечность и онемение кистей и стоп. Впервые выявлено повышение артериального давления до 170/100 мм рт.ст. В июле 2019 г. обследован по месту жительства. В общем анализе мочи (ОАМ): относительная плотность – 1008, белок – 6,5 г/л, лейкоциты – 1 в поле зрения (п/зр), эритроциты – 22 в п/зр. В общем анализе крови (ОАК): лейкоцитоз – 11 тыс/мкл, анемия с гемоглобином – 111 г/л, СОЭ – 87 мм/ч (метод Вестергрен, норма: 0–30 мм/ч). В биохимическом анализе крови: общий белок – 66 г/л; в белковых фракциях: гипергамма-глобулинемия – 25%, креатинин сыворотки крови – 73 мкмоль/л, С-реактивный белок (СРБ) 91 мг/л (норма: 0,01–5 мг/л). В сыворотке крови методом иммуноблотинга обнаружены АНЦА-антитела к протеиназе-3. Рентгенография голеностопных суставов: без патологии. Рентгенография органов грудной полости: без патологии. Фиброгастродуоденоскопия (ФГДС): хронический гастрит. Колоноскопия: патологии не выявлено. Эхокардиоскопия (Эхо-КС): концентрическое ремоделирование левого желудочка. Ультразвуковое исследование (УЗИ) органов брюшной полости: без патологии. УЗИ щитовидной железы: без патологии. По УЗИ почки и толщина паренхимы нормальных размеров, чашечно-лоханочная си-стема не расширена. Консультирован ревматологом 30.08.2019: критериев для диагноза АНЦА-ассоциированного васкулита недостаточно. По поводу артралгии и миалгии самостоятельно принимал кеторол. Консультирован нефрологом, госпитализирован в нефрологическое отделение Кировской областной клинической больницы (КОКБ). Данные обследования: в ОАМ относительная плотность – 1016, белок – 0,65 г/л, эритроциты – 26 в п/зр, лейкоциты – 3 в п/зр. Суточная протеинурия – 1,02 г. В ОАК: анемия с гемоглобином – 112 г/л, лейкоцитоз – 14,9 тыс/мкл, тромбоцитоз – 858 тыс/мкл. СОЭ – 87 мм/ч. В биохимическом анализе крови: креатинин – 77 мкмоль/л, скорость клубочковой фильтрации (СКФ) – 93 мл/мин, мочевина – 5 ммоль/л, калий – 4,5 ммоль/л, СРБ – 77 мг/л, холестерин общий – 6,2 ммоль/л, липопротеиды низкой плотности – 2,1 ммоль/л. Глюкоза и трансаминазы в норме. Альбумин – 42 г/л, общий белок – 66 г/л. При анализе белковых фракций: гипергаммаглобулинемия – 26%. В сыворотке крови методом иммуноблотинга обнаружены АНЦА к протеиназе-3 (++). Маркеры гепатитов В и С, ВИЧ не обнаружены. Коагулограмма в норме. По данным УЗИ: правая почка – 105×60 мм, левая – 105×60 мм, толщина паренхимы – 17–18 мм, чашечно-лоханочная система не расширена. Мочевой пузырь и предстательная железа по УЗИ без патологии. Проведена электронейромиография: выявлена сенсорная, преимущественно аксональная невропатия периферических нервов верхних и нижних конечностей. Допплер артерий нижних конечностей обнаружил окклюзию задне-большеберцовой артерии справа. Нефробиопсия проведена 10.09.2019. Гистологическое исследование биоптата проведено в ГБ № 52 Москвы, включало световую микроскопию с окрасками: гематоксилин-эозин, ШИК-реакцию, трихром по Массону, а также иммунофлуоресценцию (рис. 1А, Б).
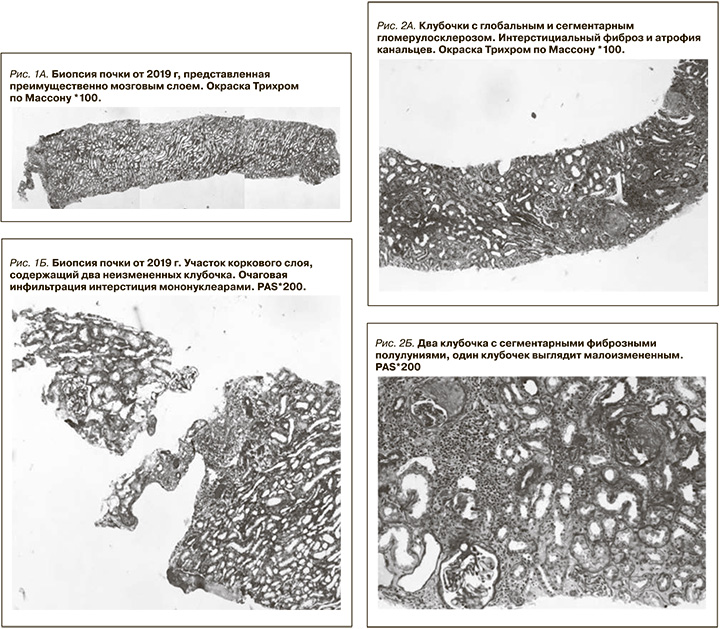
Препарат для световой микроскопии представлен преимущественно мозговым слоем, содержит 3 клубочка. Клубочки не увеличены в размерах, без мезангиальной и эндокапиллярной гиперклеточности. Стенки капиллярных петель не утолщены, одноконтурные. В препарате для иммунофлуоресценции 12 клубочков, склерозированных нет. Клубочки не увеличены в размерах, выглядят малоизмененными. Стенки капиллярных петель не утолщены, одноконтурные. Отек интерстиция. Очаговая инфильтрация интерстиция мононуклеарами с незначительными явлениями тубулита (до 2–3 лимфоцитов) в атрофичных канальцах. Артерии и артериолы без особенностей. Иммунофлуоресценция (БП 54206-13): иммуноглобулин G (IgG) – негативно, IgA – негативно, IgM – негативно, C1q – негативно, C3 – негативно, кaппa – негативно, лямбда – негативно, фибрин – негативно. Заключение: очаговый интерстициальный нефрит. Признаки острого интерстициального нефрита в нефробиоптате расценены как лекарственное поражение (пациент принимал кеторол по поводу артралгии, миалгии, лихорадки). С учетом клинико-лабораторных данных (фебрильная лихорадка, миалгия, артралгия, полиневропатия, артериальная гипертензия, мочевой синдром с умеренной протеинурией и эритроцитурией, лейкоцитоз, повышение СОЭ и уровня СРБ, гипергаммаглобулинемия, положительный титр АНЦА к протеиназе-3) был диагностирован АНЦА-ассоциированный гломерулонефрит (АНЦА-ГН), предположительно в рамках МПА. Назначена иммуносупрессивная терапия: пульсы метилпреднизолона (суммарная доза составила – 1,75 г) с последующим переходом на пероральный прием преднизолона 35 мг/сут. Проведен пульс циклофосфана (ЦФ) 800 мг однократно. Также получал периндоприл, амлодипин, омепразол, препараты кальция, аторвастатин, ацетилсалициловую и тиоктовую кислоты. На фоне иммуносупрессивной терапии наблюдалось быстрое улучшение: нормализовалась температура, исчезли миалгии и артралгии, восстановилась чувствительность в кистях и стопах, нормализовались артериальное давление, уровни СРБ и гемоглобина, уменьшилась выраженность протеинурии и эритроцитурии. Азотвыделительная функция почек оставалась сохранной.
После выписки наблюдался нефрологом в течение полугода. Через 3 месяца анализы мочи нормализовались, АНЦА в крови не обнаруживались. Доза преднизолона была снижена до полной отмены в течение 6 месяцев. Принимал периндоприл 2 мг/сут., ацетилсалициловую кислоту 100 мг/сут., аторвастатин 20 мг/сут. Через 6 месяцев после выписки перестал обращаться за врачебной помощью, со слов: в связи с хорошим самочувствием.
В феврале 2022 г. почувствовал ухудшение: вновь появились общая слабость, миалгии, артралгии, онемение и парестезии в области стоп, субфебрилитет. Самостоятельно начал принимать преднизолон 5 мг/сут. – без эффекта. В апреле 2022 г. обратился к нефрологу. От 26.04.2022 в ОАМ: относительная плотность – 1008, белок – 1,92 г/л, лейкоциты – 3 в п/зр, эритроциты – 11 в п/зр. в ОАК: лейкоциты – 11 тыс/мкл, гемоглобин – 94 г/л, тромбоциты – 525 тыс/мкл. СОЭ – 55 мм/ч. Впервые обнаружено повышение азотемии с креатинином 203 мкмоль/л, мочевиной 16 ммоль/л. СКФ снизилась до 29 мл/мин (до уровня хронической болезни почек С4). Общий белок – 71 г/л, СРБ – 25 мг/л, калий – 4,9 ммоль/л. Глюкоза и трансаминазы в норме. Обнаружены АНЦА к протеиназе-3 методом иммуноблотинга (+++). По УЗИ почки сохранных размеров: правая – 103х50 мм, левая – 105х50 мм, толщина паренхимы – 20 мм. Проведена компьютерная томография (КТ) органов грудной полости, патологии не выявлено. КТ придаточных пазух носа и консультация оториноларинголога: данных за синусит нет. Электронейромиография: аксонально-демиелинизирующая сенсомоторная невропатия нижних конечностей. ФГДС: хронический гастрит. УЗИ органов брюшной полости, мочевого пузыря, предстательной железы патологии не обнаружило. Повторная нефробиопсия проведена 17.05.2022 (рис. 2А, Б).
В препарате 18 клубочков, 7 из которых полностью склерозированы, в части склерозированных клубочков определяются фрагменты фиброзных полулуний. В 5 из оставшихся клубочках имеются сегментарные фиброзные полулуния, еще в 2 определяются небольшие сегментарные фиброзно-клеточные полулуния. Оставшиеся клубочки выглядят малоизмененными. Сохранные стенки капиллярных петель не утолщены, одноконтурные. Диффузно-очаговый фиброз интерстиция и атрофия канальцев занимают около 20–25% площади паренхимы. Диффузно-очаговая интерстициальная инфильтрация мононуклеарами в зонах фиброза. Артерии и артериолы без особенностей. Иммунофлуоресценция не выявила иммунных депозитов. Заключение: диффузный склерозирующий и некротизирующий гломерулонефрит с 63% преимущественно фиброзных полулуний.
С учетом клинической картины, лабораторных, морфологических, инструментальных признаков сформулирован клинический диагноз: «системный некротизирующий васкулит, АНЦА ассоциированный (АНЦА к протеиназе-3): МПА, хроническое течение, высокая активность (BVAS 20 баллов), с поражением почек (диффузный склерозирующий и некротизирующий гломерулонефрит, активная фаза), нервов (полиневропатия нижних конечностей, сенсорная форма)».
Возобновлена иммуносупрессивная патогенетическая терапия глюкокортикостероидами (ГКС)и ЦФ. После пульса метилпреднизолона 500 мг назначен преднизолон перорально 30 мг/сут. Проводились пульсы ЦФ по 400–600 мг каждые 3 недели в течение полугода. На фоне патогенетической терапии наблюдалось быстрое клиническое улучшение и снижение уровня креатинина до 152 мкмоль/л. Через 6 месяцев достигнута ремиссия АНЦА-ГН: восстановление азотвыделительной функции почек, снижение протеинурии менее 0,5 г/сут., исчезновение эритроцитурии. Последнее введение циклоосфана в ноябре 2022 г., суммарная доза составила 4,8 г.
В настоящее время проводится противорецидивная терапия азатиоприном 50 мг/сут., доза преднизолона снижена до 7,5 мг/сут. Лабораторные данные от 09.01.2023: в ОАМ относительная плотность – 1017, белок – 0,4 г/л, лейкоциты – 0 в п/зр, эритроцитов нет. Суточная протеинурия – 0,14 г. В ОАК: лейкоциты – 8,2 тыс/мкл, гемоглобин – 139 г/л, тромбоциты – 367 тыс/мкл, СОЭ – 7 мм/ч. В биохимическом анализе крови: креатинин – 106 мкмоль/л, СКФ – 62 мл/мин, мочевина – 6 ммоль/л, общий белок – 69 г/л, альбумин – 43 г/л, глюкоза – 4,2 ммоль/л, трансаминазы в норме. АНЦА к протеиназе-3 в крови не обнаружены. Продолжается противорецидивная терапия азатиоприном и преднизолоном, срок наблюдения в настоящее время составляет 43 месяца.
Обсуждение
Типичная морфологическая картина поражения почек при АНЦА-васкулите представлена третьим (малоиммунным) типом экстракапиллярного гломерулонефрита с клеточными и/или фиброзно-клеточными полулуниями, а также фокально-сегментарным фибриноидным некрозом капилляров клубочков и артериол. Наряду с гломерулярными изменениями при АНЦА-ГН обнаруживают и тубулоинтерстициальные изменения [6]. Морфологические признаки АНЦА-ГН не позволяют дифференцировать нозологические формы АНЦА-васкулитов, поэтому окончательный диагноз АНЦА-васкулита ставят с учетом особенностей экстраренальных проявлений заболевания в соответствии с определением, принятым на согласительной конференции в Чапел-Хилле в 2012 г. [7].
Трудности диагностики МПА в данном клиническом случае в дебюте заболевания (в 2019 г.) были связаны с отсутствием характерных морфологических признаков АНЦА-гломерулонефрита при первой нефробиопсии. Признаки интерстициального нефрита в биоптате данного пациента в то время нами были расценены как возможное лекарственное повреждение на фоне приема кеторола. Однако, по данным литературы, клеточная инфильтрация интерстиция полиморфноядерными лейкоцитами и тубулит встречаются при высокой активности АНЦА-васкулита [6]. Отсутствие полулуний в первом биоптате могло быть обусловлено его низким качеством, поскольку он содержал всего 3 клубочка. Малое число клубочков в биоптате (менее 10) не всегда позволяет обнаружить фокальные (очаговые) изменения. Пациенту была предложена повторная нефробиопсия, но в то время пациент от нее воздержался.
С учетом совокупности клинико-лабораторных данных было высказано мнение об АНЦА-ГН, предположительно в рамках МПА. Назначенная иммуносупрессивная терапия ГКС и ЦФ позволила получить быструю ремиссию заболевания, азотвыделительная функция почек оставалась сохранной. В дальнейшем противорецидивную иммуносупрессивную терапию пациент не получал, не наблюдался. Через 2 года развился тяжелый рецидив заболевания с клиникой быстропрогрессирующего гломерулонефрита, со снижением функции почек до уровня хронической болезни почек С4 при нормальных размерах почек. Проведенная повторно нефробиопсия обнаружила характерные морфологические признаки АНЦА-гломерулонефрита с полулуниями.
Особенностью течения МПА в приведенном клиническом случае явилось развитие заболевания с преимущественным поражением почек при скудности экстраренальных системных проявлений, а также повышенный титр АНЦА к протеиназе-3 в отсутствие более характерных для МПА антител к миелопероксидазе нейтрофилов.
Превалирование в клинической картине поражения почек и/или легких перед другими системными проявлениями характерно для МПА [3, 5]. По данным литературы, гломерулонефрит более характерен для МПА (98–100% случаев) и реже встречается при эозинофильном гранулематозе с ПА (44%) и гранулематозе с ПА (62%) [3]. Поражения легких, которое может протекать и бессимптомно при МПА [3], при обследовании выявлено не было. По данным клинических исследований, при МПА с АНЦА к протеиназе-3 (как у нашего пациента) по сравнению с МПА позитивным по антителам к миелопероксидазе менее свойственно поражение легких и чаще наблюдается быстропрогрессирующее течение гломерулонефрита [3, 4]. Периферическая полиневропатия, выявленная у нашего пациента, согласно клиническим исследованиям при МПА, встречается в 27–62% случаев и обусловлена некротизирующим поражением мелких сосудов, питающих нервы [4, 8, 9].
Лечение МПА по-прежнему остается актуальной и до конца нерешенной проблемой. В дебюте МПА или при развитии рецидива заболевания в качестве индукционной терапии применяют ГКС в сочетании с ЦФ в виде пульс-терапии и/или ритуксимабом [10]. Своевременное назначение иммуносупрессантов способствует статистически значимому улучшению почечного прогноза (р=0,001) [11]. У нашего пациента иммуносупрессивная терапия ГКС и ЦФ при рецидиве позволила предотвратить прогрессирование заболевания, стабилизировать и затем улучшить функцию почек. По индексу ANCA renal risk score, предложенному S.R. Brix et al., (2018) [12], число баллов у данного пациента составило 2 (средний риск), 36-месячная почечная выживаемость в группе среднего риска, по автору, составляет 83–84%. В настоящее время почечная выживаемость пациента уже составила 43 месяца, что подтверждает прогностическую ценность данного индекса.
Таким образом, прогноз и качество жизни пациентов с МПА непосредственно связаны с ранней диагностикой и своевременно назначенной иммуносупрессивной терапией до развития тяжелого поражения почек и/или легких. Диагностика МПА и его рецидивов требует всестороннего вдумчивого анализа всех клинических, лабораторных, инструментальных данных в каждом конкретном случае, планомерного обследования и длительного мониторирования состояния пациентов.
Заключение
Диагностика МПА и его рецидивов требует всестороннего анализа совокупности всех клинических проявлений и лабораторно-инструментальных данных в каждом конкретном случае, планомерного обследования и длительного мониторирования состояния пациентов. Прогноз и качество жизни пациентов с МПА зависят от своевременной диагностики заболевания, проведения иммуносупрессивной терапии ГКС и цитостатиками.



