Введение
Пандемия коронавирусной болезни 2019 г. (COVID-19) требует особого внимания к пациентам с ослабленным иммунитетом. Реципиенты паренхиматозных органов, получающих постоянную иммуносупрессивную терапию, подвержены повышенному риску тяжелого течения SARS-CoV-2 и смерти, чем население в целом [1, 2]. Пациентам с высоким риском развития тяжелого течения заболевания по мере увеличения клинической тяжести симптомов SARS-CoV-2 было рекомендовано эмпирическое поэтапное снижение иммуносупрессивной терапии [3, 4]. Наряду с общепризнанным положительным эффектом от прерывания терапии антиметаболитами (азатиоприном – АЗА, микофенолат мофетилом – ММФ) и рапамицином (imTOR) [4] некоторые исследователи отметили неоднозначное влияние глюкокортикостероидов (ГКС) [5–7] и ингибиторов кальциневрина (ИКН) [8–10] на исходы заболевания у РПТ с SARS-CoV-2.
Цель исследования заключалась в сравнении данных о смертности и иммунносупрессивной терапии РПТ с SARSCoV-2, проходивших лечение в клиниках Москвы, по данным ЕМИАС с 01.02.2020 по 30.09.2020, с систематическим анализом опубликованных исследований по той же теме за аналогичный период времени.
Материал и методы
Систематический обзор проведен в соответствии с предпочтительными элементами отчетности для систематических обзоров и мета-анализа (PRISMA) [11]. В электронных базах данных MEDLINE, Scopus и Кокрановского центрального регистра контролируемых исследований проведен поиск подходящих исследований, опубликованных до сентября 2020 г., в которых оценивалась смертность среди РПТ с SARS-CoV-2 и проводимая иммуносупрессивная терапия. Списки литературы в квалифицированных статьях также были проверены, и исследования добавлены вручную, если это было сочтено целесообразным. Стратегия поиска включала следующие термины: «смертность реципиентов почечного трансплантата», «COVID-19», «факторы риска смертности реципиентов почечного трансплантата (РПТ) с SARS-CoV-2», «иммуносупрессивная терапия», «ингибиторы кальциневрина (ИКН)», «такролимус (FK 506)», «стероиды», «метилпреднизолон», «дексаметазон».
Этот систематический обзор и мета-анализ были сосредоточены на изучении смертности РПТ с SARS-CoV-2. В него были включены исследования, в которых участвовали взрослые реципиенты, прожившие более года после АТП, сообщались данные об их смертности и/или ее причинах, число выживших и умерших, их демографические и/или клинические характеристики, указывалась проводимая иммуносупрессивная терапия. Лечение, связанное с трансплантацией, было извлечено отдельно для выживших и умерших. Поскольку отдельные отчеты о случаях и небольшие серии случаев могут быть подмножеством более крупных клинических регистров, мы выбрали для нашего обзора только исследования с ≥50 пациентов с трансплантированной почкой [12].
Исследования исключались, если в них были педиатрические реципиенты, реципиенты комбинированных трансплантатов почки/поджелудочной железы и реципиенты с отсутствующими данными. Если в двух крупных исследованиях была представлена потенциально дублирующаяся популяция, в качестве основного источника данных выбиралось исследование, в котором сообщалось больше информации о выживших и умерших. В обзор были включены работы, которые соответствовали отчетности о наблюдательных исследованиях в эпидемиологии (STROBE) [13]. Два автора (Н. и М.) независимо друг от друга проверили электронные заголовки, аннотации, и полные тексты статей. Разногласия были разрешены путем консенсуса с третьим автором (З.).
Из каждого исследования была извлечена следующая информация: имена авторов, название журнала, место исследования, страна происхождения, продолжительность исследования, общее число включенных РПТ с SARS-CoV-2, иммуносупрессивная терапия, число выживших и умерших.
Мета-анализ пропорций проводился по методу Мантела– Ханзела с использованием преобразования Фримана–Туки для вычисления взвешенной суммарной доли по модели фиксированных и случайных эффектов. Гетерогенность модели оценивали с использованием p-значения Q-теста Кокрейна [14] и индекса I2. Индекс I2 выше 75% указывает на неоднородность от средней до высокой [15]. Для проверки систематической ошибки публикации мы применяли метод линейной регрессии Эггера и метод ранговой корреляции Бегга с использованием тау Кендалла в качестве меры ассоциации [16]. Потенциальная систематическая ошибка публикации представлена в виде воронкообразного графика.
Ассоциацию между смертностью и частотой назначения иммуносупрессивной терапии проводили с помощью непараметрического парного критерия Вилкоксона для связанных выборок. Данные представлены в виде медианы (Ме) и межквартильного размаха (IQR).
Этического одобрения не требовалось, поскольку наше исследование носило наблюдательный неинтервенционный характер и было мета-анализом.
Результаты
Характеристики включенных исследований
На рис. 1 показана блок-схема выбора исследования. В общей сложности 379 исследований получены с использованием наших критериев поиска. После исключения дублирующихся ссылок и нерелевантных исследований 23 статьи прошли полнотекстовый обзор и 12 из них были включены в окончательный мета-анализ [7–9, 17–25]. Подробная информация о каждом исследовании представлена в табл. 1. Десять из 13 исследований были многоцентровыми и 2 –международными и интернациональными. Всего в мета-анализ вошли 3333 пациента (от 52 до 1011), а уровень смертности варьировался от 11 до 32%.
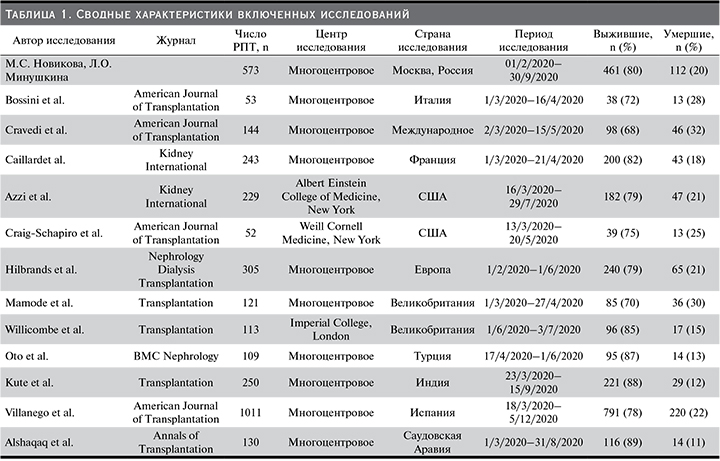
Мета-анализ выживаемости
Совокупный расчетный уровень смертности у РПТ с SARSCoV-2 составил 19,82% (95% ДИ: 18,479–21,209%) в фиксированной модели и 19,30% (95% ДИ: 16,422–22,364%) в случайной модели. Уровень смертности пациентов, госпитализированных в клинические центры Москвы, составил 19,546% (95% ДИ: 16,376–23,034%) (табл. 2, рис. 2) Данные мета-анализа не были гетерогенными: I2=75,42% (95% ДИ: 57,79–85,69%, Q-тест, р-значение <0,0001).
Проведен тест Эггера и Бегга на асимметрию регрессии, который показал отсутствие систематической ошибки публикации (рис. 3).
Мета-анализ иммуносупрессивной терапии
Выявлен положительный эффект терапии такролимусом в отношении выживаемости РПТ с SARS-CoV-2. Такролимус применялся чаще у выживших (Ме – 0,7890, 95% ДИ: 0,5828–0,9200, IQR 0,5828–0,9200) по сравнению с умершими (Ме 0,7860, 95% ДИ 0,3800–0,8625, IQR 0,3800–0,8295; p=0,0195), рис. 4. Терапия ГКС чаще проводилась среди умерших, однако полученные в мета-анализе данные не были достоверными (р=0,25, табл. 3).
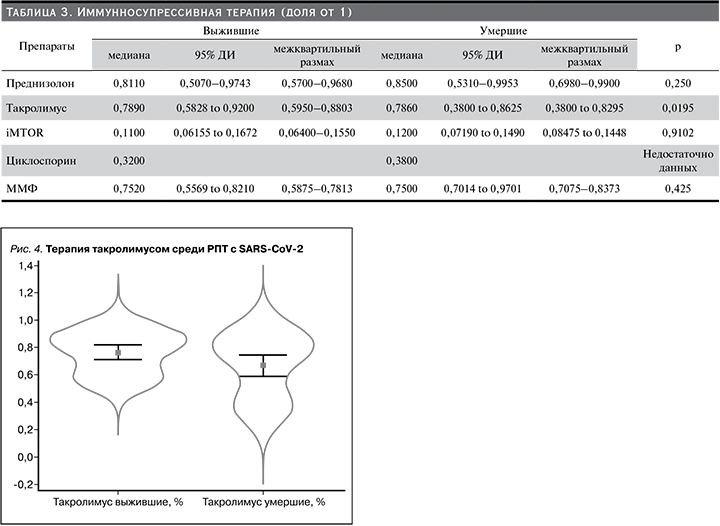
Частота применения iMTOR и ММФ не различалась между выжившими и умершими пациентами.
Обсуждение
Проведенный мета-анализ 13 исследований, включавший 3333 РПТ с SARS-CoV-2, выявил, что по данным ЕМИАС среди пациентов, госпитализированных в клинические центры Москвы, доля умерших и выживаемость практически не различались по сравнению со средними значениями этих показателей в фиксированной и случайной моделях проведенного мета-анализа (табл. 2, рис. 2) При этом систематической ошибки отбора данных не было выявлено (рис. 3).
По данным ЕМИАС, за 8 месяцев наблюдения выживаемость РПТ с SARS-CoV-2 составила почти 80% (табл. 1). Похожий результат по выживаемости был получен в 4 из включенных в мета-анализ исследований [18, 19, 21, 24] (рис. 2).
В исследовании, проведенном S. Caillard и соавт., были представлены результаты реципиентов трансплантатов почек, включенных во французский национальный регистр реципиентов паренхиматозных органов с Covid-19. Во время госпитализации антиметаболиты, ИКН и ингибиторы imTOR были отменены у 70,8% (136 из 192), 28,7% (58 из 202) и 62,1% (18 из 29) пациентов соответственно. Лечение в основном основывалось на гидроксихлорохине (24,7%), противовирусных препаратах (7,8%) и тоцилизумабе (5,3%) [18].
В исследовании, проведенном в Бронксе Y. Azziet al., общая летальность составила 20,5%, но значительно выше (37,8%) cреди пациентов, которым потребовалась госпитализация. На момент постановки диагноза антиметаболиты были отменены 74 (93,7%) пациентам, а ИКН – 11 (13,9%) , в основном после клинического ухудшения (7,8% выживших и 25% умерших). Первоначально всем пациентам назначали гидроксихлорохин, однако эта практика была прекращена из-за отсутствия эффективности. Больные со средней и тяжелой клинической картиной получали повышенные дозы ГКС (44%), тоцилизумаб (14%), экспериментальный ингибитор CCR-5 леронлимаб (7,6%), реконвалесцентную плазму (13,7%), антагонист рецептора интерлейкина-1 (ИЛ-1RA), по 1 больному применяли внутривенный иммуноглобулин и ингибитор тирозинкиназы [19].
В исследовании, проведенном L.B. Hilbrands et al., на основании данных ERACODA (база данных Европейской почечной ассоциации COVID-19) более 70% госпитализированных пациентов получали противовирусное лечение гидроксихлорохином, 18% – высокими дозами ГКС. Терапия тоцилизумабом была нечастой. Доза ИКН была снижена 14% с полной отменой 15% пользователей. ММФ был отменен в 54% случаев, тогда как АЗА и ингибиторы imTOR почти не отменялись. Дозу преднизолона чаще всего не меняли или увеличивали. Прекращение приема иммуносупрессивных препаратов произошло у пациентов, которые нуждались в госпитализации в отделение интенсивной терапии [21].
В исследовании, проведенном F. Villanego et al., на основании данных из регистра Испании показано, что различий в иммуносупрессивной терапии между выжившими и умершими не было. Умерших чаще лечили ГКС, гидроксихлорохином, лопинавир-ритонавиром или тоцилизумабом [24].
Таким образом, данные европейских исследований показывают, что у РПТ с SARS-CoV-2 в большинстве случаев отменялись антиметаболиты и проводилось лечение гидроксихлорохином, а тоцилизумаб назначался редко. Прием ИКН отменялся или снижалась их доза почти на 30% (28,7%, по данным французского национального регистра, и 29%, по данным ERACODA). Дозу ГКС увеличивали 18% пациентов (ERACODA). Французские и испанские исследователи в целом отмечают усиление терапии ГКС среди умерших пациентов [18, 21, 24]. В этом случае данные американских исследователей отличаются от европейских быстрым отказом от лечения гидроксихлорохином и более частым назначением тоцилизумаба (14% – в клинике Бронкса и 5,3%, по данным французского регистра) с широким усилением терапии ГКС (в 44% случаев против 18) и более редкой отменой ИКН (14%), т.е. почти в 2 раза реже, чем в Европе. Стоит отметить, что среди пациентов с отменой ИКН 7,8% выжили, 25% умерли [19].
По нашим данным, полученным через ЕМИАС, такролимус получали 60% выживших и 38% умерших, лечение ГКС проводилось в 98 и 99% случаев соответственно. Все наблюдаемые нами пациенты прожили не менее 1 года после АТП, и большинство из них были со cтабильной функцией трансплантата почки (скорость клубочковой фильтрации в группе выживших составляла 48,7±17,05 мл/мин/1,73 м2, в группе умерших – 46,3±19,82 мл/мин/1,73 м2; р>0,05), 77% из них имели сердечно-сосудистые заболевания и 31,2% – сахарный диабет. В связи с этим было важно уточнить, как вести выживших пациентов после госпитализации, когда иммуносупрессивная терапия была изменена.
И если лечение в острый период тяжелых пациентов с отменой антиметаболитов, снижением дозы или отменой ИКН, применением тоцилизумаба, повышением дозы ГКС признано большинством международных исследователей [4] и нашими ведущими московскими специалистами нефрологами и пульмонологами из ГКБ52 ДЗМ [26–28], то подходы к иммунносупрессивной терапии после выписки остаются до сих пор открытыми.
В связи с этим интересен опыт применения ГКС и различные варианты их назначения. По данным проспективного многоцентрового одностороннего слепого рандомизированного контролируемого исследования, выполненного X. Tang et al., лечение метилпреднизолоном (МП) госпитализированных пациентов с пневмонией, вызванной COVID-19, по сравнению с контрольной группой, не имело разницы по частоте клинического ухудшения (4,8 против 4,8%; p=1,000). Продолжительность обнаружения вирусной РНК горла в группе МП составила 11 дней (межквартильный диапазон – 6–16 дней), что было значительно больше, чем в контрольной группе, – 8 (2–12) дней (p=0,030). Масс-цитометрия выявила CD3+-Т-клетки, CD8+-Т-клетки и NK-клетки в группе МП, число которых было значительно меньше, чем в контрольной группе после рандомизации (р<0,05). Исходя из этого, X. Tang et al. сделали выводы, согласно которым краткосрочное раннее применение МП может подавлять иммунные клетки и продлевать выделение коронавируса-2 при остром респираторном дистресс-синдроме (ОРДС) у пациентов с пневмонией COVID-19 [5].
С другой стороны, дексаметазон в комбинации с иммунобиологическими препаратами снижал частоту неблагоприятных исходов до 4,8% [28]. В связи с этим интересными будут результаты амбиспективного когортного исследования с анализом выживаемости 216 пациентов с диагнозом тяжелой пневмонии SARS-CoV2, в котором сравнивали различия в клинических исходах и лабораторных результатах госпитализированных пациентов, получавших дексаметазон в дозе 6 мг/сут., по сравнению с пациентами, получавшими высокие дозы МП (от 250 до 500 мг ежедневно в течение 3 дней с последующим переходом на пероральный преднизолон 50 мг ежедневно в течение 14 дней). У пациентов, получавших дексаметазон, чаще развивался ОРДС (26,1% против 17,1 в группе МП). Лабораторные маркеры значительно снизились в группе, получавшей МП, С-реактивный белок (СРБ) – 2,85 (2,3–3,8) против 7,2 (5,4–9,8; р<0,0001), D-димер – 691 (612–847) против 1083 (740–1565; р=0,04) и лактатдегидрогеназа (ЛДГ) – 273 (244–289) против 355 (270,6–422; р=0,01). Перевод в отделение интенсивной терапии (4,8% против 14,4), смертность (9,5% против 17,1), время восстановления 3 (3–4) дня против 6 (5–8) были ниже у пациентов, получавших МП, чем у пациентов, принимавших дексаметазон (р<0,0001). При 30-дневном наблюдении 88 (92,6%) пациентов были живы в группе MП по сравнению с 58 (63,1%) из тех, кто получал дексаметазон. В этом исследовании лечение тяжелой пневмонии Covid-19 высокими дозами МП по сравнению с 6 мг дексаметазона уменьшало время восстановления, необходимость перевода в реанимацию и маркеры воспаления СРБ, ЛДГ и Д-димер [6]. Анализируя данные этих двух исследований [5, 6], можно сказать, что использование ГКС, по-видимому, имеет особое значение для РПТ с SARS-CoV-2. В связи с этим может быть интересно предложение Willicombe et al., [7], которые рекомендуют для стабильных РПТ проведение поддерживающей иммуносупрессивной терапии такролимусом с протоколом минимизации ГКС. Как считают Willicombe et al., это может помочь уменьшить риск вторичной инфекции и нарушение элиминации вируса, связанные с длительным применением ГКС [5].
Надо также заметить, что в исследовании M.G. Willicombe et al. 54,2% выживших РПТ с SARS-CoV-2 принимали такролимус, среди умерших пациентов такролимус принимали 35,3% (р=0,0086) [7]. Похожий результат использования ИКН был получен индийскими исследователями V.B. Kute et al. с большей наглядностью. Среди выживших 74,6% пациентов продолжили лечение ИКН без изменения дозы препарата и 19% уменьшили дозу. Среди умерших 72,4% прервали прием ИКН и 27,5% уменьшили дозу (р<0,0001) [9]. Ранее мы уже приводили данные американских коллег, показавших, что среди пациентов с отменой ИКН 7,8% выжили, а 25% умерли [19].
Эти данные совпадают с нашими, полученными через ЕМИАС, и результатом нашего мета-анализа стало повышение выживаемости среди РПТ, которые чаще принимали такролимус (рис. 4). Наиболее вероятным объяснением этого факта может быть механизм действия ИКН, которые in vitro ингибируют репликацию SARS-CoV-1 и других коронавирусов человека посредством взаимодействия циклофилина и FK-связывающего белка с неструктурным белком SARS-CoV-1 [3]. Исследования показали, что репликация коронавируса (CoV) зависит от активных путей иммунофилина. Такролимус (FK506) сильно ингибировал рост коронавирусов человека SARS-CoV, HCoV-NL63 и HCoV-229E при низких нецитотоксических концентрациях в культуре клеток. Посредством количественной полимеразной цепной реакции с титрованием было показано, что FK506 снижал экспрессию репортерных генов люциферазы и репликацию зеленого флуоресцентного белка (GFP) на несколько порядков. Нокдаун клеточных FK506связывающих белков FKBP1A и FKBP1B в клетках CaCo2 предотвращал репликацию HCoV-NL63, что свидетельствует о необходимости этих представителей семейства иммунофилинов для роста вируса [29]. Эти данные могут быть основанием того, чтобы не прерывать прием ИКН и продолжать лечение, снижая дозу, если это требуется.
Нужно отметить, что для пациентов с длительным периодом после трансплантации почки и SARS-CoV-2 характерен высокий риск смертности [30], в т.ч. обусловленный тяжелым коморбидным состоянием, и правильно подобранная иммунносупрессивная терапия во время госпитализации может иметь решающее значение для их выживания и последующего амбулаторного ведения. В данном случае рекомендации, приведенные в обзоре Beth Russell, по назначению низких доз преднизолона и такролимуса для РПТ с SARS-CoV-2 могут быть примером правильного подхода к амбулаторному лечению таких сложных пациентов [31].
Заключение
По данным ЕМИАС, смертность РПТ с SARS-CoV-2 в Москве за период с 01.02.2020 до 30.09.2020 была довольно высокой и составила 19,5%, однако не превышала среднего уровня 19,82% (фиксированная модель), определенного в мета-анализе. Продолжение терапии такролимусом может улучшать выживаемость РПТ с SARS-CoV-2.



