Цель исследования: изучить участие фактора роста фибробластов-23 (FGF-23) во взаимосвязи с показателями минерального обмена, в механизмах развития острого инфаркта миокарда (ОИМ) у больных хронической болезнью почек (ХБП), получающих заместительную почечную терапию, оценить риск фатальных и нефатальных случаев.
Материал и методы. В течении 3 лет проводилось проспективное когортное исследование 85 больных ХБП 5Д-стадии, которые получали лечение программным гемодиализом. На первом этапе исследования определены показатели, характеризующие минерально-костные нарушения: уровни фосфата, кальция крови, паратиреоидного гормона (ПТГ), кальцитриолоа (1,25(ОН)D), фактора роста фибробластов 23 (FGF-23) и трансмембранного белка Альфа-Клото (A-KloTHo). Второй этап исследования проведен спустя 3,1±0,1 года с регистрацией случаев фатального и нефатального ОИМ.
Результаты. Зарегистрировано 10 случаев ОИМ: нефатального – 6, фатального – 4. Установлено, что высокие значения FGF-23 и низкие А-KloTHo не обладают самостоятельной рисковой активностью в отношении ОИМ (р>0,05). Анализ сочетанного влияния повышенного уровня FGF-23 и/или низких значений А-KloTHo с гиперфосфатемией и дефицитом
1,25(ОН)D3 демонстрирует достоверно значимое повышение риска развития всех случаев ОИМ (р<0,05), в случаях фатального и нефатального ОИМ показана связь с дефицитом 1,25(ОН)D3 (р<0,05). Установлено статистически значимое влияние изолированного дефицита 1,25(ОН)D3, содружественного влияния нескольких факторов (гиперфосфатемия, гиперпаратиреоз, дефицит витамина D) на риск ОИМ.
Заключение. FGF-23 – один из ключевых маркеров развития как фатальных, так и нефатальных случаев ОИМ, прогнозирования сердечно-сосудистого риска у больных ХБП. Заслуживают внимания данные о содружественном влиянии нескольких факторов из числа минерально-костных нарушений на риск ОИМ.
Введение
Причиной высокой смертности больных хронической болезнью почек (ХБП) сявляются сердечно-сосудистые осложнения, в т.ч. острый инфаркт миокарда (ОИМ), связанные с минеральными и костными нарушениями (МКН-ХБП). МКН-ХБП способствуют развитию кальцификации сосудов, в т.ч. коронарных, гипертрофии и кальцинозу миокарда [1–4]. Гиперфосфатемия, гиперпаратиреоз и снижение уровня кальция – основные факторы развития сердечно-сосудистой кальцификации (ССК). Их значение в летальности от сердечнососудистых осложнений у пациентов с ХБП продемонстрировано во многих исследованиях [4–11). Матриксным белкам, моделирующим кальцификацию, принадлежит важная роль в МКН и развитии ССК. Установлено, что повышение уровня фосфатурического гормона (FGF-23) приводит к повышению риска развития ССК у больных ХБП-5Д, частоты госпитализаций и смерти от сердечно-сосудистых осложнений. А-Клото (А-Klotho), являясь трансмембранным белком, участвует в активации рецептора FGF-23 в органах-мишенях [4, 12–14]. Изучение роли FGF-23 в развитии МКН-ХБП и его влияния на риск развития ОИМ весьма актуально.
Цель исследования: изучить участие FGF-23 во взаимосвязи с показателями минерального обмена, в механизмах развития ОИМ у больных ХБП, получающих заместительную почечную терапию, оценить риск фатальных и нефатальных случаев.
Материал и методы
В течение 3 лет проводилось проспективное когортное исследование 85 больных ХБП 5Д-стадии, получавших лечение программным гемодиализом. Средний возраст составил 56,8±14,8 года. Продолжительность ХБП – 23,2±10,1 года. Лечение гемодиализом проводилось в течение 11,7±6,9 года. Kt/V составил в группе в среднем 1,4±0,08 [15]. Обследование проведено по предварительно утвержденному протоколу, всем больным выполнены рутинные лабораторные и инструментальные исследования, определены показатели, характеризующие МКН: уровни фосфата, кальция крови, паратиреоидного гормона (ПТГ), кальцитириола (1,25(ОН)D), FGF-23 и A-Klotho. Второй этап исследования проведен через 3,1±0,1 года с регистрацией конечных точек, в качестве которых были определены случаи фатального и нефатального ОИМ [15]. Гиперпаратиреоз диагностирован в случае превышения уровня ПТГ>300 пг/мл (исключены первичные формы), гиперфосфатемия – при повышении уровня фосфата >1,49 ммоль/л [16]. Недостаточностью (1,25(ОН)D) считалось снижение его уровня <30 нг/мл. Проведено разделение группы по медиане A-Klotho, составившей 444 пг/мл, и по медиане FGF-23, составившей 63 пг/мл [15]. Статистическая обработка полученных данных проводилась с применением аппарата программы Statistica, 12.6. Использованы стандартные методы описательной статистики, проведен логит-регрессионный анализ с определением χ2-критерия, и при значении р<0,05 результат считался статистически значимым.
Результаты
Средние значения показателей минерально-костного обмена составили: ПТГ – 345±331 пг/мл, FGF-23 – 69,9±24,4 пг/мл, A-Klotho – 443±145 пг/мл, 1,25(ОН)D – 27±8,0 нг/мл, Р – 1,6±0,36 ммоль/л, Са – 2,3±0,32 ммоль/л, Р*Са – 3,8±1,32 ммоль2/л2 [17]. Зарегистрировано 10 случаев ОИМ, из них нефатальных – 6, фатальных – 4. Для выявления связи FGF-23 и других показателей минерально-костного обмена с риском развития ОИМ (все случаи) проведен логит-регрессионный анализ (табл. 1).
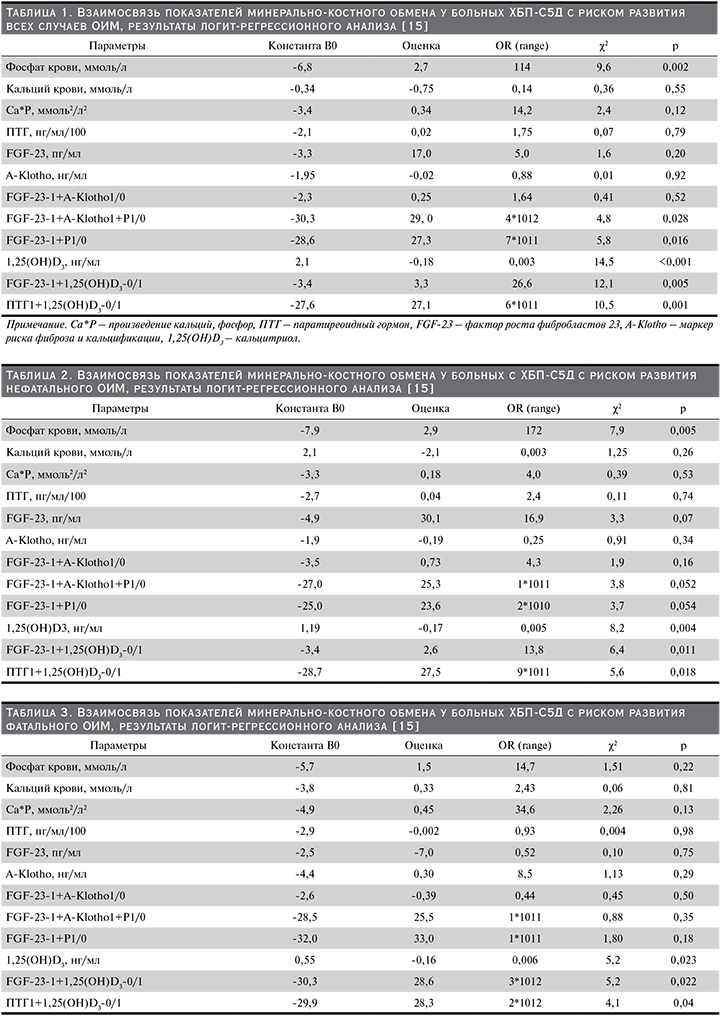
Выявлена достоверная корреляционная связь риска развития ОИМ с уровнем фосфатов крови и 1,25(ОН)D. Статистически значимое влияние на риск ОИМ оказывает как изолированный дефицит 1,25(ОН)D3, так и его сочетание с гиперпаратиреозом (ПТГ1+1,25(ОН)D3-0/1) [15] (табл. 1). Высокие значения FGF-23 и низкие А-Klotho не обладают самостоятельной рисковой активностью в отношении ОИМ. Однако проведенный анализ сочетанного влияния повышенного уровня FGF-23 и низких значений А-Klotho с гиперфосфатемией и дефицитом 1,25(ОН)D3 продемонстрировал достоверно значимое повышение риска развития ОИМ [15] (табл. 1).
Далее был проведен анализ взаимосвязи показателей минерально-костного обмена и случаев нефатального ОИМ (табл. 2). Из табл. 2 следует, что у пациентов с нефатальными случаями ОИМ повышение уровня FGF-23 также демонстрирует прогностическую значимость риска, но только в сочетании с дефицитом 1,25(ОН)D3 (FGF-23-1+1,25(ОН)D3-0/1) [15].
Установлена достоверная статистическая связь риска развития ОИМ в случае изолированной гиперфосфатемии и дефицита витамина D. Гиперпаратиреоз имеет диагностическую значимость только в сочетании с дефицитом витамина D (ПТГ1+1,25(ОН)D3-0/1).
Далее был проведен анализ в отношении фатальных случаев ОИМ (табл. 3). Несмотря на то что их было немного и продолжительность проспективного наблюдения была 3-летней, данный анализ послужил важным инструментом прогнозирования смертельных исходов у больных ОИМ [15].
Из табл. 3 следует, что в отношении фатальных случаев ОИМ приобретает значение дефицит 1,25(ОН)D3, как изолированный, так и в сочетании с повышением уровня FGF-23 (FGF-23-1+1,25(ОН)D3-0/1) [15]. Гиперпаратиреоз также имеет диагностичеcкую значимость в случае фатальных вариантов ОИМ, но только в сочетании с дефицитом витамина D (ПТГ1+1,25(ОН)D3-0/1).
Обсуждение
FGF-23 принадлежит ключевая роль в регуляции фосфорно-кальциевого обмена [4, 12, 14, 18]. В проведенном исследовании высокие значения FGF-23 и низкие А-Klotho не показали самостоятельной рисковой активности в отношении ОИМ [15]. Выявлен повышенный риск развития ОИМ, связанный с гиперфосфатемией, гиперпаратиреозом и дефицитом витамина D. Вместе с тем анализ сочетанного влияния повышенного уровня FGF-23 и /или низких значений А-Klotho с гиперфосфатемией и дефицитом 1,25(ОН)D3 демонстрирует важную роль FGF-23 в механизмах развития ОИМ, достоверно повышая риск развития ОИМ, и подтверждает сложные патофизиологические механизмы МКН-ХБП. Функции FGF-23 многогранны, он не только оказывает фосфатурическое действие через натрий-фосфорный транспортер почечного канальца, но и угнетает 1α-гидроксилазу, приводя к снижению продукции 1,25-дигидроксивитамина D, стимулирует 24-гидроксилазу, приводя к ускоренной деградации активной формы витамина D [19]. FGF-23 напрямую ингибирует секрецию ПТГ [4, 18].
Таким образом, полученные данные подтверждают не только участие FGF-23 в регуляции фосфорно-кальциевого обмена, но и его тесную взаимосвязь с показателями минерально-костного обмена, демонстрируют влияние на риск развития фатального и нефатального ОИМ.
Заключение
FGF-23 – один из ключевых маркеров развития как фатальных, так и нефатальных случаев ОИМ, прогнозирования сердечнососудистого риска у больных ХБП. Заслуживают внимания данные о содружественном влиянии нескольких факторов из числа МКН на риск ОИМ [15].
1. Томилина Н.А., Андрусев А.М., Перегудова Н.Г., Шинкарев М.Б. Заместительная терапия терминальной хронической почечной недостаточности в Российской Федерации в 2010–2015 гг. Нефрология и диализ. 2017;19(4):5–111. Doi: 10.28996/1680-4422-2017-4suppl-1-95. [Tomilina N.A., Andrusev A.M., Peregudova N.G., Shinkarev M.B. Replacement therapy for terminal chronic kidney failure in the Russian Federation in 2010- 2015. Nephrol. Dial. 2017;19(4):5–111 (In Russ.).
2. Tonelli M., Karumanchi S.A., Thadhani R., et al. Epidemiology and mechanisms of uremia-related cardiovascular disease. Circulation.2016;133(5):518–36. Doi: 10.1161/CIRCULATIONAHA.115.018713.
3. Saran R., Li Y., Robinson B., et al. US Renal Data System 2015 Annual Data Report: Epidemiology of Kidney Disease in the United States. Am. J. Kidney Dis. 2016;67(3):1–305. Doi: 10.1053/j.ajkd.2015.12.014.
4. Смирнов А.В., Румянцев А.Ш. Строение и функции костной ткани в норме и при патологии. Сообщение II. Нефрология. 2015;19(1):8–17. Doi: 10.24884/1561-6274-2015-1-8-17.
5. Ulusoy S., Ozkan G., Guvercin B., Yavuz A. The Relation Between Variability of Intact Parathyroid Hormone, Calcium, and Cardiac Mortality in Hemodialysis Patients. Artificial Organs. 2016;40(11):1078–85. Doi: 10.1111/aor.12690.
6. Li D., Zhang L., Zuo L., et al. Association of CKD-MBD Markers with All-Cause Mortality in Prevalent Hemodialysis Patients: A Cohort Study in Beijing. PLoS ONE. 2017;12(1):0168537. Doi: 10.1371/journal.pone.0168537.
7. Liu Y., Lee W.C., Cheng B.C., et al. Association between the Achievement of Target Range CKD-MBD Markers and Mortality in Prevalent Hemodialysis Patients in Taiwan by Using the Kidney Disease: Improving Global Outcomes Clinical Guidelines. Biomed. Res. Int. 2016;2016:1523124. Doi: 10.1155/2016/1523124.
8. Zhu J.G., Chen J.B., Cheng B.C., et al. Association between Extreme Values of Markers of Chronic Kidney Disease: Mineral and Bone Disorder and 5-Year Mortality among Prevalent Hemodialysis Patients. Blood Purif. 2018;45(1– 3):1–7. Doi: 10.1159/000478972.
9. Querido S., Quadros Branco P., Silva Sousa H., et al. Hypervolemia, hypoalbuminemia and mitral calcification as markers of cardiovascular risk in peritoneal dialysis patients. Rev. Port. Cardiol. 2017;36(9):599–604. Doi: 10.1016/j.repc.2016.12.014.
10. Wu C.F., Lee Y.F., Lee W.J., et al. Severe aortic arch calcification predicts mortality in patients undergoing peritoneal dialysis. J. Formos Med. Assoc. 2017;116(5):366–72. Doi: 10.1016/j.jfma.2016.06.006.
11. Eun-Jung K., Bo H.K., Hye Y.J., et al. Serum 25-hydroxyvitamin D as a predictor of hospitalization-free survival in predialysis and dialysis patients with chronic kidney disease: a single-center prospective observational analysis. Kidney Res. Clin. Pract.2016;35(1):22–8. Doi: 10.1016/j.krcp.2015.12.004.
12. Милованова Л.Ю., Козловская Л.В., Милованова С.Ю. и др. Взаимосвязь фактора роста фибробластов-23 (FGF-23) SKLOTHO, тропонина-I у больных хронической болезнью почек. Международный научно-исследовательский журнал. 2016;51(9–13):65–8. Doi: 10.18454/ IRJ.2016.51.074.
13. Ермоленко В.М., Ветчинникова О.Н., Волгина Г.В. и др. Минеральные и костные нарушения при хронической болезни почек. Научное общество нефрологов России, 2015.
14. Ganidagli B., Nacar H., Yildyz Y.S., et al. The relationship between serum osteopontin and FGF-23 levels with valvular calcification in hemodialysis patients. Clin. Nephr. 2019;91(1):9–17. Doi: 10.5414/CN109505.
15. Мамбетова А.М., Гатураева Ш.Н., Семенова И.Л., Кегадуев А.Ш. Прогнозирование риска развития острого инфаркта миокарда у больных хронической болезнью почек 5Д стадии и минерально-костными нарушениями. СПб. Нфрология. 2020 Том: 24 № 5 С. 51-57
16. KDIGO Clinical Practice Guideline Update for the Diagnosis, Evaluation, Prevention, and Treatment of Chronic Kidney Disease–Mineral and Bone Disorder (CKD-MBD). Kidney Int. 2017;7(1):1–59.
17. Мамбетова А.М, Гатураева Ш.Н., Семенова И.Л. Подходы к прогнозированию риска развития острого нарушения мозгового кровообращения у больных с хронической болезнью почек 5Д стадии и минерально-костными нарушениями. Нефрология. 2022;26(3):66–71.
18. Bone Disorder (CKD-MBD). Kidney Int. 2017;7(1):1–59.
19. Ананьин П.В., Комарова О.В., Цыгин А.Н. и др. Роль фактора роста фибробластов-23 в патогенезе нарушений обмена фосфора при нефропатиях у детей. Нефрология. 2016;20(2):59–67
Мамбетова Анета Мухамедовна – д.м.н., профессор кафедры общей врачебной подготовки и медицинской реабилитации ФГБОУ ОВ «Кабардино-Балкарский государственный университет им. Х.М. Бербекова» Министерства образования и науки РФ, Нальчик. Адрес: 360000 Нальчик, ул. Чернышевского, 173; тел.: +7 (866) 293-00-80, +7 (905) 439-11-90; e-mail:
. ORCID: https://orcid.org/0000-0003-0378-0754
Гатураева Шамсия Нажмудиевна – зав. отделением эфферентной хирургии крови и гемодиализа ГБУЗ «Республиканская клиническая больница
им. Ш.Ш. Эпендиева» Минздрава Чеченской республики, Грозный. Адрес: 364047 Чеченская Республика, Грозный, ул. Хвойная, 5; e-mail:
Семенова Ирина Леонидовна – старший преподаватель кафедры общей врачебной подготовки и медицинской реабилитации медицинского факультета ФГБОУ ВО «Кабардино-Балкарский государственный университет им. Х.М. Бербекова» Министерства образования и науки РФ, Нальчик. Адрес: 360000 Кабардино-Балкарская Республика, Нальчик, ул. Чернышевского, 173; e-mail:
. ORCID: https://orcid.org/0000-0002-2658-6551




