Введение
Эпидемиологические исследования фиксируют увеличение числа пациентов с коморбидным нарушением функции почек. Например, по данным национальной госпитальной базы США, в течение последних 8 лет число пациентов с терминальной почечной недостаточностью и диагностированным инфарктом миокарда увеличилось в 1,5 раза, при этом госпитальная летальность возросла с 22 до 25% [1]. К концу года наблюдения в корейском регистре у пациентов с инфарктом миокарда и снижением клиренса креатинина до 30–59, 15–29 и менее 15 мл/мин риск сердечно-сосудистых событий увеличился в 1,6, 2,1 и 2,5 раза соответственно [2]. На каждые 10 мл/мин снижения скорости клубочковой фильтрации (СКФ) смертность у пациентов с острым инфарктом миокарда с подъемом сегмента ST (ИМП ST) повышается на 30–40% [3]. В исследовании HORIZONS-AMI в группе пациентов с ИМП ST наличие хронической болезни почек (ХБП) увеличило 3-летнюю смертность почти в 4, а риск кровотечении – в 3 раза [4].
После внутрикоронарного вмешательства при ИМП ST прогноз существенно зависел от степени дисфункции почек: при нормальной функции, умеренном и выраженном снижении СКФ смертность в течение 30 дней составила 2%, 8 и 22% соответственно [5]. Кроме того, не исключается влияние диабета, дегидратации, сердечной недостаточности и дисфункции левого желудочка, возраста старше 80 лет, выраженной гипотензии [6, 7]. Таким образом, нарушение функции почек – важный независимый предиктор смерти и сердечно-сосудистых осложнений у больных ОКС. Оптимизация тактики ведения данной категории пациентов становится особенно актуальной. Целью настоящего исследования стало изучение прогностического значения нарушения функции почек как фактора риска сердечно-сосудистой смерти у больных с ИМП ST.
Материал и методы
В проспективное наблюдение, продолжавшееся 6 месяцев, включен 241 пациент с ИМП ST, поступивший в стационар в течение года, в возрасте 32–95 лет (средний возраст – 62,4±11,13 года), из них 177 (73,4%) мужчин. Всем пациентам проводилось общеклиническое обследование (сбор анамнеза, антропометрическое и физическое исследования больного, измерение АД, ЧСС). Лабораторно-инструментальное обследование включило клинические анализы крови, биохимический анализ крови при поступлении и в динамике на 2-й и 7-й день поступления, ЭКГ, эхокардиография. Для диагностики инфаркта миокарда использовали критерии национальных рекомендаций Российского кардиологического общества по диагностике и лечению ИМП ST. Для оценки функционального состояния почек рассчитывали СКФ по формуле CKD-EPI с использованием показателей сывороточного креатинина. ХБП диагностировали на основании критериев последних российских и международных рекомендаций (KDIGO). Критериями исключения стали мышечная масса пациента резко отклоняется от средних величин, выраженные истощение и ожирение (ИМТ<15 и >40 кг/м2), беременность, заболевания скелетной мускулатуры (миодистрофии), параличи/парезы конечностей, состояние после пересадки почки, предполагаемые затруднения последующего наблюдения больных. Все пациенты получали стандартную фармакологическую терапию согласно рекомендациям по ведению пациентов с инфарктом миокарда с подъемом сегмента ST на ЭКГ. Тромболитическая терапия (ТЛТ) проводилась догоспитально или в условиях отделения реанимации и интенсивной терапии с использованием генетически модифицированного рекомбинантного активатора плазминогена – метализа (тенектеплаза) по стандартным протоколам в сроки инфаркта миокарда, не превышающие 12 часов.
Через 6 месяцев проведен повторный осмотр пациентов, зарегистрировано развитие сердечно-сосудистых осложнений. Конечные точки в исследовании: госпитальная летальность, смерть от сердечно-сосудитых причин в период последующего наблюдения, повторные госпитализации в связи с ОКС. Статистическая обработка полученных результатов проведена с использованием статистических пакетов программ «SPSS Statistics 17.0». Для определения статистической значимости различий непрерывных величин в зависимости от параметров распределения использовался непарный t-критерий Стьюдента или U-критерий Манна–Уитни. При сравнении трех независимых групп и более по одному признаку в зависимости от параметров распределения использовались критерий Краскела–Уоллиса или однофакторный дисперсионный анализ. Для оценки динамических изменений внутри групп применяли непараметрический критерий Вилкоксона для парных величин. Для выявления предикторов развития неблагоприятных исходов выбран прямой пошаговый алгоритм бинарного логистического регресса с оценкой относительного риска и 95% доверительного интервала. Для проведения анализа выживаемости использованы оценки Каплана–Мейера и графики функции выживаемости. Для всех проведенных анализов различия считались достоверными при двустороннем уровне значимости р<0,05. Исследование проводилось в соответствии с принципами Хельсинкской декларации.
Результаты
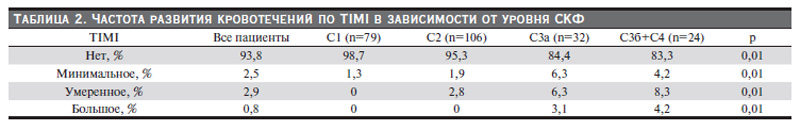
В зависимости от значений СКФ пациенты исходно были разделены на группы: 1) более 90 мл/мин; 2) от 60 до 89 мл/ мин; 3) от 45 до 59 мл/мин; 4) менее 44 мл/мин. У 41,1% (n=99) пациентов встречалась почечная дисфункция (СКФ меньше 60 мл/ мин). По тяжести нарушения функции почек больные распределились следующим образом (рис. 1). В течение последующего наблюдения от 1 дня до 6 месяцев (медиана наблюдения – 6 месяцев) у 39 (17,8%) больных зарегистрировано наступление комбинированной первичной конечной точки (23 случая госпитальной летальности в период индексного события, 13 повторных госпитализаций в связи с симптомами ОКС, 4 случая смерти в течение временного интервала 6 месяцев, трое из которых умерли от острой декомпенсации сердечной недостаточности, один – от повторного инфаркта миокарда), рис.1. Клиническая характеристика больных в зависимости от уровня СКФ представлена в табл. 1.

Все пациенты получали стандартную фармакологическую терапию. Суммарно ТЛТ проведена в 41 (17,0%) случае, частота проведения ТЛТ не различалась в разных группах СКФ, хотя у пациентов с СКФ менее 30 мл/мин частота ТЛТ все же достигала 40%. Критериями успешной ТЛТ служили изменения ЭКГ-картины (уменьшение элевации сегмента ST ≥ 50% от исходного), уровень кровотока ТIМI I-III по данным ангиографической картины, а также клиническая картина.
Чрескожное коронарное вмешательство (ЧКВ) – баллонная ангиопластика, баллонная ангиопластика со стентированием – в период госпитализации выполнено пациентам как без предшествовавшей ТЛТ (первичное ЧКВ), так и после ее проведения (отсроченное ЧКВ, «спасительное» ЧКВ). В 96,7% случаев проведена коронароангиография (КАГ), частота проведения КАГ опускалась со снижением СКФ (p=0,027), в 91,7% случаев проведение КАГ завершалось выполнением ангиопластики, в остальных случаях от проведения ЧКВ решено воздержаться ввиду многососудистого поражения коронарных артерий и/или технических сложностей при выполнении ЧКВ. Поражение ствола ЛКА и его эквиваленты, так же как и трехсосудистое поражение, чаще встречались среди пациентов с более низкими значениями СКФ (p=0,037). Среди пациентов с ИМП ST с СКФ>60 мл/мин КАГ не проведена в 1,6% случаев, в то время как с СКФ менее 60 мл/мин – в 8,9% (p=0,013), в группе же пациентов с СКФ<30 мл/мин КАГ не проведена 30% пациентов (3 из 10 пациентов), p<0,001.
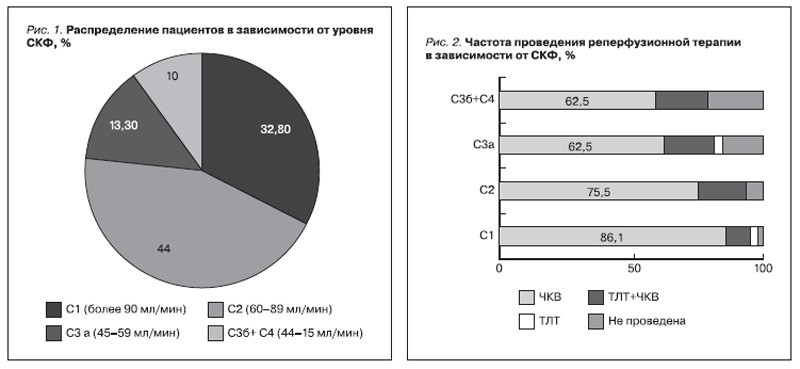
Частота реперфузионной терапии в зависимости от СКФ представлена на рис. 2. У пациентов с СКФ от 15 до 29 мл/мин отсутствие реперфузионной терапии достигало 30%. Частота различных вариантов кровотечений по критериям группы TIMI возрастала со снижением СКФ (p=0,01), данная закономерность была характерной как для минимальных, так и для больших кровотечений, табл. 2. Развитие кровотечения ассоциировалось с увеличением частоты случаев госпитальной летальности; так, при развитии малого кровотечения по критериям TIMI в 16,7% регистрировалась госпитальная летальность, в случае среднего и большого кровотечения по критериям TIMI – в 57,1 и 50% соответственно, в то время как в отсутствие кровотечения во время индексной госпитализации – в 7,5% (p<0,001).
Госпитальная летальность среди всех пациентов ИМП ST зарегистрирована в 9,5% случаев (23 из 241 пациента). Наибольшая госпитальная летальность отмечена в группе пациентов с СКФ<60 мл/мин – 17,2% (17 из 99 пациентов), в то время как среди пациентов с СКФ>60 мл/мин – 4,2% (6 из 142 пациентов), p=0,001. Исходно низкие показатели СКФ ассоциировались с неблагоприятным прогнозом; так, при уровне СКФ от 45 до 59 мл/мин госпитальная летальность составила 6,3% (2 пациента из 32), при уровне СКФ от 30 до 44 мл/мин – 42,9% (6 пациентов из 14), при уровне СКФ от 15 до 29 мл/мин – 60,0% (6 пациентов из 10), в то время как в группах с более высокими значениями СКФ случаи госпитальной летальности встречались значительно реже (p<0,001). Среди пациентов отмечено статистически значимое уменьшение скорости клубочковой фильтрации по мере увеличения возраста (р<0,001). Отмечено снижение уровня гемоглобина с уменьшением уровня СКФ (p<0,001). Снижение СКФ ассоциировалось с уменьшением ФВ ЛЖ (p=0,031), что, вероятно, можно объяснить более обширным поражением миокарда среди пациентов ИМП ST, приводящим к снижению сократительной способности миокарда и развитию острого кардиоренального синдрома.
Была установлена положительная корреляция между СКФ и количеством летальных исходов в течение полугода с момента включения в наблюдение (p<0,001); таким образом, выявлена прямая зависимость между выраженностью дисфункции почек и смертностью.
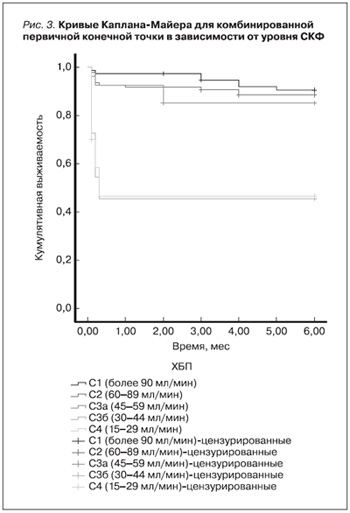 Также было проанализировано отношение рисков (ОР) наступления госпитальной летальности и комбинированной первичной конечной точки в зависимости от уровня СКФ. СКФ менее 60 мл/мин увеличивает риск наступления госпитальной летальности в 5 раза (ОР 95% – 4,699 [1,781–12,399], р=0,002), СКФ от 45 до 30 мл/мин – в 29 раз (ОР 95% – 28,875 (4,977–167,522), р<0,001), СКФ от 30 до 15 мл/мин – в 58 раз (ОР 95% – 57,750 [8,726–382,120], р<0,001). СКФ менее 60 мл/ мин увеличивает риск наступления комбинированной первичной конечной точки в 3 раза (ОР 95% – 2,917 [1,360–6,254], p=0,006), СКФ от 45 до 30 мл/мин – в 8 раз (ОР 95% 7,714 [2,076–28,661], p=0,002), СКФ от 30 до 15 мл/мин в 10 раз (ОР 95% – 10,286 [2,383–44],398, p=0,002). Анализ ОР наступления госпитальной летальности в зависимости от острой сердечной недостаточности (ОСН) по Killip показал, что Killip III увеличивает риск данной конечной точки в 32 раза (ОР 95% – 32,320 [8,940–116,845], р<0,001), а Killip IV увеличивает данный риск еще более кратно (ОР 95% – 101,0 [70,764–947,734], р<0,001). Кривые Каплана–Майера для комбинированной первичной конечной точки в зависимости от уровня СКФ представлены на рис. 3.
Также было проанализировано отношение рисков (ОР) наступления госпитальной летальности и комбинированной первичной конечной точки в зависимости от уровня СКФ. СКФ менее 60 мл/мин увеличивает риск наступления госпитальной летальности в 5 раза (ОР 95% – 4,699 [1,781–12,399], р=0,002), СКФ от 45 до 30 мл/мин – в 29 раз (ОР 95% – 28,875 (4,977–167,522), р<0,001), СКФ от 30 до 15 мл/мин – в 58 раз (ОР 95% – 57,750 [8,726–382,120], р<0,001). СКФ менее 60 мл/ мин увеличивает риск наступления комбинированной первичной конечной точки в 3 раза (ОР 95% – 2,917 [1,360–6,254], p=0,006), СКФ от 45 до 30 мл/мин – в 8 раз (ОР 95% 7,714 [2,076–28,661], p=0,002), СКФ от 30 до 15 мл/мин в 10 раз (ОР 95% – 10,286 [2,383–44],398, p=0,002). Анализ ОР наступления госпитальной летальности в зависимости от острой сердечной недостаточности (ОСН) по Killip показал, что Killip III увеличивает риск данной конечной точки в 32 раза (ОР 95% – 32,320 [8,940–116,845], р<0,001), а Killip IV увеличивает данный риск еще более кратно (ОР 95% – 101,0 [70,764–947,734], р<0,001). Кривые Каплана–Майера для комбинированной первичной конечной точки в зависимости от уровня СКФ представлены на рис. 3.
Обсуждение
Поражение почек как органа-мишени часто встречается у пациентов с сердечно-сосудистыми заболеваниями, что активирует каскад патологических механизмов в почках и усугубляет прогноз данной категории больных. Для улучшения прогноза у пациентов с данным видом коморбидной патологии необходим единый подход к диагностике и лечению, особенно в плане раннего предупреждения кардиальных и почечных осложнений. Оптимальная медикаментозная и инвазивная тактика, основанная на объективных критериях оценки функции почек, способна снизить риск развития сердечно-сосудистых и почечных осложнений, замедлить прогрессирование коморбидной патологии.
Эпидемиологические исследования фиксируют увеличение числа пациентов с коморбидным нарушением функции почек. Среди поражений почек чаще определяется ХБП. По данным регистра ACTION, критерии ХБП выявили у 31% пациентов с ИМБП ST и у 43% – при ИМП ST. По нашим данным, в 41,1% случаев встречалась почечная дисфункция (СКФ<60 мл/мин). Анализ данных исследований TIMI, InTIME-II у пациентов с ИМП ST выявил повышение 30-дневной летальности. По данным нашего исследования, летальный исход регистрировался в 9,5% случаев. По данным крупного регистра GRACE, тромболизис существенно не повлиял на госпитальную летальность пациентов с легкой и выраженной дисфункцией почек и повысил госпитальную летальность на 35% при умеренном нарушении функции почек с СКФ 30–59 мл/мин [8]. Современные рекомендации рассматривают тромболитическую терапию как альтернативу ЧКВ у пациентов с ИМП ST независимо от наличия дисфункции почек. Вместе с тем нет убедительных данных об эффективности тромболизиса при ХБП 3–5-й стадий [9]. В нашем исследовании частота различных вариантов кровотечений по критериям группы TIMI возрастала со снижением СКФ (p=0,01), данная закономерность была характерной как для минимальных, так и для больших кровотечений. Также наблюдалась прямая зависимости госпитальной летальности от развития кровотечений по критериям TIMI (p<0,001).
Заключение
Поражение почек как органа-мишени сопряжено с неблагоприятным прогнозом у пациентов с ИМП ST. Снижение СКФ отражает существенное увеличение вероятности летального исхода в течение 6-месячного периода наблюдения. Таким образом, повсеместное внедрение метода расчета СКФ позволит своевременно выявить даже умеренное нарушение фильтрационной функции почек и внести коррекцию в терапию пациента, тем самым позволив уменьшить число неблагоприятных исходов. На стационарном этапе грамотное использование величины СКФ, особенно оцененной в динамике, приобретает особое значение для больных острым инфарктом миокарда. Помимо почечной дисфункции основным фактором, оказывающим наибольшее влияние на риск развития летального исхода в течение госпитализации, является тяжесть ОСН по Killip III–IV при поступлении в стационар. У пациентов с ОКС снижение функции почек сопряжено с неблагоприятным прогнозом и является независимым предиктором для оценки долгосрочного риска смерти и сердечно-сосудистых осложнений.
Оценка сывороточной концентрации креатинина у этой категории пациентов обязательно должна дополняться расчетом СКФ, значение которого может рассматриваться в качестве самостоятельного и зачастую более точного прогностического маркера.



