Введение
Заболеваемость сахарным диабетом 2 типа (СД2) ежегодно увеличивается во всем мире. По данным Международной федерации диабета (IDF), в мире насчитывается 415 млн больных СД и к 2040 г. их число достигнет 642 млн [1].
По данным Всероссийского исследования Nation, распространенность СД среди взрослого населения России составляет 5,4%. На одного пациента с диагностированным СД приходится 1,2 человека с недиагностированным заболеванием [2].
На момент установления диагноза до 50% пациентов имеют те или иные сосудистые осложнения СД [3].
По данным Государственного регистра больных СД в Российской Федерации, смертность больных СД2 от инфаркта миокарда и сердечной недостаточности составляет около 60%, а смертность от инсульта в 1,5 раза превышает таковую в мире.
У пациентов с СД частота развития сердечно-сосудистой патологии в 3–4 раза выше по сравнению с лицами без этого заболевания [3].
Причиной высокой распространенности сердечно-сосудистых осложнений и летальности от них при СД служит сочетание эндокринных и гемодинамических факторов риска быстрого развития и прогрессирования атеросклероза. Главными факторами риска макроангиопатий при СД2 признаются гипергликемия, артериальная гипертензия, дислипидемия, инсулинорезистентность, эндотелиальная дисфункция и воспалительная реакция сосудистой стенки. Все эти факторы риска на фоне гипергликемии приобретают высокую атерогенность [4].
Риск микро- и макрососудистых осложнений при СД2 находится в прямой зависимости от уровня гликемии. В исследовании UKPDS доказано, что даже минимальное снижение уровня гликированного гемоглобина (HbA1c) способствует уменьшению риска осложнений СД2, а самый низкий риск выявляется у лиц с нормальными значениями HbA1c. Снижение уровня HbA1c на 1% приводило к уменьшению риска инфаркта миокарда на 14%, а микрососудистых осложнений – на 37%, что подчеркивает важность тщательной коррекции гликемии при лечении пациентов с СД2 [5].
Сахарный диабет типа 2 является независимым от возраста, артериальной гипертензии, ишемической болезни сердца (ИБС), ожирения, гиперлипидемии предиктором развития хронической сердечной недостаточности (ХСН), а также фактором, значительно отягчающим течение ХСН [6]. По данным того же исследования UKPDS, частота встречаемости ХСН у больных СД пропорциональна уровню HbA1c, и риск ее развития составляет около 3% в год [5]. Исходя из этого, в последнее время большое внимание уделяется дополнительной кардиоваскулярной защите, необходимой пациентам с СД2, помимо эффекта коррекции гликемии даже в отсутствие у больных очевидного сердечно-сосудистого риска.

Применение препаратов инкретинового ряда стало новым направлением в терапии СД2, на основе результатов проведенных исследований выявлены кардиопротективные свойства этих лекарственных средств. При проведении исследований на животных отмечено снижение размера инфаркта под действием глюкагоноподобного пептида-1 (ГПП-1), уменьшение ремоделирования левого желудочка при реперфузии миокарда, повышение выживаемости кардиомиоцитов при окклюзии коронарных артерий и реперфузии [7].
При проведении исследований влияния миметика ГПП-1 во время первичных чрескожных коронарных вмешательств выявлено уменьшение инфарктной зоны и улучшение функции левого желудочка практически у всех пациентов с СД2, получавших такое лечение [8].
Результаты исследований позволяют предположить возможность использования этих препаратов с целью фармакологического прекондиционирования – адаптации миокарда к ишемии у пациентов с СД2.
 Кардиоваскулярные нарушения при СД2 – это совокупность многих факторов, поэтому важное значение приобретает выявление у пациентов маркеров сердечно-сосудистого риска, контроль за ними на фоне лечения, применение препаратов, оказывающих влияние не только на уровень глюкозы крови, но и на состояние липидного обмена, положительно воздействующих на диастолическую функцию левого желудочка, эндотелиальную функцию, что может значительно снизить заболеваемость и смертность от сердечно-сосудистых заболеваний.
Кардиоваскулярные нарушения при СД2 – это совокупность многих факторов, поэтому важное значение приобретает выявление у пациентов маркеров сердечно-сосудистого риска, контроль за ними на фоне лечения, применение препаратов, оказывающих влияние не только на уровень глюкозы крови, но и на состояние липидного обмена, положительно воздействующих на диастолическую функцию левого желудочка, эндотелиальную функцию, что может значительно снизить заболеваемость и смертность от сердечно-сосудистых заболеваний.
Цель исследования состояла в изучении влияния миметика ГПП-1 эксенатида на динамику маркеров сердечно-сосудистого риска (С-реактивный белок (СРБ), фактор некроза опухоли α (ФНО-α), степень компенсации углеводного обмена, метаболические показатели, массу тела (МТ), индекс МТ (ИМТ), окружность талии (ОТ) у пациентов с СД2.
Материал и методы
Под нашим наблюдением в лечебно-реабилитационном центре Минэкономразвития России находились 70 пациентов с СД2. Длительность заболевания составила от 2 до 15 лет (в среднем 8,5±3,7 года), из них 20 мужчин и 50 женщин. Возраст больных составил от 48 до 75 лет (в среднем 61,5±7,4 года).
До начала исследования все пациенты получали сахароснижающую терапию: 84% – таблетированные сахароснижающие препараты (метформин в суточной дозе 2000 мг и препараты сульфонилмочевины), 16% – комбинированное лечение (инсулин и таблетированные сахароснижающие препараты).
Степень компенсации углеводного обмена оценивали по уровню HbA1c, который определялся в клинико-диагностическом отделении лечебно-реабилитационного центра Минэкономразвития России методом иммунохроматографии на аппарате Glycomat DS – 5N11 (Drew Scienific, Великобритания).
Биохимическим методом определены показатели липидограммы: общий холестерин (ОХС), триглицериды (ТГ), липопротеины низкой плотности (ЛПНП), липопротеины высокой плотности (ЛПВП), коэффициент атерогенности (КА).
В клинико-диагностической лаборатории лечебно-реабилитационного центра всем пациентам проведено исследование маркеров сердечно-сосудистых заболеваний (ССЗ):
- СРБ определен высокочувствительным биохимическим методом на анализаторе Access-2 (Bekman-culter, США);
- ФНО-α определен иммунологическим методом (проточная цитометрия) на анализаторе Access-2 (Bekman-culter, США).
В зависимости от значений СРБ, согласно рекомендациям Американской ассоциации сердца, пациенты с его уровнем <0,1 мг/дл были отнесены к группе низкого риска развития ССЗ, с уровнем 0,1–0,3 мг/дл – к группе среднего риска и с уровнем >0,3 мг/дл – к группе высокого риска [9].
После предварительного обследования пациенты методом случайной рандомизации были разделены на две группы:
- основная группа (50 пациентов): к получаемой сахароснижающей терапии был добавлен эксенатид в виде подкожных инъекций в дозе 5 мкг 2 раза в день в течение месяца, затем 10 мкг 2 раза в день в течение 5 месяцев.
- группа сравнения (20 пациентов): продолжали получать предшествовавшую сахароснижающую терапию.
В табл. 1 приведены основные клинические характеристики пациентов обеих групп, из которых видно, что они были сопоставимыми по всем параметрам.
В течение полугода с пациентами обеих групп проводились беседы о необходимости соблюдения принципов питания с исключением легкоусвояемых углеводов, ограничением жиров, расширением физической активности; проводился мониторинг дневников самоконтроля 1 раз в месяц с коррекцией сахароснижающей терапии.
Через 6 месяцев лечения в клинико-диагностической лаборатории проведено повторное измерение уровня HbA1c, измерены антропометрические показатели, повторно определены уровни маркеров сердечно-сосудистого риска.
Статистическая обvработка результатов исследования осуществлена с помощью пакета прикладных программ Statistika 6 и Microsoft Exsel 2010. Для оценки достоверности различий для рядов с нормальным распределением переменных использовался t-критерий Стьюдента. Результаты представлены в виде М±SD, где М – среднее арифметическое, SD – среднестатистическое отклонения. Различия считались достоверными при значениях р<0,05.
Результаты исследования
Проведен анализ динамики исследуемых показателей в группе пациентов, к лечению которых был добавлен эксенатид, и в группе сравнения, в которой больные продолжали получать предшествовавшую сахароснижающую терапию.
Исследование уровня СРБ показало, что его значения колебались у больных обеих групп от 0,08 до 1,1 мг/дл, составив в среднем 0,52±0,10 мг/дл. Анализ индивидуальных значений этого показателя выявил у большинства (72,8%) пациентов повышение уровня СРБ >0,3 мг/дл, что определяло высокий риск развития ССЗ, менее четверти (22,8%) пациентов имели уровень СРБ 0,1–0,3 мг/дл (средний риск ССЗ) и только у 4,2% значения СРБ составили <0,1 мг/дл, что свидетельствовало о низком риске ССЗ (рис. 1).
Степень компенсации СД не оказала существенного влияния на уровень СРБ. Так, у пациентов с уровнем HbA1c до 7,5% средние значения СРБ составили 0,65±0,42мг/дл и существенно не отличались от таковых у больных с HbA1с >7,5% (0,50±0,38 мг/дл), отразив одинаково высокий риск ССЗ в обеих группах обследованных.
Значения ФНО-α колебались от 4,0 до 18,8 пг/мл, составив в среднем 9,28±1,2 пг/мл, что объясняется наличием ожирения (рис. 2) у большинства пациентов и развивающейся вслед за этим инсулинорезистентностью.
До начала исследования практически все пациенты имели нарушения липидного обмена: уровень ОХС >5,2 ммоль/л определен у 90% пациентов, уровень ТГ >1,7 ммоль/л отмечен у всех больных, уровень ЛПНП >2,6 ммоль/л имел место у 88% пациентов.
Лечение статинами (аторвастатин 10–20 мг/сут) получали 34% пациентов. За время проведения исследования лечение не менялось.
Повторное обследование пациентов через 6 месяцев от начала лечения выявило положительную динамику в обеих группах, однако в основной группе, получавшей в составе комплексной терапии эксенатид, эти изменения имели более выраженный характер (табл. 2).
Через 6 месяцев лечения в группе пациентов, получавших эксенатид, выявлено значимое снижение уровня HbA1c, ИМТ, ОТ, улучшение показателей липидограммы (снижение уровней ОХС и ЛПНП, повышение уровня ЛПВП), отмечено достоверное снижение уровня СРБ, имела место тенденция к снижению уровня ФНО-α.
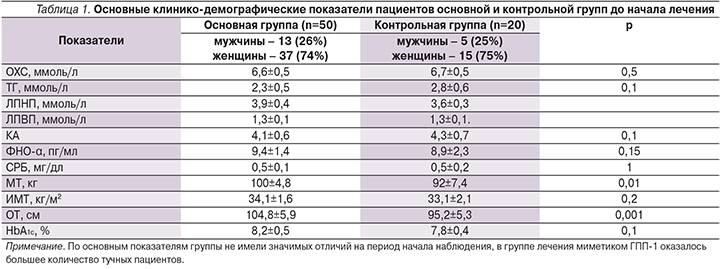
Таким образом, результаты исследования позволяют отметить высокую эффективность эксенатида в отношении снижения уровня HbA1c по сравнению с контрольной группой: с 8,2±0,5% до 7,4±0,4% (р=0,001) и с 7,8±0,4 до 7,4±0,3% (р=0,02) соответственно (рис. 3).
У большинства пациентов, получавших эксенатид, снизилась МТ по сравнению с группой контроля (с 100±4,8 до 94,1±4,5 кг [р=0,01], в группе сравнения показатели МТ прежние), уменьшился ОТ (с 104,8±5,9 до 99,1±5,52 см; р=0,03), тогда как в группе сравнения показатели достоверно не изменились.
В группе пациентов, получавших эксенатид, значительно улучшились показатели липидного обмена: уровень ОХМ снизился с 6,6±0,47 до 6,2±0,45 ммоль/л (р=0,05), уровень ЛПНП – с 3,9±0,45 до 3,16±0,42 ммоль/л (р=0,002), уровень ЛПВП повысился с 1,3±0,12 до 1,5 ±0,14 ммоль/л (р=0,01). В группе сравнения показатели липидного обмена не изменились или поменялись недостоверно.
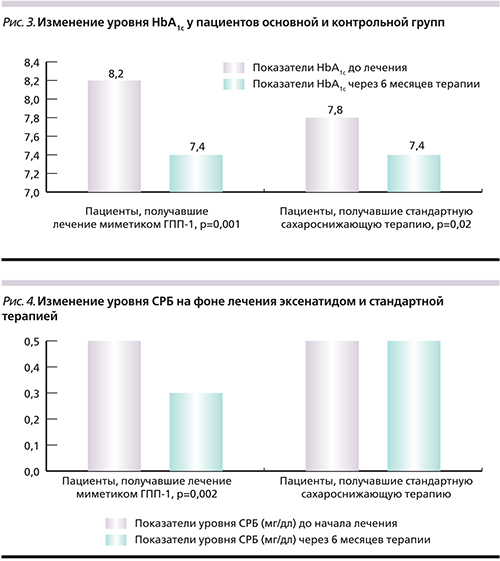
В группе пациентов, получавших эксенатид, отмечено достоверное снижение уровня СРБ с 0,5±0,1 до 0,3±0,1 мг/дл (р=0,001), изменений уровня СРБ у пациентов группы сравнения не произошло (рис. 4).
Наблюдалась тенденция к снижению уровня ФНО-α у пациентов обеих групп: у получавших эксенатид – с 9,4±1,38 до 8,6±0,9 пг/мл (на 8,5%; р=0,15, в группе сравнения – с 8,9±2,3 до 8,3 ±1,78 пг/мл (на 6,7%; р=0,8).
Обсуждение
Следует отметить, что в настоящее время СД2 считается эквивалентом ИБС, а пациенты с этой формой диабета, даже не имеющие ССЗ, рассматриваются как больные с высоким сердечно-сосудистым риском [10, 11].
Большинство пациентов имеют избыточный вес, ожирение, что усугубляет инсулинорезистентность, дислипидемию, повышает уровень маркеров неспецифического воспаления, что в конечном счете увеличивает риск ССЗ. Применяемые сахароснижающие препараты не всегда положительным образом влияют на МТ, в связи с чем применение препаратов инкретинового ряда, способных препятствовать увеличению МТ, привлекательно для лечения пациентов с СД2 [12].
По данным ранее проведенных исследований установлено, что терапия эксенатидом сопровождается снижением МТ [13, 14]. Препарат замедляет эвакуацию пищи из желудка, подавляет аппетит и снижает потребление пищи [15]. Показано, что снижение массы тела происходит именно за счет жировой ткани, преимущественно висцерального жира, при этом тощая масса тела не изменяется. Эти данные были получены в небольшом исследовании, включившем 36 пациентов с СД2, при изучении композиционного состава тела [16].
Как известно, дислипидемия, считающаяся одним из основных факторов риска развития атеросклероза, отмечается у большинства пациентов с СД2. Поэтому особый интерес представляет возможность улучшения показателей липидного спектра при применении сахароснижающих препаратов.
У пациентов с СД2 при повышенном уровне холестерина модифицированные ЛПНП и некоторые клеточные элементы крови (моноциты, лимфоциты) проникают в интиму артерий и подвергаются окислению или гликированию (модификации), что способствует еще большему повреждению эндотелия и облегчает дальнейшую миграцию из кровотока в интиму артерий этих клеточных элементов. Моноциты, проникшие в интиму, трансформируются в макрофаги, поглощающие модифицированные ЛПНП и накапливающие свободный и этерифицированный холестерин. Перегруженные липидами макрофаги превращаются в пенистые клетки. Макрофаги, перегруженные модифицированными ЛПНП, а также тромбоциты, проникающие в интиму артерий из крови, секретируют факторы роста и митогены, воздействующие на гладкомышечные клетки, расположенные в средней оболочке артерий. Под действием факторов роста и митогенов гладкомышечные клетки мигрируют в интиму и начинают пролиферировать. Находясь в интиме, они захватывают и накапливают модифицированные ЛПНП, также превращаясь в своеобразные пенистые клетки. Кроме того, гладкомышечные клетки приобретают способность продуцировать элементы соединительной ткани, которые в дальнейшем используются для построения фиброзного каркаса атеросклеротической бляшки [17].
Результаты ранее проведенных исследований демонстрируют достоверное улучшение показателей липидного спектра крови при применении миметиков ГПП-1: в результате лечения эксенатидом было отмечено снижение уровней ТГ, ОХС, ЛПНП, и повышение содержания ЛПВП, причем положительное влияние эксенатида нельзя полностью объяснить влиянием препарата на МТ, т.к. улучшение показателей отмечалось даже у пациентов без ее изменений [18].
Результаты нашего исследования не противоречат полученным ранее данным. В группе пациентов, получавших миметик ГПП-1, отмечено снижение МТ по сравнению с контрольной группой, снижение уровней ОХС, ЛПНП и ТГ, повышение уровня ЛПВП.
Полученные результаты подтверждают положительное влияние эксенатида на состояние углеводного и липидного обменов у больных СД2, что способствует снижению риска ССЗ.
При современном подходе к лечению больных СД2 определение некоторых факторов риска, таких как уровень HbA1с, артериальное давление, состав липидов крови, стало рутинным исследованием, однако в последнее время выявлено множество иммуновоспалительных маркеров атеросклероза, которые могут свидетельствовать об имеющихся сосудистых осложнениях, а также помогают прогнозировать риск их появления и развития. Также эти исследования могут стать необходимыми при определении результата лечения некоторыми препаратами, способными улучшать прогноз и снижать частоту сердечно-сосудистых осложнений при СД2.
Следует отметить, что при оценке исходного состояния пациентов уровень СРБ, соответствующий среднему и высокому рискам ССЗ, имели в нашем исследовании 95,6% пациентов независимо от степени компенсации диабета и продолжительности заболевания. Высокий уровень СРБ был связан не только с наличием СД2, но и с имеющимися у подавляющего большинства пациентов сопутствующими ССЗ. В нашей работе уровень СРБ достоверно снижался на фоне лечения миметиком ГПП-1 эксенатидом, чего не наблюдалось при применении стандартной сахароснижающей терапии.
Уровень ФНО-α выше референсных значений изначально выявлялся у пациентов обеих групп (основной и сравнения), что связано с избыточной МТ, имеющимися нарушениями углеводного и липидного обменов у большинства пациентов. В результате лечения достоверного изменения данного показателя не выявлено ни в одной из групп, однако в основной группе средний уровень ФНО-α снизился в большей степени: на 8,5 против 6,7% в группе сравнения, что, возможно, связано с улучшением показателей углеводного и липидного обменов, снижением МТ пациентов, получавших лечение миметиком ГПП-1.
Таким образом, в ходе проведенного исследования отмечено благоприятное влияние эксенатида на уровни иммуновоспалительных маркеров атеросклероза у пациентов, страдавших СД2, что может свидетельствовать о снижении у них риска развития или прогрессирования ССЗ и улучшении прогноза лечения.
Выводы
- У пациентов с СД2 выявляется повышение уровня высокочувствительного СРБ и уровня ФНО-α, что отражает средний и высокий риски сердечно-сосудистых осложнений.
- Применение миметика ГПП-1 эксенатида улучшает состояние углеводного и липидного обменов у пациентов с СД2.
- При использовании миметика ГПП-1 отмечено достоверное снижение уровня СРБ, имеется тенденция к снижению уровня ФНО-α.
- В группе пациентов, получавших миметик ГПП-1 эксенатид, наблюдалось достоверное снижение МТ, ОТ, что служит отражением его модифицирующего влияния на важные факторы риска ССЗ.
- Воздействие не только на показатели гликемии, но и на другие факторы риска ССЗ, имеющиеся у больных СД2, делает привлекательным использование миметика ГПП-1 эксенатида в составе сахароснижающей терапии для коррекции кардиоваскулярных нарушений, которые отмечаются у подавляющего большинства пациентов независимо от состояния углеводного обмена.



