Репродуктивная система и щитовидная железа тесно взаимосвязаны друг с другом, что объясняется общими механизмами их центральной регуляции. У женщин репродуктивного возраста патология щитовидной железы встречается чаще, чем в любых других популяциях [1], поэтому крайне важным является изучение влияния дисфункции щитовидной железы на все этапы развития и функционирования репродуктивной системы: регуляцию менструального цикла, возможность зачатия, вынашивание беременности, протекание послеродового периода [2, 3].
 Также важно учитывать, что и сама беременность оказывает значимое влияние на щитовидную железу и ее функцию. Во время беременности щитовидная железа увеличивается до 10% у женщин, проживающих в областях без дефицита йода, и на 20–40% – в районах с дефицитом йода. При нормальном течении беременности отмечается увеличение почечной экскреции йода, повышение уровня белков, связывающих тироксин, увеличение выработки гормонов щитовидной железы и стимулирующее влияние хорионического гонадотропина человека (ХГЧ) на щитовидную железу. Поэтому во время беременности женщины имеют более низкую концентрацию тиреотропного гормона (ТТГ) в сыворотке крови, чем до беременности (рис. 1). Здоровая щитовидная железа адаптируется к этим изменениям. Полагают, что для поддержания эутиреоза во время беременности выработка тироксина должна повыситься на 40–50% [4].
Также важно учитывать, что и сама беременность оказывает значимое влияние на щитовидную железу и ее функцию. Во время беременности щитовидная железа увеличивается до 10% у женщин, проживающих в областях без дефицита йода, и на 20–40% – в районах с дефицитом йода. При нормальном течении беременности отмечается увеличение почечной экскреции йода, повышение уровня белков, связывающих тироксин, увеличение выработки гормонов щитовидной железы и стимулирующее влияние хорионического гонадотропина человека (ХГЧ) на щитовидную железу. Поэтому во время беременности женщины имеют более низкую концентрацию тиреотропного гормона (ТТГ) в сыворотке крови, чем до беременности (рис. 1). Здоровая щитовидная железа адаптируется к этим изменениям. Полагают, что для поддержания эутиреоза во время беременности выработка тироксина должна повыситься на 40–50% [4].
Все виды патологии щитовидной железы можно условно разделить на две группы: нарушения функции щитовидной железы (гипотиреоз и тиреотоксикоз); структурные нарушения щитовидной железы (увеличение объема, узловые образования).
Наиболее важным влиянием на репродуктивную систему обладает дисфункция щитовидной железы, так как это оказывает прямое воздействие на протекание нормальных процессов регуляции менструального цикла, овуляции, зачатия и вынашивания.
Хронический аутоиммунный тиреоидит (АИТ) и репродуктивная функция
Наиболее частой причиной первичного гипотиреоза является аутоиммунная агрессия против клеток щитовидной железы. По различным данным носительство антител встречается у 2–17% женщин репродуктивного возраста. В настоящее время имеются данные, что сам по себе аутоиммунный процесс может также влиять на репродуктивную систему и на способность зачатия и вынашивания беременности. В исследовании Перминовой С.Г. показана ассоциация аутоиммунных заболеваний щитовидной железы с идиопатическим бесплодием, эндометриозом, эндокринным бесплодием [6]. Существует ряд данных, указывающих на то, что среди женщин с бесплодием выше распространенность повышенного уровня антител к тиреоидной пероксидазе даже при эутиреозе, по сравнению с фертильными женщинами в тех же возрастных группах [7]. В одномоментном исследовании среди женщин в возрасте 18–50 лет распространенность бесплодия составила 47% среди женщин с АИТ [8].
Кроме того, есть данные о более высокой распространенности повышенного уровня соответствующих антител у женщин с синдромом поликистозных яичников [9]. Антитиреоидные антитела также определяются в фолликулах яичников у женщин с АИТ и коррелируют с уровнем антител в сыворотке крови [10], хотя влияние указанных антител на процессы созревания ооцитов остается неизвестным. Существуют данные, что среди женщин с синдромом поликистозных яичников наличие антитиреоидных антител коррелирует с более низкой вероятностью ответа на лечение кломифена цитратом [11].
Данные об исходах программ вспомогательных репродуктивных технологий, в зависимости от наличия антитиреодных антител, противоречивы. Часть исследователей предлагает для улучшения прогнозов ЭКО назначать терапию тироксином женщинам без выявленного гипотиреоза, но с высоко нормальными показателями ТТГ, однако не все поддерживают данную тактику [12–17].
Ряд мета-анализов указывают на повышение частоты потерь беременности, включая привычный выкидыш, у женщин при повышенном уровне антитиреоидных антител [18–21]. Мета-анализы 7 и 11 исследований, включавших 23 000 и 35 467 женщин, выявили взаимосвязь между АИТ и преждевременными родами [22, 23]. Антитиреоидные антитела были связаны с перинатальной смертностью в некоторых [24], но не во всех [25, 26] исследованиях. В двух группах пациентов повышенный риск отслойки плаценты наблюдался у женщин с АИТ без клинического гипотиреоза [25, 27]. АИТ был также ассоциирован с послеродовой депрессией [28] и с неонатальным респираторным дистресс-синдромом [26].
Необходимо учитывать, что возможности патогенетического лечения аутоиммунного процесса в настоящее время в клинической практике отсутствуют, поэтому исследования, посвященные изучению взаимодействия репродуктивной системы и хронического АИТ, носят преимущественно научный, но не практический интерес.
Гипотиреоз и репродуктивная функция
Большую значимость представляют исследования, посвященные собственно влиянию гипотиреоза на репродуктивную систему, так как это заболевание легко выявляется и хорошо поддается медикаментозной терапии, что может оказывать значимое влияние на состояние репродуктивной системы у женщины. По степени выраженности выделяют манифестный гипотиреоз (ТТГ ≥ 10 мМЕ/л и/или низкий показатель свободного тироксина) и субклинический гипотиреоз (ТТГ 4–10 мМЕ/л и нормальный уровень свободного тироксина). Вне зависимости от причины гипотиреоза, подход к терапии единый – восполнение нехватки тиреоидных гормонов с помощью препарата левотироксина; варьируют только назначаемые дозировки.
Как манифестный, так и субклинический гипотиреоз, являются хорошо изученными факторами риска хронической ановуляции и бесплодия. Так, например, в исследовании 171 женщины с гипотиреозом (с уровнем ТТГ>15 мМЕ/л) в 68% случаев отмечался нерегулярный менструальный цикл, в отличие от группы контроля, где нарушения менструального цикла составили 12% [29]. Согласно данным ряда исследователей, среди женщин с бесплодием уровни ТТГ были самыми высокими у женщин с овуляторной дисфункцией и неизвестными причинами бесплодия, в отличие от женщин с трубным и мужским факторами бесплодия [30]. В ретроспективном исследовании Yoshioka et al. показано, что у 84,1% женщин с бесплодием и субклиническим гипотиреозом успешно наступала беременность после непродолжительного периода терапии левотироксином [31].
Поэтому не вызывает сомнений, что на этапе планирования беременности как манифестный, так и субклиническй гипотиреоз должны быть своевременно и адекватно компенсированы с помощью препаратов левотироксина в дозе, позволяющей добиться целевых показателей ТТГ менее 2,5 мМЕ/л [4].
При изучении влияния манифестного гипотиреоза на течение уже наступившей беременности была продемонстрирована ассоциация с повышенным риском осложнений беременности (преждевременные роды, недоношенность, невынашивание беременности) [20], а также с отрицательным эффектом на нейрокогнитивное развитие плода [32].
С субклиническим гипотиреозом ситуация не столь однозначная. Дело в том, что в связи с отсутствием характерной клинической симптоматики, многие исследователи используют разные отрезные точки диагностики этого заболевания и полученные результаты крайне противоречивы. Как было указано выше, в норме существуют физиологические колебания ТТГ на ранних сроках беременности в связи повышением уровня ХГЧ (и его стимулирующим влиянием на щитовидную железу), повышением продукции тиреоидных гормонов и повышением их связывания с белками. Начиная с 6–7 недели беременности, уровень ТТГ значительно снижается, по сравнению со значениями до беременности, что необходимо учитывать; однако, что считать «нормой», остается дискуссионным вопросом.
В 2011г. Американской (АТА) [33] и 2014 г. Европейской (ЕТА) [34] тиреоидологическими ассоциациями были предложены следующие, мало отличающиеся триместр-специфические референсные значения ТТГ (таблица), по которым предлагалось назначать терапию гипотиреоза вне зависимости от уровней антител к тиреоглобулину и тиреоидной перкозидазе.

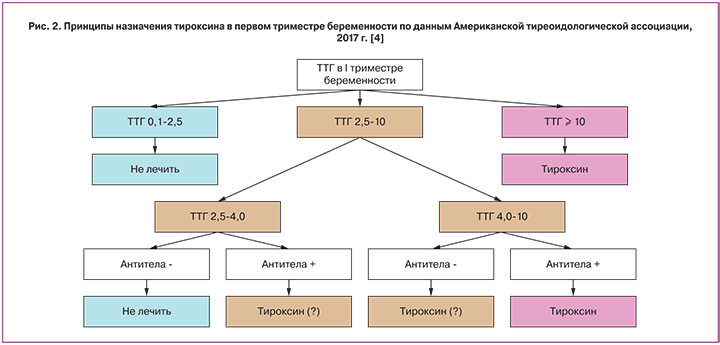
В 2017 г. Американская тиреоидологическая ассоциация в противовес предшествующим рекомендациям, предложила не назначать препараты левотироксина женщинам в 1-м триместре с ТТГ 2,5–4,0 мМЕ/л и низкими показателями антител к ткани щитовидной железы. Решение о назначении тироксина при повышении уровня антител и ТТГ 2,5–4,0 мМЕ/л, а также при низких показателях антител и ТТГ 4,0–10 мМЕ/л принимается индивидуально (рис. 2) [4]. В настоящее время ведутся активные дискуссии по данному вопросу.
Связано это с тем, что исследования, посвященные вопросам негативного влияния субклинического гипотиреоза на беременность, по-прежнему остаются противоречивыми. Так, например, ряд исследователей показал, что женщины с субклиническим гипотиреозом и хроническим АИТ находятся в группе риска по невынашиванию беременности на ранних сроках [21, 35]. Другими была показана корреляция между субклиническим гипотиреозом и преждевременными родами, гестационным диабетом, гестационной гипертензией, эклампсией, задержкой роста плода, низкой массой при рождении [36, 37]. Однако были и исследователи, показавшие отсутствие значимых различий в количестве новорожденных между пациентками с эутиреозом, леченным и не леченным субклиническим гипотиреозом [38]. Такие же противоречивые данные имеются и по прогнозам когнитивной функции у детей. В 2010 г. было показано, что субклинический гипотиреоз у матери является значимым предиктором снижения интеллектуального и физического развития у детей в возрасте 25–30 месяцев [39]. Однако, уже много лет продолжающееся британское исследование CATS, посвященное вопросам дисфункции щитовидной железы и беременности, оценивая уровень IQ у 9–10-летних детей от матерей с субклиническим гипотиреозом, опровергает эти данные [40]. Подобные противоречия связаны, прежде всего, с разными отрезными точками исследования ТТГ при беременности.
Как видно из представленных данных, влияние грубого манифестного гипотиреоза на вынашивание беременности хорошо изучено, и такие пациентки нуждаются в незамедлительном подборе заместительной терапии, позволяющей в кратчайшие сроки добиться эутиреоидного состояния. Субклинический гипотиреоз, в его классическом понимании с ТТГ≥ 4,0 мМЕ/л, по всей видимости, требует такого же внимания при беременности, как и манифестный. Основным дискуссионным вопросом остаются высоконормальные показатели ТТГ (выше предложенных триместр-специфических уровней, но ниже 4,0 мМЕ/л), когда лечение во-многом будет зависеть от сопутствующих факторов риска, в частности, уровня антител к ткани щитовидной железы.
Тиреотоксикоз и репродуктивная функция
Повышение функции щитовидной железы (тиреотоксикоз), вне зависимости от причины, может приводить к изменениям менструального цикла. Согласно данным Krassas et al., нерегулярный менструальный цикл был выявлен у 22% пациенток с гипертиреозом, по сравнению с 8% женщин контрольной группы с эутиреозом, сопоставимых по возрасту и весу [41].
Однако, тиреотоксикоз не является причиной бесплодия. Так, согласно данным одномоментного исследования, распространенность гипертиреоза (как субклинического, так и манифестного) была сходной у бесплодных женщин, по сравнению с контрольной группой с нормальной фертильностью [7]. И о возможности наступления беременности на фоне тиреотоксикоза необходимо помнить, когда речь идет о женщине репродуктивного возраста, так как это значительно осложняет ведение таких пациенток.
В отличие от гипотиреоза, при котором лечение практически не зависит от причины, уточнение этиологии тиретоксикоза имеет принципиальное значение, так как тактика может существенно различаться. В структуре тиреотоксикоза различают:
- тиреотоксикоз, связанный с гиперпродукцией тиреоидных гормонов (болезнь Грейвса, токсическая аденома, йод-индуцированный тиреоидит 1 типа);
- тиреотоксикоз, связанный с деструкцией щитовидной железы (тиреотоксическая фаза хронического АИТ, подострого или послеродового тиреоидита, йод-индуцированный тиреоидит 2 типа);
- другие, специфические причины (например, ТТГ- секретирующая опухоль гипофиза, транзиторный гестационный гипертиреоз, пузырный занос и др.).
Тактика ведения напрямую зависит от причины. Если речь идет о деструкции щитовидной железы, никакого специфического лечения обычно не требуется. Однако, нужно помнить о возможности развития гипотиреоза после окончания процесса деструкции. Поэтому планирование беременности следует начинать после окончательного завершения процесса деструкции и адекватной коррекции гипотиреоза.
Гестационный гипертиреоз, связанный с избыточным действием ХГЧ на рецепторы ТТГ на ранних сроках беременности, по сути, заболеванием не является и специфического лечения также не требует, несмотря на то, что может ухудшать состояние беременных, приводя к снижению массы тела, тахикардии, токсикозу, а иногда и к неукротимой рвоте беременных.
Основная проблема у женщин репродуктивного периода заключается в лечении тиреотоксикоза с гиперпродукцией гормонов. На это есть несколько причин. Во-первых, при беременности все тиреостатики, применяемые в консервативном лечении, способны проникать через плаценту и сопряжены с риском развития пороков у плода. В настоящее время предпочтительным является применение в 1 триместре препарата пропилтиоурацила, так как на фоне его приема частота пороков ниже [42], однако во 2-м и 3-м триместрах предпочтение отдается препаратам тиамазола, в связи с их меньшей гепатотоксичностью.
В то же время, отменять терапию во избежание внутриутробных мальформаций нельзя, так как неадекватный контроль тиреотоксикоза ассоциирован с потерей беременности, артериальной гипертензией, недоношенностью, низким весом при рождении, внутриутробной задержкой роста плода, мертворождением, тиреотоксическим кризом и застойной сердечной недостаточностью у матери. Более того, некоторые исследования показывают, что воздействие повышенных уровней гормонов щитовидной железы матери на плод может привести к развитию таких заболеваний, как эпилепсия и поведенческие расстройства в более позднем периоде жизни [43].
Необходимо учитывать тот факт, что наиболее распространенной причиной гипертиреоза у женщин детородного возраста является аутоиммунная болезнь Грейвса (диффузный токсический зоб), встречающаяся до беременности у 0,4–1,0% женщин и примерно у 0,2% – во время беременности [44]. В патогенезе болезни Грейвса основную роль играют стимулирующие антитела к рецепторам ТТГ, также способные проникать через плацентарный барьер, стимулировать щитовидную железу плода и вызывать транзиторный тиреотоксикоз.
В отличие от болезни Грейвса, тиреотоксикоз вследствие токсической аденомы течет более благоприятно при беременности, так как в организме матери не производятся антитела к рецепторам ТТГ, и, следовательно, щитовидная железа плода не стимулируется, как при болезни Грейвса. Однако, риски, как при не леченом тиреотоксикозе, так и при приеме тиреостатиков, сохраняются.
Поэтому для нивелирования подобных рисков, желательно решать проблему тиреотоксикоза еще до беременности, в случае гиперпродукции гормонов – в большинстве случаев радикально – с помощью хирургического лечения или радиойодтерапии.
Структурные изменения щитовидной железы и репродуктивная функция
Увеличение щитовидной железы при отсутствии нарушения функции само по себе не является фактором, способным повлиять на репродуктивную систему. Однако оно может указывать на две возможные проблемы: аутоиммунный процесс, влияние которого описано ранее, или дефицит йода. У женщин такое увеличение встречается чаще, чем у мужчин, так как во время беременности щитовидная железа увеличивается до 10% у женщин, проживающих в областях без дефицита йода, и на 20–40% – в районах с дефицитом йода. К счастью, уже неактуальна ситуация, когда из-за дефицита йода могли развиться когнитивные нарушения и, тем более, кретинизм у детей; однако, до сих пор персистирующий дефицит йода может со временем приводить к узлообразованию у женщин, а далее – и к токсической аденоме с развитием тиреотоксикоза. Именно поэтому согласно рекомендациям ЕТА и АТА, начиная с 2011 г., все беременные и кормящие женщины, за исключением женщин с уже выявленным тиреотоксикозом вследствие гиперфункции щитовидной железы, должны получать дополнительно не менее 250 мкг, но не более 500 мкг йода в сутки [33, 34].
Если узловые образования в щитовидной железе уже выявлены, то необходимо ответить на два вопроса: есть ли нарушение функции щитовидной железы, и является ли это образование доброкачественным.
Мелкие изменения в щитовидной железе менее 1 см с неизмененной функцией клинического внимания обычно не требуют. Более крупные образования необходимо дообследовать, вне зависимости от того, выявлены ли они до беременности или во время нее. В настоящее время для этого применяется две методики: ультразвуковое исследование (УЗИ) и тонкоигольная пункционная биопсия. Если ранее рекомендовалось пунктировать все узлы более 1 см, то в настоящее время УЗИ экспертного уровня с оценкой узлов по шкале TIRADS [45] позволяет проводить стратификацию риска малигнизации узлов и направлять на биопсию меньшее количество пациентов. При подтверждении доброкачественных коллоидных узлов лечения такие женщины не требуют – только адекватной йодной профилактики для предотвращения роста и ежегодного динамического наблюдения.
Распространенность доброкачественных узловых образований при беременности крайне разнообразна и зависит, преимущественно, от популяции и региона проживания. В трех исследованиях в областях с легкой и умеренной йодной недостаточностью (Брюссель, Китай и Германия) оценивали распространенность узловых образований щитовидной железы во время беременности, влияние беременности на размеры узлов и частоту обнаружения новых узлов во время беременности. Распространенность узловых образований щитовидной железы варьировала от 3 до 21% и повышалась с увеличением паритета. Во время беременности сообщалось об увеличении объема узлов, который возвращался к объемам первого триместра на третий месяц после родов. У 11–20% женщин, у которых в первом триместре беременности был обнаружен узел щитовидной железы, в течение беременности появлялся второй узел. По мере увеличения возраста повышается доля беременных женщин, у которых определяют узлы щитовидной железы [4, 46].
Иная тактика применяется при подтверждении злокачественного характера узловых образований. Популяционный ретроспективный анализ родов, произошедших в Калифорнии в период с 1991 по 1999 гг. (4 846 505 женщин), выявил распространенность рака щитовидной железы во время беременности 14,4 на 100 000, при этом наиболее часто определялся папиллярный рак [47]. Сроки диагностики рака щитовидной железы были следующими: 3,3 / 100 000 случаев, диагностированных до родов, 0,3 / 100 000 во время родов и 10,8 / 100 000 в течение одного года после родов.
При выявлении высокодифференцированного (папиллярного или фолликулярного) рака щитовидной железы при беременности тактика зависит от сроков гестации. При диагностике в 1-м триместре беременности рекомендуют динамическое наблюдение и, в случае значимого роста узла, оперативное лечение предлагается во 2-м триместре. Если рак щитовидной железы выявлен во 2–3 триместрах, оперативное лечение обычно откладывается на послеродовый период. Это связано с тем, что высокодифференцированные раки за время беременности прогрессируют не быстро [1]. Другие виды рака щитовидной железы встречаются намного реже, но требуют более агрессивного подхода.
Если рак щитовидной железы выявлен и пролечен еще до беременности, считается, что беременность не повышает риск рецидива рака щитовидной железы у женщин. Таким образом, женщины с полным ответом на терапию не требуют какого-то особенного мониторинга во время беременности, кроме динамического наблюдения и коррекции послеоперационного гипотиреоза [1]. Крайне важным является планирование беременности только после подтверждения ультразвуковой и биохимической ремиссии заболевания.
Заключение
Таким образом, понимание взаимного влияния щитовидной железы и репродуктивной системы, а также своевременное выявление и коррекция патологии щитовидной железы являются важными факторами, необходимыми для успешной реализации репродуктивной функции у женщин.



