Введение
Синдром Сезари (СС) является лейкемическим вариантом Т-клеточной эпидермотропной лимфомы кожи, клинически проявляющийся покраснением всего кожного покрова, крупнопластинчатым шелушением и поражением внутренних органов. Этот относительно редкий дерматоз зачастую характеризуется слабым клиническим ответом на проводимую терапию и неблагоприятным прогнозом без адекватного лечения. Определенной сложностью при ведении больных данной патологией является необходимость участия в процессе диагностики и лечения врачей различных специальностей. Это условие трудно реализуемо при узкоспециализированной медицинской помощи в районных кожно-венерологических диспансерах или стационарах дерматологического профиля, изолированных многопрофильных медицинских стационарах. Недостаточное количество кабинетов фототерапии, отсутствие на фармацевтическом рынке Российской Федерации лекарственных препаратов второй и третьей линий терапии, рекомендованных для лечения СС зарубежными экспертными организациями (такими, как FDA), являются одной из важных проблем для практикующего врача. Кроме этого низкая доступность в аптечной сети РФ некоторых лекарственных препаратов, уже зарегистрированных в России и пригодных для лечения СС, не позволяют накапливать собственный положительный опыт ведения больных данной патологией дерматологам и врачам других специальностей.
В связи с этим случаи полной реконвалесценции или длительной ремиссии у больных синдромом Сезари в нашей стране казуистически редки.
Клиническое наблюдение
 Пациент Е. 52 лет (1962 г.р.) обратился на кафедру дерматовенерологии СЗГМУ им. И.И. Мечникова с жалобами на покраснение и сухость кожи, сопровождающимися интенсивным зудом.
Пациент Е. 52 лет (1962 г.р.) обратился на кафедру дерматовенерологии СЗГМУ им. И.И. Мечникова с жалобами на покраснение и сухость кожи, сопровождающимися интенсивным зудом.
Заболевание началось около 6 лет назад с появления красных пятен на коже туловища, которые не сопровождались субъективными ощущениями. За медицинской помощью обратился лишь через 3 года в связи с усилением кожного зуда, появлением высыпаний в местах соприкосновения с одеждой с постепенным распространением на все кожные покровы. В области внутренней поверхности обоих бедер на фоне сухой, гиперемированной кожи сформировались трещины, экскориации, усилилось крупнопластинчатое шелушение.
В апреле 2012 г. в анализе крови выявлен лейкоцитоз (20×109/л), относительный лимфоцитоз до 95% и с подозрением на лимфопролиферативное заболевание больной был направлен на консультацию к гематологу. Терапия антигистаминными препаратами в течение нескольких месяцев оказалась неэффективной.
В октябре 2012 г. пациент был госпитализирован в терапевтическое отделение с диагнозом Т-клеточная лимфома с вовлечением кожи, шейных, подмышечных, паховых лимфоузлов и лимфоузлов в воротах печени в стадии лейкемизации (синдром Сезари)/Т-клеточный хронический лимфолейкоз».
При цитологическом исследовании костного мозга отмечена гиперплазия лимфоидного ростка до 48,8%, лимфоидные клетки представлены малыми лимфоцитами с церибриформными ядрами и высоким ядерно-цитоплазматическим соотношением (мелкоклеточный вариант клеток при СС).
При проточно-цитометрическом исследовании клеток костного мозга выявлены Т-лимфоциты с абберантным соотношением основных Т-лимфоидных антигенов CD4/CD8 (90% CD3+-Т-лимфоцитов имели фенотип CD4+) и цепей Т-клеточного рецептора (TcRαβ/TcRγδ; практически все Т-клетки позитивны по экспрессии TcRαβ; CD3+; TcRαβ+=93,4%), на этих клетках выявлено также снижение степени интенсивности экспрессии Т-клеточного антигена CD7, что не характерно для нормальных лимфоцитов. Таким образом, эти клетки имеют Т-клеточный иммунофенотип CD2+, CD3+, CD4+, CD5+, CD7dim+, TcRαβ+, что может соответствовать иммунофенотипическому диагнозу СС.
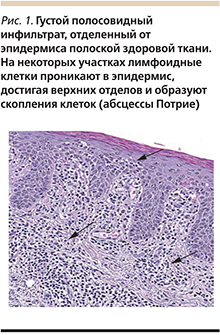
При гистологическом исследовании кожи выявлены рыхлые лимфоидные инфильтраты в поверхностных слоях дермы, состоящие из клеток среднего размера с ядрами неправильной формы, проявляющие тропность к эпидермису с образованием многочисленных абсцессов Потрие (рис. 1), при иммуногистохимическом исследовании выявлена экспрессия LCA, CD3, CD2, CD5, CD4. Таким образом, морфологическая картина и иммунофенотипирование опухолевых клеток соответствуют грибовидному микозу (рис. 2, 3).
При спиральной компьютерной томографии шеи, органов груди, живота и малого таза выявлены многочисленные глубокие и поверхностные лимфатические узлы: шеи до 1,4×0,8 см; немногочисленные подмышечные лимфатические узлы до 2,9×0,7 и 1,9×1,1 см справа, до 3,3×2,0 и 2,4×1,1 см слева; единичные портальные лимфатические узлы 1,0×0,7 и 1,1×0,7 см; единичные подвздошные лимфатические узлы до 0,9×0,6 см (справа), а также многочисленные паховые лимфатические узлы до 2,7×1,4 см справа и 3,6×1,9 см слева. Печень увеличена в размерах (КРР=20,1), однородной структуры, плотностью +40/+46HU.
В левой верхне-челюстной пазухе выявляются утолщение слизистой оболочки и наличие густого содержимого (до +15HU): признаки левостороннего гайморита.
За время нахождения больного в терапевтическом отделении было проведено 8 курсов полихимиотерапии: CHOP (циклофосфан 750 мг/м2+доксорубицин 50 мг/м2+винкристин 1,4 мг/м2 – 1-й день, преднизолон 40 мг/м2 – 1–5-й дни)+проспидин (200 мг внутримышечно – 21 день). Под влиянием проведенной терапии элементы кожной сыпи разрешились частично, относительное количество лимфоцитов в периферической крови снизилось до 48%.

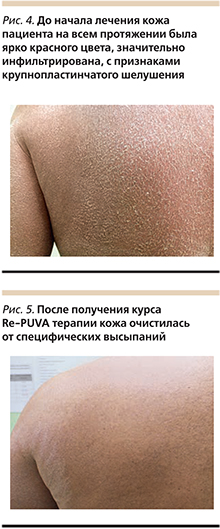
Через 2 месяца в связи с обострением кожных изменений была проведена терапия быстрыми электронами, однако из-за развития лучевого дерматита 2-й степени лечение было прекращено и пациент получал системные глюкокортикостероиды (ГКС; преднизолон) в суточной дозе 60 мг с последующим снижением до поддерживающей дозы (20 мг/сут), на фоне применения которой появились новые высыпания в виде микровезикул на поверхности гиперемированной кожи. Общее самочувствие ухудшилось: появилась и постепенно усилилась одышка, показатели артериального давления повысились до 140/100 мм рт.ст. Появились головные боли, что и послужило причиной отмены данной терапии. На фоне применения наружных суперпотентных ГКС (клобетазол), антиметаболита фолиевой кислоты (метотрексат) внутримышечно 30 мг 1 раз в неделю в течение 2 месяцев пациент отметил незначительное улучшение в виде снижения интенсивности зуда, уменьшения гиперемии кожи. После 12-й инъекции метотрексата клинические симптомы возобновились и в последующем стали нарастать: зуд усилился, появились эктропион век, озноб и лихорадка (рис. 4).
 В августе 2014 г. пациент был представлен на клиническом разборе президенту Французского Общества дерматологии. Диагноз верифицирован, однако план терапии был скорректирован. В течение последующих 6 месяцев больной получал системные ретиноиды (ацитретин 25–50 мг/сут) в сочетании с PUVA-терапией (кумулятивная доза – 245 Дж/см2). На фоне проводимого лечения пациент уже с первых недель отметил улучшение: интенсивность гиперемии и инфильтрация кожи значительно снизились и полностью разрешились к началу 7-го месяца фототерапии.
В августе 2014 г. пациент был представлен на клиническом разборе президенту Французского Общества дерматологии. Диагноз верифицирован, однако план терапии был скорректирован. В течение последующих 6 месяцев больной получал системные ретиноиды (ацитретин 25–50 мг/сут) в сочетании с PUVA-терапией (кумулятивная доза – 245 Дж/см2). На фоне проводимого лечения пациент уже с первых недель отметил улучшение: интенсивность гиперемии и инфильтрация кожи значительно снизились и полностью разрешились к началу 7-го месяца фототерапии.
На всем протяжении кожа очистилась от специфических высыпаний, ощущение зуда стало появляться эпизодически, однако в области ладоней и подошв длительное время сохранялись очаги гиперкератоза (рис. 5).
Значительно улучшилось и общее состояние. В клиническом анализе крови при выписке нормальные показатели гемоглобина, эритроцитов и тромбоцитов (эритроциты – 4,50×1012/л, гемоглобин – 141 г/л, тромбоциты – 190×109/л), лейкоцитоз за счет абсолютного лимфоцитоза (лейкоциты – 30,57×109/л, лимфоциты – 86,9%, моноциты – 2,2%, нейтрофилы сегментоядерные – 7,7%, эозинофилы – 3,2%), СОЭ – 35 мм/ч.
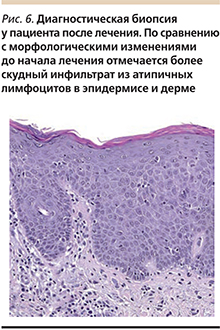
При повторном гистологическом исследовании в эпидермисе отмечен неравномерный паракератоз, псориазиформный акантоз. В большей части препарата в эпидермисе имеются лимфоидные клетки с ядрами различной величины, степени выраженности базофилии, голоядерные лимфоциты. В дерме определяется полосовидный инфильтрат, состоящий преимущественно из атипичных лимфоцитов с ядрами триангулярной формы и церебриформными ядрами. Данные клетки имеют тенденцию проникать в эпидермис на всем протяжении среза. Атипичные лимфоциты в эпидермисе имеют бόльшие размеры, чем в дерме. Местами между коллагеновыми волокнами отмечены атипичные лимфоциты, расположенные линейно («indian-file cells» синдром). Описанные гистологические изменения соответствуют картине Т-клеточной эпидермотропной лимфомы кожи (рис. 6).
При обсуждении больного с гематологом изменение показателей периферической крови расценены как «некритические», а задача по поддержанию состояния кожи, свободной от специфических высыпаний, определена как первостепенная. Однако при появлении и прогрессировании симптомов поражения лимфоидных органов, повышении количества лимфоцитов в периферической крови необходима повторная консультация с целью решения вопроса о целесообразности присоединения системной полихимиотерапии.
Обсуждение
Анализ материалов данного клинического случая позволяет сделать вывод о неэффективности диагностических и терапевтических мероприятий, осуществленных в дебюте заболевания, выполненных за время прохождения обследования и лечения данного пациента. Амбулаторно-диагностический алгоритм выполнялся непоследовательно, либо в излишнем объеме, либо несвоевременно и неполностью. Так, в течение первых нескольких лет при обращении к дерматологу пациенту выставлялись различные клинические диагнозы, характеризующие состояние кожи не как злокачественное заболевание, а как воспалительный или аллергический дерматоз.
Известно, что в большинстве случаев высыпания на начальных стадиях Т-клеточных лимфом кожи не имеют признаков четкой нозологической принадлежности и малоспецифичны [1, 3], однако у данного пациента отсутствие клинического эффекта на длительно проводимую терапию могло бы быть показанием к проведению диагностической биопсии кожи [2].
 С другой стороны, как раз характер элементов кожной сыпи, их топография, а именно локализация высыпаний в местах трения кожи одеждой, торпидность течения процесса, оказались достаточным основанием, для того чтобы заподозрить лимфопролиферативное заболевание.
С другой стороны, как раз характер элементов кожной сыпи, их топография, а именно локализация высыпаний в местах трения кожи одеждой, торпидность течения процесса, оказались достаточным основанием, для того чтобы заподозрить лимфопролиферативное заболевание.
Из анамнеза также известен факт использования данным пациентом антигистаминных препаратов и витаминов после подтверждения злокачественного характера пролиферации лимфоидной ткани. Согласно современным представлениям о терапии СС, нет данных об эффективности для пациентов с данной патологией десенсибилизирующей и витаминотерапии [19].
В настоящее время для лечения СС используется стадийный подход [2]. Основной принцип терапии основан на постепенном наращивании интенсивности терапевтического потенциала в соответствии со стадией или фазой заболевания, без применения наиболее агрессивных методов лечения в дебюте болезни [4, 19]. Так, лечение ранних стадий СС (IA-IIA) включает лишь назначение топических ГКС, а при их неэффективности – фототерапию (PUVA, NB-UVB; 311 nm, TL01) и лишь при торпидном рецидивирующем течении или прогрессировании заболевания прибегают к системной терапии [18].
В лечении СС широкое применение нашли иммуномодулирующие препараты (интерферон-α, интерферон-γ), оральные рексиноиды (бексаротен), ретиноиды-АТРА (третинаин – Весаноид), агонисты toll-like-рецепторов (имиквимод, CpG 7909), дериваты ретиноевой кислоты (этретинат – Тегизон), ацитретин [Сориатан]), ингибиторы деацетилазы гистонов (вориностат – Золинза), ромидепсин, гибридный токсин денилейкин дифтитокс (Онтак), метотрексат, моноклональные антитела (алемтузумаб, занолинумаб, сиплизумаб), ингибиторы топоизомеразы (этопозид), пегилированный и липосомальный доксорубицин (Доксил), ингибитор протеососмы бортезомиб (Велкейд), алкилирующие препараты (хлорамбуцил – Лейкеран), циклофосфамид (Цитоксан), темозоламид (Темодал), аналоги пурина (флударабина монофосфат), 2-хлордеоксиаденозин (Кладрибин), деоксикоформицин (Пентостатин), гемцитабин (Гемзар), фородезин, пралатрексат, а также экстракорпоральный фотоферез и трансплантация гемопоэтических стволовых клеток [5].
Наиболее часто в дерматологической практике врач сталкивается с начальными стадиями СС. В связи c этим наиболее актуальны для дерматологов препараты первой линии – суперпотентные ГКС, метод второй линии – фототерапия, а также препараты, успешно сочетающиеся со светолечением, – ретиноиды и рексиноиды [6].
Топические ГКС
Противовоспалительный и иммуносупрессивный эффекты топических ГКС объяснются их механизмом действия. Имея липофильную структуру, они легко проникают через цитоплазматическую мембрану кератиноцитов и других клеток кожи путем прямой диффузии и быстро связываются в цитоплазме с рецепторными белками. Активированный гормон-рецепторный комплекс перемещается из цитоплазмы в ядро, накапливается в хроматине и, взаимодействуя с определенными его участками, воздействует на ДНК, ингибируя синтез интерлейкина-1 и повышая синтез липокортина, угнетающего активность фосфолипазы А2.
 Подавление фосфолипазы А2 в свою очередь влечет за собой снижение синтеза простагландинов и лейкотриенов, играющих ключевую роль в патогенезе воспаления [19].
Подавление фосфолипазы А2 в свою очередь влечет за собой снижение синтеза простагландинов и лейкотриенов, играющих ключевую роль в патогенезе воспаления [19].
Кроме этого, связываясь со специфическими рецепторами мембран лейкоцитов, липокортин угнетает эпителиальную адгезию лейкоцитов, их миграцию из сосудистого русла в эпидермис, хемотаксис, фагоцитоз, окислительный метаболизм. Также он подавляет высвобождение различных медиаторов аллергии и воспаления, таких как лизосомальные ферменты, тканевые активаторы плазминогена, воздействуя на нейтрофилы, макрофаги и мастоциты [7].
Фототерапия
Механизм действия фототерапии при СС заключается в повреждении UV-лучами опухолевого пула Т-лимфоцитов в дерме и эпидермисе, чем и обеспечивается терапевтический эффект. При попадании UV-лучей на кожу, в ней формируются устойчивые соединения, обратимо связывающиеся с ДНК, в результате чего образуются бифункциональные аддукты к пиримидиновым основаниям. Конечным этапом воздействия является ингибирование синтеза клеточной ДНК, лимфоцитотоксичность, а при регулярном и длительном воздействии – стойкое снижение содержания циркулирующих в коже иммунокомпетентных клеток [8].
Правильный выбор методики фототерапии является для лечащего врача одним из основополагающих условий успешного лечения. Он зависит от множества факторов, таких как фаза или стадия заболевания, возраст и наличие у пациента коморбидных состояний, сопутствующей патологии.
Существует несколько основных видов фототерапии: UVA1, UVA2 в сочетании с фотосенсибилизатором (PUVA) и NB-UVB (311 nm, TL01).
Терапия NB-UVB (311 nm, TL01) не требует использования сенсибилизирующих агентов и по своей интенсивности значительно превосходит UV-лучи типа А, однако ее лечебный эффект ограничен лишь поверхностным воздействием. В связи с этим длительно существующие высыпания, сопровождающиеся значительным акантозом (лихенизацией, инфильтрацией) или наличием корок на своей поверхности, делают этот вид фототерапии малоэффективным, а применение PUVA с более высокой пенетрационной способностью – приоритетным. С другой стороны, из-за своего поверхностного воздействия NB-UVB (311 nm, TL01) в отличие от PUVA-терапии способно более стойко подавлять функцию клеток Лангерганса и продукцию цитокинов в иммунокомпетентных кератиноцитах, чем и объясняется ее более быстрый терапевтический ответ.
Сочетание светолечения и медикаментозной терапии значительно раздвинуло рамки терапевтического арсенала, позволив изменить прогноз заболевания.
К. Томсен и соавт. в рандомизированном исследовании доказали более высокую эффективность этретината и изотретиноина в сочетании с PUVA-терапией по сравнению с монотерапией лучами PUVA 69 больных на ранней стадии грибовидного микоза (частота клинического ответа – 72%) [9].
N.J. Lowe и соавт. отметили более выраженный эффект от сочетанного применения циклофосфамида и PUVA-терапии по сравнению с длительно проводимым лечением преднизолоном и фототерапией больных СС [10].
Ретиноиды
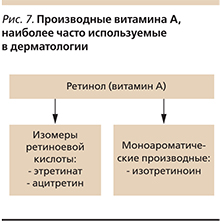
Наиболее актуальными в практике дерматолога среди препаратов этого класса являются структурные аналоги ретинола (витамина А) [11] (рис. 7).
В настоящее время на фармакологическом рынке представлены как системные, так и наружные лекарственные формы производных витамина А.
Из-за особенностей химической структуры молекулы витамина А, состоящей из трех компонентов, стало практически возможным создание целого ряда синтетических аналогов, обладающих меньшей токсичностью, лучшей биодоступностью и более высоким терапевтическим эффектом, чем витамин А.
Механизм действия системных ретиноидов при CС основан на их антипролиферативном действии на кератиноциты. Проникая через клеточную мембрану, ретиноиды связываются с рецепторами клеточного ядра и тормозят пролиферативную активность, воздействуя на транскрипцию генов и как следствие – на экспрессию генов-мишеней [12]. Кроме того, ретиноиды подавляют миграцию нейтрофилов и ингибируют презентацию антигенов [13, 14]. Это ингибирование обусловлено не только клетками Лангерганса, но и самими кератиноцитами, обладающими весьма высокой степенью иммунокомпетентности.
Рексиноиды
Это качественно новый класс препаратов, имеющий близкий к ретиноидам механизм действия, однако в отличие от последних рексиноид бексаротен селективно активирует ретиноевые Х-рецепторы (RXR), а не RAR, на которые воздействует ретиноевая кислота [15]. Имея три подтипа (α, β, γ), RXR, взаимодействуя с бексаротеном, формирует гомодимеры, которые при активации функции в качестве факторов транскрипции регулируют клеточную дифференцировку и пролиферацию. Бексаротен также может образовывать гетеродимеры с другими видами ядерных рецепторов (RAR, рецептор витамина D, рецептор тиреоидного гормона), чем и объясняется наличие у него более широкой биологической активности [16]. Кроме того, бексаротен имеет проапоптотический эффект и подавляет клеточный рост лимфоцитов, что имеет особое значение в лечении СС. Также описано иммуномодулирующее действие бексаротена за счет увеличения популяции CD8+ лимфоцитов [17].
Выводы
Основной принцип лечения СС заключается в постепенном наращивании терапевтического потенциала с учетом стадии заболевания, без применения неоправданно агрессивных схем стандартной полихимиотерапии с низким уровнем клинического ответа в начальных стадиях заболевания.
Фототерапия в сочетании с пероральным приемом системных ретиноидов является приоритетным методом выбора и позволяет уже на ранних этапах снизить риск развития таких осложнений СС, как гипертермия, вторичная инфекция, повышение артериального давления, сердечно-сосудистые заболевания.
СС является междисциплинарной проблемой, требующей пристального внимания врачей различных специальностей: дерматолога, гематолога, патоморфолога и онколога.
Создание единого регистра больных СС позволит консолидировать усилия врачей различных специальностей в отношении этой проблемы, позволив накапливать отечественным специалистам собственный опыт ведения пациентов с этой патологией.



