Введение
Антибактериальная терапия послеродовой инфекции проводится эмпирически и должна основываться на локальных данных о структуре и антибиотикорезистентности возбудителей. В настоящее время у родильниц, пуэрперальный период которых осложнился развитием послеродового эндометрита (ПЭ), увеличивается доля аэробных грамотрицательных бактерий как возбудителей инфекции [1–4]. Если до недавнего времени ведущим аэробным возбудителем ПЭ была Escherichia coli, то в последние годы не менее широкое распространение получили и другие представители семейства Enterobacteriaceae [5, 6]. Энтеробактерии, как правило, обладают низкой чувствительностью к различным классам антибактериальных препаратов, а также способностью приобретать резистентность в процессе лечения, что представляет существенные проблемы при проведении антибактериальной терапии.
По данным ранее проведенных исследований [1, 2], было показано, что Enterobacter cloacae, E. coli и Klebsiella pneumoniae являются основными возбудителями ПЭ из группы грамотрицательных аэробных микроорганизмов. На основании этих данных особое значение приобретает изучение антибиотикорезистентности к наиболее часто применяемым препаратам именно этих микроорганизмов, что и явилось целью настоящего исследования.
Материал и методы
На базе кафедры репродуктивного здоровья женщин Северо-Западного государственного медицинского университета им. И.И. Мечникова в СПбГУЗ «Родильный дом № 6 им. проф. В.Ф. Снегирева» были подвергнуты анализу результаты бактериологического исследования метроаспирата на 130 родильницах с ПЭ. Взятие метроаспирата проводили при появлении первых симптомов заболевания до начала антибактериальной терапии. Забор отделяемого из полости матки осуществляли при помощи специального аспирационного устройства, исключающего контаминацию образцов микрофлорой влагалища и цервикального канала. Посев материала проводили на питательную среду в момент взятия.
В лаборатории раневой инфекции Российского НИИ травматологии и ортопедии им. Р.Р. Вредена была проведена окончательная идентификация полученного материала. Время полного микробиологического анализа с углубленным исследованием по классическим методам аэробной и анаэробной бактериологии составило около 7 дней.
Микробиологическое исследование биоматериала на пациентках проведено в соответствии с Методическими указаниями по определению чувствительности микроорганизмов к антибактериальным препаратам (МУК 4.2.1890-04. 2004) с использованием полуавтоматизированной системы идентификации выделенных микроорганизмов на тест-системах Lachema (Чехия) с учетом результатов на планшетном микрофотометре iEMSReader (ThermoLabsystem, Финляндия), включающем системы микробиологического мониторинга «Микроб-Автомат» и «Микроб-2». Определение чувствительности к антибактериальным препаратам проведено диско-диффузионным методом с использованием дисков фирм Bio-Rad Laboratories (США) и bioMerieux (Франция), а также полуавтоматизированным методом с использованием стандартных панелей «СТАФИ-тест ТПК-6» (Россия).
Чувствительность выделенных штаммов грамотрицательных микроорганизмов определена к ампициллину, ампициллину/сульбактаму, пиперациллину/тазобактаму, цефотаксиму, цефтриаксону, цефтазидиму, цефоперазону, цефоперазону/сульбактаму, цефепиму, имипенему, меропенему, гентамицину, ципрофлоксацину, доксициклину, тетрациклину.
Полученные данные интерпретированы в соответствии со стандартами Национального комитета по клиническим лабораторным стандартам США (National Committee for Clinical Laboratory Standards – NCCLS) [7].
При характеристике микроорганизмов использовались общепринятые категории: чувствительные (Ч), умереннорезистентные (УР) и резистентные (Р). Для интегральной характеристики лекарственной устойчивости резистентные и умеренно-резистентные микроорганизмы были объединены в группу нечувствительных штаммов, как рекомендуется Европейской системой по контролю антибиотикорезистентности (EARSS –
European Antimicrobial Resistance Surveillance Scheme). Полученные данные анализировались с помощью программы мониторинга за антибиотикорезистентностью, представленной Всемирной организацией здравоохранения WHONET 5.1.
Результаты исследования
Из исследованных метроаспиратов было выделено и идентифицировано 282 штамма. Отсутствие роста микроорганизмов в содержимом полости матки отмечено у 2 (1,5%) родильниц (рис. 1). Наиболее часто (86,2%) микроорганизмы высевались в виде ассоциаций, при этом чаще наблюдались аэробно-анаэробные (55,4%). Ведущее положение в спектре грамотрицательных возбудителей ПЭ (91%) занимают аэробные палочки семейства энтеробактерий (E. cloacae – 45,1%, E. coli – 33,3% и K. pneumoniae – 21,6%) (рис. 2).
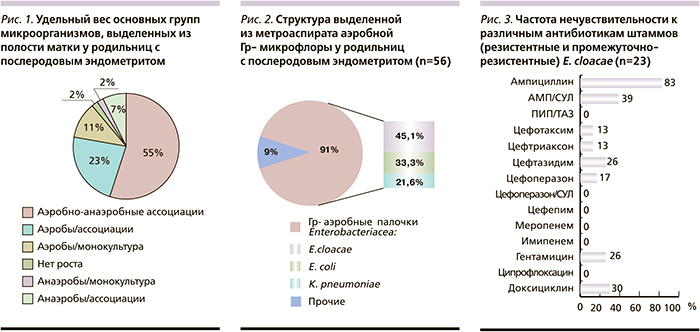
Высокая резистентность изолятов E. cloacae отмечена к ампициллину, доксициклину и цефтазидиму. Комбинированные антимикробные препараты с ингибиторами β-лактамаз показывают значительно большую активность в отношении данного микроорганизма (рис. 3), однако чувствительность выделенных штаммов к ампициллину/сульбактаму остается достаточно низкой. Из представленных данных видно, что наиболее эффективными были пиперациллин/тазобактам, цефоперазон/сульбактам, цефепим, ципрофлоксацин и карбапенемы.
Выделенные изоляты E. coli обладают наибольшей резистентностью к аминопенициллинам, цефалоспоринам, гентамицину, ципрофлоксацину, доксициклину и тетрациклину (рис. 4). Максимально активным в отношении E. coli были пиперациллин/тазобактам, цефоперазон/сульбактам и карбапенемы, к которым были чувствительны все штаммы данного микроорганизма.
Выделенные изоляты K. pneumoniae обладают наибольшей среди представленных видов энтеробактерий резистентностью к антимикробным препаратам (рис. 5). Наибольшую активность в отношении штаммов K. pneumoniae сохраняют пиперациллин/тазобактам, карбапенемы и тетрациклин.
Обсуждение
Микробиологический мониторинг в послеродовых отделениях акушерского стационара показал, что около 91% случаев ПЭ протекают с участием аэробных грамотрицательных палочек семейства Enterobacteriaceae.
Анализ данных, полученных в ходе изучения антибиотикорезистентности клинически наиболее значимых энтеробактерий, позволяет сделать ряд заключений.

Инфекции, вызываемые E. coli, представляют наименьшую проблему для этиотропной терапии ПЭ. Тем не менее рассматривать в качестве надежных средств эмпирической терапии незащищенные ингибиторами β-лактамазы цефалоспорины III поколения, аминопенициллины и гентамицин нельзя, поскольку уровень чувствительности к ним достигал лишь 35–70%. Наличие ассоциированной устойчивости к цефалоспоринам III поколения и гентамицину является типичным свойством возбудителей нозокомиальной инфекции. Феномен связан с локализацией генов, детерминирующих продукцию β-лактамаз расширенного спектра и аминогликозидмодифицирующих ферментов на одних и тех же плазмидах, что обеспечивает их совместное распростра-нение [8, 9].
Лечение послеродовой инфекции, вызванной K. pneumonia, представляет собой гораздо более сложную задачу. Механизмы устойчивости клебсиелл во многом сходны с таковыми у кишечной палочки, однако частота их распространения гораздо шире. Так, в ходе одного из многоцентровых исследований, проведенных в Российской Федерации в 1999 г., частота распространения β-лактамаз расширенного спектра (обусловливающих устойчивость к цефалоспоринам III поколения) колебалась в различных учреждениях от 0 до 93% [10].
Выявленная в настоящем исследовании крайне низкая частота чувствительности клебсиелл к цефалоспоринам III поколения и гентамицину ставит под сомнение возможность широкого использования этих антимикробных препаратов в конкретном акушерском стационаре. Следовательно, пиперациллин/тазобактам и карбапенемы остаются практически единственными средствами лечения тяжелых форм ПЭ, вызванных клебсиеллами.
Среди E. cloacae частота чувствительности к цефалоспоринам III поколения колебалась на уровне 74–87%. Очевидно, что данные препараты сохраняют свое значение при лечении тяжелых форм ПЭ, вызванных энтеробактерами, однако вероятность неудач достаточно существенна.
В сложившейся ситуации низкой частоты чувствительности к гентамицину и ципрофлоксацину также возрастает значение пиперациллина/тазобактама и карбапенемов как средств эмпирической терапии послеродовых инфекций, вызванных микроорганизмами группы Enterobacter.
Таким образом, из β-лактамных антибиотиков наибольшую активность в отношении выделенных изолятов энтеробактерий сохраняют пиперациллин/тазобактам, цефоперазон/сульбактам и карбапенемы. Полученные данные свидетельствуют о 100%-ной чувствительности энтеробактерий к карбапенемам. Эти данные согласуются с мировым опытом, который свидетельствует о крайне редком выделении штаммов этого семейства, устойчивых к имипенему или меропенему. Чувствительность энтеробактерий к аминогликозидам различается в зависимости от вида микроорганизма: наибольшая резистентность к данной группе установлена у штаммов K. pneumoniaе. Чувствительность E. coli и E. cloacae к гентамицину была выше, но не превысила 70%, что исключает возможность широкого применения этого аминогликозида для эмпирической терапии послеродовой инфекции. Возможность эмпирического применения других антимикробных препаратов (некомбинированных цефалоспоринов III–IV поколений, защищенных аминопенициллинов и фторхинолонов) определяется локальными условиями, их использование может быть связано с риском клинической неудачи.
Внедрение в клиническую практику рационально ограниченного списка антибиотиков является одним из способов управления антимикробной терапией в стационаре. Основой построения формуляра должны быть нозологическая структура пациентов, микробный пейзаж возбудителей инфекции и уровень их антибиотикорезистентности.



