Актуальность
Атопический дерматит (АтД) – это хроническое рецидивирующее воспалительное заболевание кожи, связанное с гиперреактивностью иммунного ответа в результате нарушения эпидермального барьера в отношении триггеров окружающей среды, которое обычно развивается в раннем детском возрасте.
За последние 10 лет было зарегистрировано увеличение заболеваемости АтД в детской популяции в 2–3 раза, особенноу детей в возрасте до 2 лет. У 45% детей начало АтД проявляется в течение первых 6 месяцев жизни, в течение первого года жизни – у 60%, в возрасте до 5 лет – минимум у 85%. Заболевание, развившееся в возрасте до 2 лет, у 20% детей имееет хроническое течение, а еще 17% детей будут иметь перемежающиеся симптомы до 7 лет [1].
Патогенез АтД объясняется в основном нарушениями в адаптивной системе иммунного ответа, причем ключевую роль играют дисрегуляция T-хелперов 1 (Th1)/Th2-клеток, усиление экспрессии иммуноглобулина Е (IgE), передача сигналов дендритными клетками и гиперреактивность тучных клеток, что влечет за собой зуд и воспаление. Именно поэтому терапия при АтД первых лет жизни направлена на улучшение состояния эпидермального барьера [2]. В последнее время появляются доказательства того, что воспаление при АтД возникает в результате наследственных и приобретенных факторов, которые приводят к изменению структуры и функции эпидермиса, после чего активируется иммунная система, что в свою очередь имеет негативные последствия для гомеостаза эпидермального барьера. Этот цикл представляет собой модель патогенеза АтД «снаружи–внутри–снаружи» [3, 4].
Кожный барьер у детей первых лет жизни не до конца сформирован, его зрелость прямо пропорциональна гестационному возрасту. Роговой слой у новорожденных в отличие от взрослых состоит из 2–3 слоев ороговевшего эпителия. Зернистый слой тоньше, в его клетках наблюдается отсутствие кератина. Существует много клинических данных, подчеркивающих важность рогового слоя и его барьерной функции для младенцев и особенно для новорожденных [5]. Младенцы, рожденные недоношенными (гестационный возраст менее 34 недель), имеют недостаточно развитую барьерную функцию кожи, и многие исследования были сосредоточены на определении влияния гестационного возраста на развитие эпидермального барьера. Учитывая резкий переход от водной к сухой окружающей среде при рождении, исследования касались адаптации кожного барьера в течение первых нескольких дней или первого месяца жизни. Английские ученые доказали, что пик значения трансэпидермальной потери воды (ТЭПВ) наблюдался в группе детей в возрасте 1–2 лет, их показатель был значительно выше, чем ТЭПВ у взрослых. Это объясняет процесс продолжающейся адаптации кожи к внешним условиям окружающей среды [6].
Известно, что кожа доношенных младенцев имеет большую склонность к развитию АтД, а также способна к более высокому транскутанному всасыванию. Известно, что естественный увлажняющий фактор (NMF – natural moisturizing factor) в роговом слое участвует в барьерной функции и служит эффективным увлажнителем [7]. Показано, что концентрация NMF с возрастом снижается, зависит от проявления кожных заболеваний и факторов окружающей среды [8]. Измерение ТЭПВ обычно считается надежным инструментом, объективно оценивающим барьерную функцию эпидермиса, особенно при его нарушении.
Ключевой особенностью АтД детей первого года жизни является ксероз кожи, вызванный дисфункцией кожного барьера с повышенной трансэпидермальной потерей воды. Следует помнить, что поверхность кожи новорожденного достаточно гидрофобна, это ограничивает эпидермальное поглощение воды. Связано это с тем, что наиболее важные липиды, необходимые для барьерной функции, такие как керамиды, холестерин и свободные жирные кислоты, синтезируются в ламеллярных гранулах или кератиносомах, а также внутри зернистого слоя.
Изменения уровня pH рогового слоя были обнаружены у пациентов с АтД, что может нарушать липидный обмен в коже. Важно помнить, что у детей при рождении рН поверхности кожи нейтральный или щелочной (6,2–7,5), что приводит к значительному ухудшению защитных механизмов, направленных на подавление роста патогенных микроорганизмов. Регулярное использование смягчающих средств имеет большое значение для решения этой проблемы, и одновременно с увлажнением кожи это является основой общего управления АтД. Увлажняющие средства следует применять непрерывно, по потребности и постоянно, даже в отсутствие признаков активного воспаления. Поскольку существуют различные формы увлажняющих средств, необходим индивидуальный подбор в зависимости от потребности, клинической картины, времени года. Эти факторы должны учитываться при выборе подходящей наружной терапии [9]. В зависимости от индивидуального статуса кожи, сезонных и климатических условий рекомендуется подбирать соответствующий уход. Зимой и при наличии сильного ксероза более оправданно применение безводных средств или окклюзивных формул «вода-в-масле», а для ухода за сухой кожей в летний период рекомендуются легкие кремы-эмульсии «масло-в-воде» с высоким содержанием влагоудерживающих компонентов [10].
Наиболее эффективным способом восстановления защитной функции эпидермиса служит применение средств, направленных на восстановление рогового слоя и предотвращающих избыточную ТЭПВ. Для ухода за кожей детей раннего возраста разрабатываются специализированные косметические средства. Общее правило рецептур специализированной косметики заключается в использовании гипоаллергенных активных компонентов с подтвержденной эффективностью и безопасных консервантов, имеющих набор микроэлементов и нейтральный рН, которые эффективно успокаивают и смягчают кожу детей, снимают воспаление и не содержат сенсибилизирующих компонентов (отдушек, красителей). Средства, имеющие в своем составе мочевину и салициловую кислоту, для детей первого года жизни не рекомендуются, т.к. могут вызывать раздражение кожного покрова. Смягчающие средства, имеющие в своем составе ментол, а также содержащие анестетик, эффективны в уменьшении симптомов зуда.
Согласно современным рекомендациям по уходу за кожей детей первого года жизни, важно обеспечить регулярное увлажнение и очищение кожи. Масла для ванн являются отличным дополнением для ухода за кожей, особенно у детей первого года жизни, но следует избегать тех, которые содержат аллергенные белки, такие как арахис или коллоидный овес (в наиболее уязвимой возрастной группе до 2 лет).
Смягчающие средства – безопасный и эффективный метод укрепления эпидермального барьера, поскольку они обеспечивают его источником экзогенных липидов, улучшая барьерные свойства. Увлажняющие средства, содержащие дубильные вещества и битуминосульфонат аммония (Ихтиол), могут быть полезным дополнением к основному методу лечения АтД, особенно при легкой степени тяжести или если лечение топическими глюкокортикостероидами (тГКС) невозможно, например, при кортикофобии (стероидная фобия).
В настоящее время на территории Российской Федерации зарегистрированы препараты группы топических блокаторов кальциневрина – пимекролимус в форме 1%-ного крема и такролимус в форме 0,03%- и 0,1%-ной мази. Из этих средств пимекролимус рекомендован для лечения обострений АтД у детей первого года жизни. Благоприятная клиническая эффективность пимекролимуса при АтД в настоящее время установлена и задокументирована в нескольких клинических испытаниях [11]. Эффективность пимекролимуса подтверждена в 6 испытаниях детей первого года жизни группой немецких ученых. Было проведено исследование с участием детей первого года жизни, которое показало, что длительная проактивная поддерживающая терапия с пимекролимусом снижает риск последующих рецидивов. Следует отметить исследование Petite, которое охватило большую популяцию детей с АтД (2418 пациентов) и контролировало состояние их кожного патологического процесса в течение 5–6 лет жизни, это одно из самых продолжительных исследований на настоящий момент. В нескольких других исследованиях с кремом пимекролимус также обнаружили, что применение препарата при самых ранних признаках клинического заболевания приводит к значительно меньшей потребности в «спасательной» терапии ГКС [12].
Дети первого года жизни, имеющие острые клинические проявления в виде мокнутия и эрозивных поражений, не всегда хорошо переносят местную терапию. С целью наискорейшего купирования выраженности клинических проявлений заболевания таким пациентам необходимо назначать лечение с использованием методики влажных обертываний «Wet wrap therapy» – (WWT) с тГКС III класса, фиксирующими бинтами Peha – crepp и легкими эластичными трубчатыми бинтами Tubifast [13]. WWT хорошо переносится при лечении экземы благодаря охлаждающим, противовоспалительным и противозудным свойствам. Зуд уменьшается при охлаждении посредством вазоконстрикции. WWT увеличивает увлажнение кожи и уменьшает ТЭПВ, а также защищает кожу как барьер от внешних раздражителей и аллергенов (рис. 1). Исследование показало положительное действие WWT на эпидермальный барьер, который сохраняется даже после прекращения этого метода терапии [14].
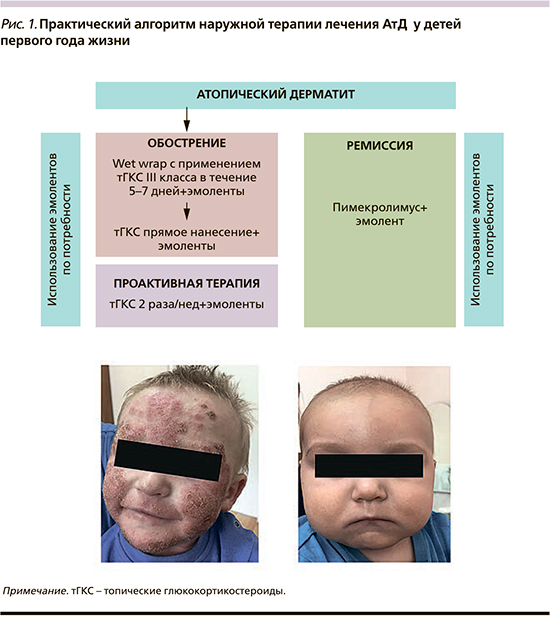
При лечении АтД детей первого года жизни нужно с осторожностью использовать тГКС в связи с возрастными анатомо-физиологическими особенностями кожи: нейтральной, а затем слабощелочной средой, рыхлым эпидермисом с тонкой базальной мембраной, богатой васкуляризацией, с большим количеством поверхностно расположенных кровеносных сосудов, большим соотношением площади кожи к массе тела пациентов раннего возраста [15, 16].
Эффективным и безопасным современным тГКС для детей первого года жизни является препарат, который в своем составе имеет гидрокортизон. Это синтетический негалогенизированный ГКС наружного применения, оказывает противовоспалительное и сосудосуживающее действия. В связи с мягким действием (относится к слабым тГКС – I класс по Европейской классификации) гидрокортизон разрешен к применению в отношении новорожденных. Кроме того, его можно использовать на чувствительных участках кожи [17].
Метилпреднизолона ацепонат (МПА) – также негалогенированный кортикостероид с метильной группой у С6, которая усиливает его эффект. MПA входит в группу сильнодействующих ГКС (класс активности III по Европейской классификации). Многократные двойные слепые плацебо-контролируемые исследования показали высокую клиническую эффективность МПА при лечении АтД через 1–4 недели применения раз в сутки, а также несколько клинических исследований подтверждают использование МПА детьми без локальных или системных побочных эффектов (8 испытаний на детях в возрасте от 4 месяцев до 15 лет действия мази 0,1% MПA 1 раз в сутки в течение 21 дня) [18].
Клинический случай
Пациентка Н. 9 месяцев. Семейный анамнез отягощен по линии отца (бронхиальная астма, АтД). В возрасте 3 месяцев появилась мелкоточечная сыпь на щеках. Лечение не проводилось. Затем высыпания распространились по всему кожному покрову, были представлены полигональными папулами, эритематозными пятнами, экскориациями. Наблюдались у педиатра по месту жительства, назначенная терапия была без эффекта. В связи с обострением и неэффективным системным и физиотерапевтическим лечением госпитализирована в стационар.
При поступлении кожный патологический процесс носил распространенный симметричный характер. На лице в области щек и подбородка наблюдались экзематозные бляшки со скудным мокнутием, чешуйками и корками на поверхности. Кожа туловища и конечностей была сухой, отмечалось явление мелкопластинчатого шелушения, высыпания в этой области были представлены множеством полигональных папул на фоне эритематозных пятен, расположенных хаотично, без склонности к слиянию и резких границ. Кожа кистей была инфильтрирована, отмечался выраженный эритематозный компонент. Также присутствовало множество линейных экскориаций с геморрагическими корочками на поверхности (рис. 2).

На лице отмечалось наличие эритематозных бляшек с мокнутием, на коже туловища мелкопластинчатое шелушение, распространенные высыпания, эритематозные пятна.
Проведено лечение: наружно на оча-ги наносился комбинированный крем (ГКС+антиботик+противогрибковое средство)+WWT 2 раза в сутки (утром и на ночь), а днем наносились увлажняющие средства (эмоленты) 3 раза в сутки. Также на область лица после стихания активного воспалительного процесса и уменьшения явлений мокнутия была назначена иммуносупрессивная терапия в виде крема пимекролимус (рис. 3).
Обсуждение
Лечение АтД должно быть начато как можно раньше, чтобы предотвратить внутреннюю и внешнюю потерю воды (которая приводит к ксерозу, трещинам, зуду и боли) и проникновение чужеродных веществ внутрь (что приводит к раздражению и сенсибилизации). Последние данные свидетельствуют о том, что здоровая кожа без повреждений также имеет признаки субклинического воспаления, которые необходимо полностью купировать, чтобы вызвать ремиссию заболевания. Поскольку АтД является хроническим заболеванием, требующим лечения в течение многих лет или даже десятилетий, такое лечение должно быть безопасным и хорошо переносимым.
Заключение
Изменение барьерных функций кожи у детей раннего возраста при АтД связано с увеличением проницаемости эпидермального барьера, характеризуется изменением структуры и состава липидного матрикса рогового слоя, уменьшением концентрации компонентов NMF, что приводит к снижению гидратации кожи и увеличение ТЭПВ. Поэтому крайне важно обеспечить правильный уход и лечение с использованием увлажняющих средств. Использование эмолентов не только необходимо с целью стероидсберегающего эффекта, уменьшения зуда, воспаления, но и направлено на восстановление структуры и защитной функции эпидермального барьера, дисфункция которого влечет за собой формирование различных аллергических реакций (бронхиальная астма, пищевая аллергия, аллергический ринит) в результате чрескожного пути проникновения аллергенов и развития транскутанной сенсибилизации.



