Введение
Синдром хронической тазовой боли (СХТБ) распространен во всем мире. Согласно данным Всемирной организации здравоохранения (ВОЗ), каждый пятый человек на планете страдает хронической болью, обусловленной заболеваниями различных органов и систем. Свыше 60% женщин и 70% мужчин обращаются к узким специалистам в связи с ХТБ [1].
Фармакотерапия болевого синдрома при СХТБ осуществляется с учетом вклада ноцицептивного, невропатического и психогенного компонентов [2]. Среди назначаемых при СХТБ препаратов неизменными всегда остаются нестероидные противовоспалительные средства (НПВС).
Эффективность НПВС при СХТБ объясняется ингибированием внутриклеточного фермента циклооксигеназы (ЦОГ), который участвует в синтезе ряда простагландинов и лейкотриенов, реализующих развитие воспалительной реакции. Вместе с тем препараты данной группы имеют класс-специфические нежелательные побочные эффекты со стороны желудочно-кишечного тракта (ЖКТ), мочевыделительной и сердечно-сосудистой систем (ССС), что делает их назначение небезопасным [3–5].
НПВС метаболизируются ферментами цитохрома Р-450, среди которых наибольшее значение имеет изофермент CYP2C9. При этом установлено, что аллели CYP2C9*2 и CYP2C9*3 ассоциированы с медленной скоростью метаболических реакций. Носительство этих полиморфизмов способствует замедлению биотрансформации НПВС, увеличивает площади под концентрационной кривой при фармакокинетическом анализе и способствует появлению побочных эффектов. Носители быстрых аллелей CYP2C9, напротив, способны элиминировать НПВС в более короткие сроки, что может приводить к снижению их клинической эффективности [6].
Руководство консорциума (CPIC – Clinical Pharmacogenetics Implementation Consortium) для СYP2C9 и НПВС рекомендует алгоритмы назначения НПВС с учетом носительства полиморфных аллелей гена СYP2C9. В руководстве консорциума разработаны рекомендации для каждого типа метаболизма по выбору препарата, его дозы или возможности замены на альтернативный НПВС, не метаболизирующийся изоферментом СYP2C9 [7].
В клинической практике данные рекомендации, несомненно, имеют большое значение, однако не учитывают наличия коморбидной патологии и факторов риска развития побочных эффектов. При стратификации известных факторов риска побочных эффектов вследствие лечения НПВС J.T. Fries выделяет следующие: возраст более 65–70 лет, анамнез язвенной болезни или желудочно-кишечного кровотечения (ЖКК), первые 3 месяца приема НПВС, курение, фоновые кардиоваскулярные или обструктивные заболевания легких с дыхательной недостаточностью, одновременная терапия стероидами или антикоагулянтами, прием более 2 НПВС одновременно [8]. Эти данные согласуются с исследованием Ю.В. Фроловой и
А.Л. Верткина, которые констатировали у пациентов многопрофильного стационара скорой медицинской помощи при применении НПВС и сочетании двух факторов риска побочных эффектов в 55% случаев и трех – в 45% [9].
В Российской Федерации назначение НПВС осуществляется в соответствии с российскими клиническими рекомендациями «Рациональное применение НПВС в клинической практике». Данные рекомендации акцентированы на наличие коморбидной патологии и факторов риска развития побочных эффектов при применении НПВС, но не учитывают вариантов носительства полиморфных аллелей СYP2C9 [10].
Целью настоящего исследования стала разработка алгоритмов персонализированного назначения НПВС больным СХТБ с учетом градации факторов риска, наличия сопутствующей коморбидной патологии и результатов индивидуального фармакогенетического тестирования СYP2C9.
Методы
Научное исследование введено в научно-исследовательский план ФГБОУ ВО «Астраханский ГМУ» Минздрава РФ и одобрено локальным этическим комитетом (протокол № 2, 2017).
Работа выполнена на кафедре нервных болезней ФГБОУ ВО «Астраханский ГМУ» Минздрава РФ на базе неврологического отделения частного учреждения здравоохранения «Медико-санитарная часть» (ЧУЗ МСЧ) Астрахани с 2016 по 2020 г.
В исследованиях больных соблюдались этические принципы, предъявляемые Хельсинкской декларацией Всемирной медицинской ассоциации (1964, 2000). От всех участников было получено добровольное информированное согласие.
Дизайн исследования включил следующие этапы:
- комплексное клинико-неврологическое обследование пациентов с СХТБ (2016);
- набор пациентов в основную группу наблюдения в соответствии с критериями включения и исключения (2016–2017);
- определение полиморфного носительства гена CYP2C9 в основной группе (n=102) (март–август 2017 г);
- формирование подгрупп клинического наблюдения в основной группе в зависимости от носительства наследственно-обусловленных генотипов CYP2C9 (сентябрь 2017 г.);
- разработка алгоритмов персонализированного назначения НПВС в зависимости от носительства наследственно-обусловленных генотипов CYP2C9 и коморбидной патологии в соответствии с российскими клиническими рекомендациями «Рациональное применение НПВС в клинической практике, 2015» и инструкциями Государственного реестра лекарственных средств (сентябрь–декабрь 2017 г.);
- оценка эффективности и безопасности разработанных адресных программ лечения пациентов с ХТБ при помощи клинического мониторинга, изучения качества жизни (КЖ) пациентов и определения концентрации провоспалительных цитокинов (2017–2020).
При этом обязательными критериями включения были наличие добровольного информированного согласия; установленный диагноз СХТБ; наличие побочных эффектов на НПВС в анамнезе; возраст от 18 до 70 лет; наличие приверженности терапии.
Критериями исключения стали наличие декомпенсированных сопутствующих заболеваний, требующих постоянного приема препаратов других групп; ишемическая болезнь легких, стенокардия напряжения III–IV функциональных классов (ФК), прием лекарственных препаратов-субстратов CYP2C9, включая варфарин, прием стероидов, наличие сахарного диабета и метаболического синдрома, наличие инсультов и инфарктов в анамнезе, гипотрофия, кахексия, выраженный астенический синдром, наличие генетических и психических заболеваний, возраст младше 18 и старше 70 лет, отсутствие приверженности терапии, беременность и прием контрацептивных препаратов, наличие индивидуальной гиперчувствительности к НПВС.
Приверженность терапии оценивалась по готовности пациента выполнять все рекомендации лечащего врача. Конфаундеры в исследовании были устранены путем формирования клинических групп, однородных с точки зрения имеющихся переменных.
В исследовании приняли участие 152 пациента с СХТБ, 102 из которых были генотипированы и получали терапию НПВС с учетом носительства полиморфных аллелей гена CYP2C9 и коморбидной патологии. В группу контроля вошли 50 человек, получавших противовоспалительное лечение без учета данных генетического тестирования.
Средний возраст пациентов основной группы составил 49,7±13,43 года. Среди них были 46 (46%) мужчин и 54 (54%) женщины. В контрольную группу вошли 50 пациентов с ХТБ, 23 мужчины и 27 женщин, средний возраст которых составил 45,37±11,4 года. Достоверных отличий по полу, возрасту, наличию сопутствующей патологии в группе наблюдения и группе контроля не было.
Всем пациентам основной группы наблюдения (n=102) проведены оценка интенсивности болевого синдрома, комплексное клинико-инструментальное, лабораторное обследование и фармакогенетическое тестирование гена СYP2C9, по результатам которого разрабатывалась и назначалась персонализированная НПВС-терапия. Разработка данных подходов проведена в соответствии с Российскими клиническими рекомендациями «Рациональное применение НПВС в клинической практике» и в соответствии с инструкциями государственного реестра лекарственных средств [10]. Кроме того, использовался алгоритм назначения НПВС, разработанный А.Е. Каратеевым [11], учитывающий градации факторов риска в зависимости от наличия сопутствующей патологии.
Определение полиморфизма гена CYP2C9 осуществляли методом полимеразной цепной реакции, предварительно выделив ДНК из образцов крови по общепринятым методикам в НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта (Санкт-Петербург). Генотипирование образцов крови было проведено с марта по август 2017 г.
По результатам проведенного генотипирования фенотип *2/n rs1799853 CYP2C9*2 (C43OT) выявлен у 10 пациентов с ХТБ, что соответствует понятию «промежуточный метаболизм» – «Intermediate metabolizer» (IM). Полиморфный медленный аллель rs 1057910 CYP2C9*3 (A1075C) выявлен у 22 пациентов, что интерпретируется как носительство «медленного метаболизма» – «Poor metabolizer» (PM). Поскольку промежуточные метаболизаторы фенотипически являются индивидуумами со сниженной функцией CYP2C9, решено объединить их в одну общую подгруппу – индивидуумов со сниженной функцией. Что в общей выборке исследования (n=102) составило 32 (31,37%) человека. Обычных, нормальных метаболизаторов («Normal metabolizer», NM) с генотипом wt/wt среди пациентов с СХТБ оказалось 68,63%.
Клинические группы сравнения были стратифицированы по носительству аллелей гена СYP2C9. Первая группа из 70 человек – пациенты с ХТБ, носители NM-генотипа CYP2C9. Вторая из 32 человек – пациенты с ХТБ, носители PM-генотипа CYP2C9. В первой и во второй группах назначение НПВС осуществлено с учетом результатов генетического анализа и наличия коморбидной патологии.
В третьей (контрольной) группе назначение НПВС происходило без учета результатов фармакогенетического обследования (n=50).
При анализе анамнестических данных выяснилось, что у пациентов с ХТБ, являющихся NM-метаболизаторами, среди сопутствующей патологии на первое место по частоте встречаемости выходили заболевания ССС – 42,9%. На втором по значимости месте были заболевания ЖКТ – 12,5%. Среди ССС патологии в данной группе больных была гипертоническая болезнь II стадии (20,4%), вторичная артериальная гипертензия – АГ (10%). Ишемическая болезнь сердца, стенокардия напряжения II–III ФК наблюдались у 7,5% больных; фибрилляция предсердий – у 5%.
Согласно российским клиническим рекомендациям по применению НПВС в клинической практике, наибольшей безопасностью в отношении ССС обладает целекоксиб, который практически не влияет на дестабилизацию АГ и не увеличивает риска госпитализаций по поводу хронической сердечной недостаточности [10].
В связи с этим у пациентов с СХТБ, являющихся NM-метаболизаторами CYP2C9 и имеющими, по данным нашего исследования, преимущественную патологию со стороны ССС, сделан выбор в пользу целекоксиба. Пациенты получали целекоксиб в средней терапевтической дозе 200 мг/сут. однократно в течение 10 дней.
В группе больных ХТБ, несущих медленную аллель CYP2C9 наиболее часто, по данным нашего исследования, встречалась патология ЖКТ, среди которой эрозивно-язвенные поражения регистрировались в анамнезе у 24% больных. Патология ССС у PM-носителей по частоте встречаемости значительно уступала патологии ЖКТ и диагностировалась у 12,5% больных преимущественно в виде вторичной АГ. В данной группе пациентов назначали ацеклофенак (Аэртал), не метаболизирующийся изоферментом цитохрома Р-450 CYP2C9. Препарат назначали, согласно инструкции по применению, в дозе 200 мг/сут., разделенной на 2 приема, в течение 10 дней.
Пациенты группы контроля (50 человек), получали НПВС по общепринятым схемам (диклофенака натриевая соль в дозе 75 мг/сут.) в течение 10 дней. Препарат назначали совместно с ингибитором протонной помпы (ИПП) омепразолом в дозе 20 мг утром натощак, за 15 минут до еды.
Помимо НПВС больным проводили современное физиотерапевтическое лечение (интерференцтерапия – 18%, JF-токи – 21%, СМТ-терапия – 6%, магнитофорез с новокаином – 18%, фонофорез с гидрокортизоном – 5%, лазеротерапия 9%, массаж – в 7% случаев). Кроме того, по показаниям назначали миорелаксанты центрального действия – толперизон (Мидокалм), ноотропы и комбинированные витаминные препараты. Частота назначения различных видов физиотерапевтического воздействия и симптоматических средств была сопоставимой во всех группах клинического наблюдения, включая группу контроля.
Для мониторинга эффективности и безопасности лечения, проведения сравнительного анализа персонализированных подходов с традиционными методами в качестве основного критерия оценки эффективности использовали клинический критерий «благоприятного ответа на лечение», под которым подразумевалось уменьшение боли ≥30% от исходного к 7-му дню стационарного лечения. Для комплексной характеристики уменьшения болевой симптоматики использовали индекс интенсивности боли в соответствии с визуально-аналоговой шкалой (ВАШ).
Для оценки безопасности терапии использовали клинический критерий появления любых побочных эффектов со стороны ЖКТ, ССС, системы крови, опорно-двигательного аппарата, мочевыделительной системы, требующих отмены препаратов или коррекции схемы назначения. Для оценки причинно-следственной связи между появлением побочных эффектов и приемом лекарственного препарата использовали шкалу Наранжо.
В качестве дополнительных критериев оценки эффективности и безопасности терапии определяли КЖ о жизни пациентов с ХТБ и динамику концентрации провоспалительных цитокинов на фоне проводимого лечения. Для оценки КЖ пациентов с ХТБ мы применяли краткий опросник ВОЗ (WHOQOL-BREF – World Health Organization’s Quality of Life).
Содержание провоспалительных цитокинов в периферической крови (интерлейкин-1β – ИЛ-1β, -6) в динамике до лечения и на фоне терапии у всех пациентов определяли методом иммуноферментного анализа (ASCENT, Финляндия) с использованием соответствующей панели моноклональных антител (ЗАО «Вектор-Бест», Ростов-на-Дону).
Статистическую обработку результатов осуществляли методами параметрической и непараметрической статистики. Определение соответствия частот генотипов в популяциях равновесию Харди–Вайнберга проводили методом χ2. Для определения средних величин (М) и стандартных отклонений (а) использовалась программа описательной статистики. Достоверность групповых различий для совокупностей, подчиняющихся нормальному распределению, оценивали с помощью Т-критерия Стьюдента. Достоверными считались различия при р<0,05. Для изучения причинно-следственной взаимосвязи между явлениями использовался метод регрессионного анализа с использованием пакета дополнительных статистических программ Excel. Для сравнения частоты встречаемости побочных эффектов в группах сравнения применяли метод Фишера с использованием статистической программы GraphPad.
Результаты исследования
При изучении равновесного распределения частот генотипов CYP2C9 по полиморфным маркерам C43OT и A1075C, согласно уравнению Харди–Вайнберга, установлено, что частоты распределения полиморфных генотипов в общей группе исследования (n=102) распределены равновесно (χ2=0,2445; р=0,6210–р>0,05.
NM-метаболизаторы CYP2C9 при поступлении имели жалобы на интенсивность болевого синдрома, согласно ВАШ, – 7,77±1,09 балла.
К 7-му дню терапии у всех пациентов, являвшихся носителями NM генотипа CYP2C9, наблюдалось уменьшение интенсивности боли более чем на 30%. Разница была статистически достоверной: p<0,05; t=1,98 (5,74±0,65 против 7,77±0,79) (табл. 1).
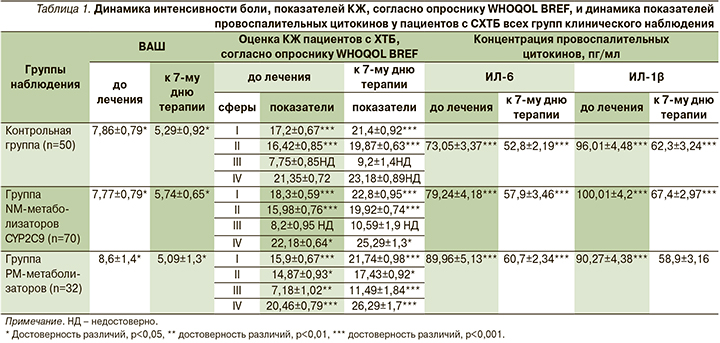
При оценке КЖ пациентов с ХТБ, NM-носителей генотипа CYP2C9, на фоне проведенной терапии целекоксибом установлено, что в численном значении увеличивались все 4 сферы, отражазившие КЖ пациентов. Так, показатели сферы 1 «Физическое и психическое благополучие», включивщей «физическую боль и дискомфорт» (F1); «жизненную активность, энергию и усталость» (F2); «сон и отдых» (F3); сферы 2 «Самовосприятие»; сферы 3 «Микросоциальная поддержка»; сферы 4 «Социальное благополучие» имели статистически достоверное преимущество перед аналогичными до начала терапии – t=4,02; p<0,001 (18,3±0,59 против 22,8±0,95); t=3,71; p<0,001 (15,98±0,76 против 19,92±0,74); t=2,15; p<0,05 (22,18±0,64 против 25,29±1,3). В группе контроля динамика не столь очевидна и касалась всего двух сфер: сферы 1 «Физическое и психическое благополучие» и сферы 2 «Самовосприятие», p<0,001 (17,2±0,67 против 21,4±0,92; 16,42±0,85 против 19,87±0,63). Показатели сфер 3 и 4 имели лишь тенденцию к увеличению без статистически достоверной разницы отличий.
Пациенты с СХТБ – PM-метаболизаторы CYP2C9 при поступлении имели самую высокую в численном отношении оценку боли по ВАШ – 8,6±1,4 против 7,77±0,79, против 7,86±0,79 балла в группе контроля и в группе NM-метаболизаторов. На фоне проводимого лечения ацеклофенаком в группе пациентов с СХТБ – PM метаболизаторов CYP2C9, отмечалось уменьшение интенсивности болевого синдрома более чем на 30%, как и в двух других группах клинического наблюдения: 8,6±1,4 против 5,09±1,3 (t=1,92; p<0,05) (табл. 1).
При оценке КЖ пациентов с ХТБ – PM-метаболизаторов CYP2C9 улучшение показателей также касалось всех четырех сфер. Причем по сравнению с группой контроля и группой пациентов, являвшихся NM-метаболизаторами CYP2C9, динамика показателей КЖ пациентов сферы 3 «Микросоциальная поддержка» и сферы 4 «Социальное благополучие» у PM-метаболизаторов оказалась более выраженной (p<0,01 и p<0,001 соответственно).
В группе контроля на фоне лечения диклофенаком натриевой солью также отмечалось уменьшение боли к 7-му дню стационарного лечения, что в целом согласуется с основными положениями российских клинических рекомендаций «Рациональное применение НПВС в клинической практике» (2015), свидетельствующими о том, что эффективность различных препаратов группы НПВС при их использовании в адекватных дозах (средних и высоких терапевтических) не различается.
Клинический мониторинг безопасности применения целекоксиба NM-метаболизаторами CYP2C9 wt/wt в суточной дозе 200 мг/сут. показал, что число побочных эффектов было значительно меньше, чем в контрольной группе пациентов с СХТБ, получавших диклофенака натриевую соль: 6 (12%) против 20 (40%) (табл. 2).
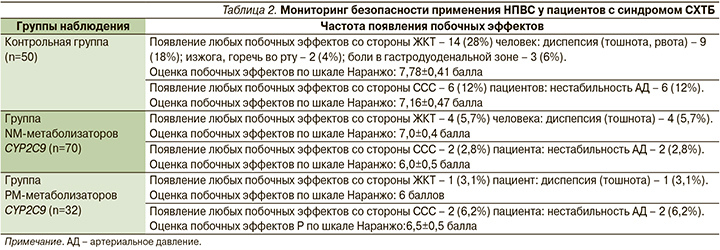
В группе NM-метаболизаторов CYP2C9 на фоне приема целекоксиба отмечено проявление побочных эффектов со стороны ЖКТ в виде диспепсии (тошноты) у 4 (5,7%) человек.
В контрольной группе побочные эффекты со стороны ЖКТ проявились у 14 человек. В структуре побочных эффектов наиболее часто наблюдались диспепсия (18%), изжога, горечь во рту (4%) и боли в гастродуоденальной зоне (6%). Известно, что диспепсия не угрожает жизни больных, но существенно влияет на КЖ и служит основным субъективным критерием переносимости НПВС. Из-за диспепсии более 10% больных прекращают прием назначенных им препаратов [10].
Побочные эффекты со стороны ССС в виде нестабильности АД у пациентов – NM-метаболизаторов CYP2C9 (wt/wt) наблюдались намного реже, чем у пациентов группы контроля: 2 (1,4%; n=70) против 6 (12%; n=50) – метод Фишера (p=0,0659).
В группе контроля побочные эффекты со стороны ССС зарегистрированы у 6 (12%) пациентов. Они проявлялись нестабильностью АД практически все 7 дней лечения диклофенаком натриевой солью, что потребовало увеличения дозы антигипертензивных препаратов в среднем на четверть от назначаемой дозы. После проведенного титрования дозы антигипертензивных препаратов удалось достичь стабилизации состояния.
В группе PM-метаболизаторов CYP2C9 у 1 (3,1%) пациента зарегистрировано появление тошноты, у 2 (6,2%) наблюдалась нестабильность АД. При сравнении с группой контроля частота побочных эффектов со стороны ССС в группе PM-метаболизаторов была 2 (2,8%; n=32) против 6 (12%; n=50) – метод Фишера (p=0,4728). Других побочных эффектов выявлено не было.
Обсуждение
Результаты работы свидетельствуют о том, что клинические алгоритмы назначения НПВС больным СХТБ с учетом сопутствовавшей патологии и результатов генетического тестирования эффективны и наиболее безопасны. По клиническому критерию эффективности во всех трех группах клинического наблюдения отмечено уменьшение интенсивности болевого синдрома более чем на 30% к 7-му дню стационарного лечения.
Более чувствительным оказался краткий опросник КЖ WHOQOL BREF, согласно которому, динамика показателей КЖ во всех группах все же была различной. В двух клинических группах наблюдения, получавших терапию с учетом результатов фармакогенетического тестирования, статистически достоверная положительная динамика касалась всех четырех сфер жизнедеятельности. Следует отметить, что в этих двух группах частота побочных эффектов при применении НПВС-терапии была минимальной. В связи с этим помимо достоверной динамики показателей, связанных с непосредственным переживанием боли (сфера 1 и сфера 2), улучшались показатели микросоциальной поддержки и социального благополучия (сферы 3 и 4). В контрольной группе пациентов, получавших НПВС-терапию без учета результатов фармакогенетического тестирования, динамика показателей, отражавших КЖ пациентов с СХТБ, была не столь выраженной, что, по-видимому, можно объяснить более частым проявлением побочных эффектов на фоне терапии НПВС.
У пациентов контрольной группы (n=50), получавших НПВС-терапию без учета результатов фармакогенетического тестирования, побочные эффекты регистрировались в 40% случаев. Причем 28% были представлены побочными эффектами со стороны ЖКТ и 12% – со стороны ССС. Частота возникновения побочных эффектов в контрольной группе была намного выше, чем в группе NM-метаболизаторов (метод Фишера, p=0,0238) и РМ-метаболизаторов (метод Фишера, p=0,0020).
Конфаундеры в интерпретации результатов исследования заключаются в том, что используемые в работе алгоритмы были предназначены только для пациентов с СХТБ – NM и PM-метаболизаторов CYP2C9, имевших какую-то одну, преимущественную коморбидную, патологию в анамнезе. Данные обстоятельства можно устранить, разработав универсальные алгоритмы персонализированного назначения НПВС, приемлемые для всех генотипов CYP2C9, с учетом градации факторов риска и наличия коморбидной патологии со стороны как ССС, так и со стороны ЖКТ.
В 2020 г. CPIC в своем руководстве для CYP2C9 и НПВС разработал терапевтические рекомендации назначения НПВС в зависимости от носительства генотипов CYP2C9. Терапевтические рекомендации CPIC для НПВС могут быть применены как для краткосрочного, так и для длительного приема препаратов. Наиболее строгие рекомендации адресованы IM и PM-метаболизаторам CYP2C9. Рекомендации касаются как предложений по титрованию дозы назначаемых НПВС, так и выбора – возможности лечения альтернативными препаратами, основная часть которых не метаболизируется CYP2C9 (например, напроксен, сулиндак, ацеклофенак и др.) [7].
В соответствии с рекомендациями CPIC для NM и с учетом широкого терапевтического индекса НПВС снижения дозы не рекомендуется. В то время как для IP и PM предложено начинать терапию с самой низкой начальной дозы, титруя ее до клинического эффекта. FDA (Food and Drug Administration) для целекоксиба и флурбипрофена рекомендует PM-метаболизаторам CYP2C9 снижать начальную дозу на 75–50% с последующим титрованием до клинического эффекта. При этом в клиническом плане наибольшее значение имеет носительство CYP2C9*3, увеличивающее площадь под концентрационной кривой AUC целекоксиба на 60% даже у IM-метаболизаторов, что требует корректировки дозы препарата [7].
В случае носительства CYP2C9*3 и риска желудочно-кишечных осложнений может быть предложен ацеклофенак (Аэртал), на фармакокинетику которого не оказывают существенного влияния генетические варианты CYP2C9 in vivo и/или нет достаточных доказательств для вынесения рекомендации CPIC в настоящее время [7]. При наличии высокого риска ЖКК со стороны ЖКТ начальная доза ацеклофенака может быть уменьшена с последующим титрованием до необходимой.
Разработанные CPIC рекомендации касаются только генотипов CYP2C9 и не учитывают сопутствующей патологии пациентов. Российские клинические рекомендации «Рациональное применение НПВС в клинической практике» (2015, 2018), напротив, учитывают наличие коморбидной патологии и факторов риска их возникновения, но не учитывают результатов фармакогенетического анализа гена CYP2C9, участвующего в метаболизме НПВС.
С учетом регламентирующих правил CPIC, российских клинических рекомендаций «Рациональное применение НПВС в клинической практике» и на основании проведенного собственного исследования нами предложены следующие объединяющие алгоритмы назначения НПВС с учетом носительства генотипов CYP2C9, градации факторов риска побочных эфектов при назначении НПВС [11] и сопутствующей коморбидной патологии (табл. 3–5).

Заключение
СХТБ является часто встречающимся заболеванием во всем мире. Длительный болевой синдром значительно снижает КЖ пациентов. Для облегчения болевой симптоматики к первоочередным препаратам относятся НПВС, которые обладают рядом класс-ассоциированных побочных эффектов, нередко жизнеугрожающих, способствующих проявлению ЖКК или сердечно-сосудистых событий.
В связи с этим наиболее рациональным подходом к назначению максимально эффективной и безопасной НПВС-терапии больным СХТБ является учет всех факторов, влияющих на исходы лечения. При этом методология разработки персонализированных алгоритмов назначения НПВС обязательно должна учитывать фармакогенетические особенности носительства полиморфизмов гена CYP2C9, градацию факторов риска возникновения побочных эффектов и наличие коморбидной патологии.
Источник финансирования. Работа выполнена при финансовой поддержке Гранта Президента РФ для НШ № НШ-2698.2020.7.
Вклад авторов. Р.М. Мамина, Б.И. Кантемирова, В.В. Белопасов – концепция и дизайн исследования. Р.М. Мамина – сбор и обработка материала. Р.М. Мамина, Р.А. Садретдинов – статистическая обработка данных. Р.М. Мамина – написание текста. Б.И. Кантемирова, В.В. Белопасов, Е.А. Орлова – редактирование текста.



