Введение
ХБП остается одним из основных осложнений СД и самой распространенной причиной хронической почечной недостаточности, требующей применения заместительной почечной терапии. Согласно данным Государственного регистра РФ, распространенность диабетической нефропати (ДН) составляет в среднем около 30% у пациентов с СД 2 типа (СД2) [1]. СД увеличивает риск ХБП в 2,6 раза, а риск смерти из-за почечной патологии – в 3 раза [1, 2]. Достижения медицины за прошедшее столетие значительно улу-шили управление СД и тем самым увеличили выживаемость пациентов. Тем не менее нынешние стандарты лечения уменьшают, но не устраняют риск развития диабетической болезни почек и для дальнейших исследований необходимо определить новые стратегии снижения риска диа-бетической болезни почек. В связи с этим активно ведутся работы по изучению новых молекулярных механизмов, участвующих в патогенезе и прогрессировании болезни почек при нарушении углеводного обмена [3, 4].
В настоящее время нефропатию у пациентов с нарушением углеводного обмена активно диагностируют только со стадии альбуминурии. Выявление неселективной протеинурии указывает на грубое повреждение гломерулярного аппарата почек. При этом мало изучены начальные структурные и функциональные нарушения, развивающиеся задолго до появления альбуминурии (АУ), отражающей наличие склероза уже 20–25% нефронов, и протеинурии, сопровождающейся утратой 50–70% клубочков [5]. Кроме того, все большая роль в патогенезе диабетической нефропатии придается тубулоинтерстициальным нарушениям, которые, по данным ряда авторов, предшествуют развитию гломерулярных повреждений [6, 7].
В связи с этим целью нашего исследования стало определение прогностической значимости маркеров повреждений почек на риск появления неселективной протеинурии у пациентов с нарушением углеводного обмена.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование скрининговое кагорное открытое проспективное, состоит из двух этапов. На первом у всех обследованных с нарушением углеводного обмена (n=69) и лиц контрольной группы (здоровые лица первой группы; n=11), проведен детальный сбор клинико-анамнестических данных, а также физикальное и лабораторно-инструментальное обследование, соответствовавшее стандарту. В зависимости от изменений лабораторных показателей пациенты были разделены на группы. В исследование включены пациенты с предиабетом (с нарушением гликемии натощак и нарушением толерантности к глюкозе; n=16), пациенты с СД2 с нормальной СКФ без АУ (n=28), а также пациенты с СД2 с нормальным уровнем СКФ и наличием АУ (n=25).

Критерии исключения из исследования: заболевание почек в анамнезе (ХБП 3–5-й стадий, пиелонефрит, гломерулонефрит, МКБ), гепатит, анемия, онкопатология, неконтролируемая артериальная гипертензия, ХСН НК 2А, Б-3, инфаркт миокарда в анамнезе, острые и приходящие нарушения мозгового кровообращения, выраженная ангиопатия сетчатки глаз, ишемия конечностей, ампутации, сопутствующие заболевания терапевтического профиля (пример – ЯБЖ, панкреатит и т.п.), возраст менее 30 и более 70 лет. Средний возраст пациентов составил 53,2±9,5 лет. Длительность предиабета у пациентов составила 5,3±1,3 месяца, длительность СД2 без патологии почек – 12,3±7,8, в то время как длительность СД2 у пациентов с АУ достигала 20,2±3,8 месяца.
В ходе обследования данных групп производилась оценка антропометрических показателей, анамнестических данных. Исследовали лабораторные показатели крови: общеклинический анализ крови, глюкоза крови, глюкозотолерантный тест, липидограмма, гликированный гемоглобин, АСТ, АЛТ, билирубин, мочевина, креатинин, С-пептид, а также показатели состава мочи: общий анализ мочи, альбуминурия, α-глутатион S-трансфераза (αGSТ), π-глутатион S-трансфераза (πGTS) и матриксная металлопротеиназа-9 (ММП-9) (метод ИФА на системе мультиплексного анализа Luminex MAGPIX (США) с применением стандартных наборов реактивов ALPCO Alpha GST ELISA и Biotrak Cell Proliferation ELISA System (Великобритания). Рассчитывалась скорость клубочковой фильтрации (СКФ; формула CKD-EPI). На втором этапе исследования (через 24 месяца) всем пациентам с СД2 произведен повторный анализ лабораторных показателей крови и мочи, оценена суточная протеинурия.
Статистическую обработку данных проводили с помощью пакета программ Microsoft Office Excel 2010 (Microsoft Corp., США) и STATISTICA 10.0 (StatSoft Inc., США). При нормальном распределении показателей в выборке при сравнении двух независимых выборок использован критерий Стьюдента, а в отличие от нормального – критерии Манна–Уитни и χ2 или тест Левена с определением F. Для оценки статистики связей проведен корреляционный анализ по Спирмену. Для категориальных признаков при анализе связей между признаками применяли критерий Фишера с расчетом χ2. Нулевую статистическую гипотезу об отсутствии различий и связей отвергали при значении р<0,05.

РЕЗУЛЬТАТЫ
Средняя концентрация уровней αGST, πGSТ и ММР-9 в моче у исследуемых пациентов составила 70,61±2,16 нг/мл, 1,68±0,04 и 529,22±23,84 нг/мл соответственно. Нами проведен корреляционный анализ уровня αGSТ мочи с другими маркерами почечного повреждения (табл. 1). Уровень αGSТ повышается по мере роста уровня ММР-9 в моче, альбуминурии, а также креатинина и мочевины крови и снижения СКФ, что свидетельствует о вовлеченности данного фермента в процессы повреждения почечной паренхимы при нарушении углеводного обмена. Отмечается наличие отрицательной корреляционной связи αGSТ с πGTS. Важно отметить, что по мере повышения исходного уровня αGSТ спустя 2 года у таких больных наблюдаются более высокие значения креатинина и протеинурии, а также более низкие значения СКФ.
В ходе оценки результатов корреляционного анализа πGSТ с другими маркерами почечного повреждения показано, что по мере повышения уровня πGSТ происходит снижение уровня ММР-9 в крови, уровня альбуминурии и вероятности обнаружения у обследованного ХБП (табл. 2). При этом отмечается, что через два года наблюдения исходно повышенный уровень πGSТ не оказывал влияния на формирование почечных событий в виде снижения СКФ, роста креатинина крови, появления и прогрессирования неселективной протеинурии, ХБП.
В результате корреляционного анализа ММР-9 с другими факторами почечного повреждения показано, что по мере роста уровня ММР-9 в моче наблюдается повышение концентрации мочевины и креатинина крови, а также снижение СКФ, помимо этого растут уровень альбуминурии и вероятность обнаружения у обследованных ХБП (табл. 3).
В ходе изучения данных двухлетнего динамического наблюдения пациентов нами проанализированы случаи прогрессирования течения СД с развитием неселективной протеинурии. При этом исходно регистрировались небольшие значения АУ (до 300 мг/сут.) или ее отсутствие. На основании полученных данных проведена оценка влияния факторов на риск прогрессироания ХБП у пациентов с нарушением углеводного обмена. Полученные результаты позволили нам также провести оценку взаимосвязи показателей ферментов мочи с факторами риска, в т.ч. с параметрами обмена веществ с точки зрения прогностической значимости развития неселективной протеинурии.
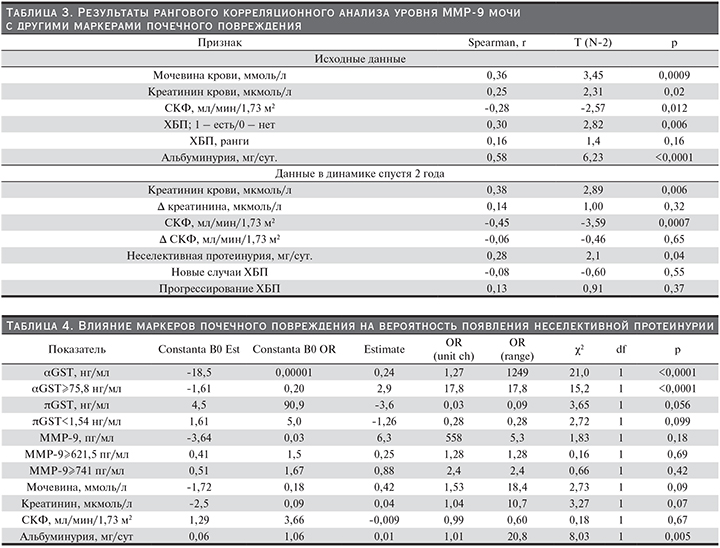
При анализе маркеров почечного повреждения показано влияние на вероятность развития неселективной протеинурии таких показателей, как αGST и АУ (табл. 4). Таким образом, наравне с известным фактором риска развития неселективной протеинурии – АУ, исходное повышение уровня αGST также является фактором риска развития данного симптома.
Из параметров углеводного обмена статистически значимым влиянием на риск появления АУ обладал уровень HbA1c в динамике как следствие низкого качества контроля уровня гликемии и компенсации углеводного обмена в период между исходным и повторным обследованиями пациентов.
При проведении двухфакторного логистического анализа были выявлены пары признаков, сочетание которых показало статистически значимое влияние на риск появления неселективной протеинурии (табл. 5).
Так, было показано, что факт курения и высокий уровень αGST повышают риск развития неселективной протеинурии, что позволяет в последующем составлять прогнозную таблицу риска развития ДН.
Влияние высоких значений αGST исходно и HbA1c в динамике на риск развития неселективной протеинурии также статистически значимо и может позволить осуществлять прогноз в реальной клинической практике.
Отмечено, что у лиц женского пола повышение уровня αGST в моче сопровождается более высоким, чем у лиц мужского пола, риском развития неселективной протеинурии в дальнейшем, что также представлено в табл. 3.
У пациентов, не имевших неселективной протеинурии на первом этапе исследования, повышение исходного уровня АУ сопровождается повышением риска ее развития в дальнейшем, при этом более высокие значения αGST, разделенные по медиане (75,8 нг/мл), дополнительно статистически значимо повышают этот риск.
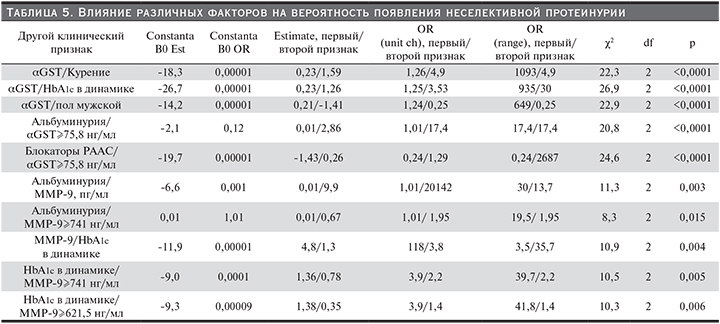
Интересна следующая находка: несмотря на отсутствие значимого влияния приема пациентами блокаторов ренин-ангиотензин-альдостероновой системы (РААС) как отдельного фактора на риск развития неселективной протеинурии, в случае учета значения αGST это влияние оказывается статистически значимым.
Уровень ММР-9 самостоятельного прогностического значения в отношении почечных конечных точек в моче не продемонстрировал, однако включение в анализ других факторов показало наличие такого влияния – по мере повышения исходного уровня АУ и ММР-9 происходит статисти-чески значимое повышение риска развития неселективной протеинурии. Таким образом, обнаружение высоких значений АУ и ММР-9 является содружественным фактором – предиктором риска развития неселективной протеинурии.
Статистическая значимость содружественного влияния ММР-9 и уровня АУ на дальнейшее развитие неселективной протеинурии было продемонстрировано и в случае, если учитывалось не количественное значение ММР-9, а его ранг, сформированный по верхней границе референсных значений этого показателя (741 нг/мл).
Также важно отметить, что ММР-9 имеет прогностическое значение и в случае учета уровня HbA1c в динамике, т.е. повышение ММР-9 в случае субкомпенсированного или декомпенсированного течения СД статистически значимо дополнительно повышало риск развития неселективной протеинурии.
ОБСУЖДЕНИЕ
Проведенное исследование позволило сравнить информативность и определить значимость традиционных методов прогнозирования неселективной протеинурии с предложенными нами маркерами.
В результате исследования отмечается хорошая информативность оценки прогностической значимости исходной АУ. Тем не менее, несмотря на имеющиеся данные литературы, о том, что МАУ значительно увеличивает относительный риск развития ДН, точность диагностики АУ в прогнозировании прогрессирования протеинурии у пациентов с нарушением углеводного обмена и развитии ДН окончательно неясна [8].
В связи с этим ценными оказались полученные данные о повышении чувствительности и специфичности методов оценки прогноза развития неселективной протеинурии при комбинации с оценкой уровня цитозольных ферментов.
Так, повышение исходного уровня АУ сопровождается повышением риска развития протеинурии в дальнейшем, при этом более высокие значения αGST дополнительно статистически значимо повышают этот риск.
Отмечается влияние высоких значений αGST и недостижение целевых значений HbA1c в динамике на риск развития неселективной протеинурии. Кроме того, высокий уровень αGST в сочетании с фактором курения повышают риск развития неселективной протеинурии и может позволить осуществлять прогноз в реальной клинической практике.
Оценка ММР-9 в сочетании с другими факторами также обладала высокой информативностью в прогнозировании риска развития неселективной протеинурии, однако следует отметить, что только сочетание αGST с ММР-9 и АУ позволило при высокой специфичности, равной 80%, добиться повы-шения чувствительности методики до 85%.
Данные, полученные в ходе нашего исследования, позволяют составить прогнозные таблицы риска развития неселективной протеинурии в зависимости от факторов, показавших наиболее статистически значимые результаты.
Прогнозирование почечной функции у больных с нарушением углеводного обмена и определение нефропротективной стратегии делают возможным дальнейшую разработку рекомендаций медикаментозного лечения при развитии данной патологии.



