Дефицит железа является основным и наиболее распространенным нарушением питания в мире, от которого страдают многие дети и женщины как в развивающихся, так и в промышленно развитых странах. Как отмечают эксперты Всемирной организации здравоохранении (ВОЗ), дефицит железа имеет место у большего числа людей, чем какое-либо другое нарушение здоровья, представляющее собой проблему общественного здравоохранения, соизмеримую с эпидемией. Уровни его распространенности поражают: 2 млрд человек, т.е. более 30% населения мира, страдают от анемии, связанной с дефицитом железа (ЖДА – железодефицитная анемия) [1]. Менее заметный в своих проявлениях, чем, к примеру, белково-энергетическая недостаточность, дефицит железа носит скрытый, но разрушительный характер, незаметно ослабляя потенциальные возможности для развития людей, общества и национальной экономики.
Заболеваемость анемией как проблема общественного здравоохранения классифицируется ВОЗ следующим образом: <5% болеющих – нет проблем общественного здравоохранения; 5–19,9% – низкая проблема; 20–39,9% – умеренная; ≥40% – серьезная (см. таблицу) [2].
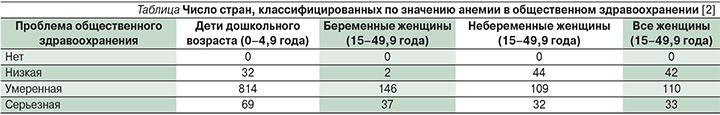
По данным ВОЗ, частота ЖДА у беременных в мире колеблется от 5,7 до 75%: 35–75% – в развивающихся и 18–20% – в развитых странах. Наиболее неблагоприятные в отношении распространенности анемии у беременных – это регионы Африки, Азии, Латинской Америки с Карибскими островами и Океании. Однако и в относительно благополучных регионах, таких как Западная Европа, анемия встречается почти у каждой пятой (18,7%) беременной [3]. В Российской Федерации 23–42% беременных страдают ЖДА разной степени тяжести (см. рисунок) [4].
В 2015 г., по данным Минздрава РФ, распространенность анемии составила в среднем 32,6% (к числу закончивших беременность). При этом в 18 регионах она встречалась более чем у 40% беременных (максимально – в Чеченской Республике – 65,2%), среди женщин, обслуживаемых Главным медицинским управлением делами Президента РФ, – у 40,9%. За 10-летний период (2005–2015) частота анемии у беременных женщин уменьшилась лишь на 8,1% (максимально – в Республике Алтай [в 2,2 раза]). В 4 регионах РФ распространенность анемии беременных возросла (Республика Коми, Калининградская область, Республика Тыва и Чукотский АО) [4].
На фоне анемии нарушается перенос и депонирование кислорода, что затрудняет обеспечение жизненно важной функции (дыхания) и ведет к метаболическому дисбалансу. Средние оценки смертности от анемии, вызванной всеми причинами, как прямыми, так и косвенными, составляют от 3 до 7,26% в развивающихся странах. Относительный риск смертности при умеренной анемии составляет 1,35 (95% доверительный интервал [ДИ] – 0,92–2,00) и при тяжелой – 3,51 (95% ДИ – 2,05–6,00) [5]. Коэффициент шансов материнской смертности уменьшается на 25% и составляет 0,75 (95% ДИ – 0,65–0,87) при увеличении уровня гемоглобина (Hb) на 1 г/дл в конце беременности [6].

По данным мета-анализа 2016 г. определены значительно более высокие риски для новорожденных, чьи матери имеют анемию. Так, относительный риск преждевременных родов составляет 1,63 (95% ДИ – 1,33–2,01), низкой массы при рождении – 1,31 (95% ДИ – 1,13–1,51), перинатальной смертности – 1,51 (95% ДИ – 1,30–1,76) и неонатальной смертности – 2,72 (95% ДИ – 1,19–6,25) [7].
При ЖДА у матери частота анемии у детей в возрасте 1 года достигает 68%, что неблагоприятно отражается на их умственном и моторном развитии, снижает сопротивляемость организма к инфекциям, увеличивает смертность [8]. В то же время показано, что легкая и средняя анемия и истощение запасов железа, выявленные в ранние сроки беременности и сопровождавшиеся добавлением железа, не приводят к осложнениям гестации [9–10].
В связи с высокой частотой и тяжестью осложнений ЖДА ВОЗ рекомендует рутинно назначать 60 мг железа и 400 мг фолиевой кислоты ежедневно с 12-й недели беременности и до срока родов. При наличии анемии дозу железа увеличивают в 2 раза [3].
В некоторых странах разработаны программы профилактики анемии во время беременности, основанные на еженедельном приеме железа (60 мг) и фолиевой кислоты (2,8 мг) по 3 месяца с полугодовым интервалом женщинами репродуктивного возраста, имеющими сохраненный меструальный цикл; ежедневном приеме железа и фолиевой кислоты (30 мг и 0,4 мг) с ранних сроков беременности в регионах, где анемия не является распространенной проблемой, и ежедневном приеме 60 мг железа и 0,4 мг фолиевой кислоты там, где ЖДА встречается часто. В завершение программы рекомендуется продолжение приема препарата в течение 6 месяцев после родов [11].
В большинстве случаев развитие ЖДА у беременных обусловлено увеличением потребности в железе. В I триместре ежедневные потребности уменьшаются из-за отсутствия менструации, тем самым экономя около 0,56 мг железа в сутки или 160 мг в течение беременности. Во II триместре объем крови увеличивается на 45% при увеличении объема плазмы на 50%, масса эритроцитов повышается на 35%, что обусловливает потребность в 450 мг железа у женщины с массой тела 55 кг. Фетальные потребности в железе максимальны в течение III триместра, и они оцениваются примерно в 270 мг у плода массой 3 кг. Следовательно, во время беременности женщине требуется около 2–2,8 мг железа в сутки, но ей нужно потреблять железа гораздо больше, чтобы получить это необходимое количество (от 20 до 48 мг) [12].
В течение беременности при нормальном питании женщина получает с пищей около 700–800 мг железа. Следовательно, еще необходимо использовать 400–500 мг железа, которые расходуются из депо. В связи с этим даже незначительный латентный дефицит железа, предшествовавший наступлению беременности, представляет опасность быстрого истощения депо и развития осложнений. Поскольку требования достаточного поступления в организм железа трудно выполнить при помощи обычного рациона питания (максимальное количество железа, которое может всосаться из пищи, составляет 2,5 мг/сут), рутинные добавки препаратов железа во время беременности необходимы [12].
Обычно при постановке диагноза анемии у беременных опираются на рекомендованную ВОЗ нижнюю границу уровня Hb в 110 г/л. Однако число женщин с низким резервом железа (уровень сывороточного ферритина менее 12 мкг/л) с 15-й до 24-й недели беременности увеличивается в 6 раз и продолжает возрастать к родам. При этом у подавляющего большинства (90%) женщин уровень Hb выше 110 г/л, что определяет недооценку железодефицитного состояния [13].
C учетом длительности цикла эритропоэза для обеспечения стабильно нормального уровня Hb при лечении ЖДА во время беременности необходим продолжительный прием препаратов, который условно делится на 3 этапа: купирование анемии (восстановление нормального уровня Hb), терапию насыщения (восстановление запасов железа в организме), поддерживающую терапию малыми дозами для сохранения нормального уровня фондов железа. Кроме того, следует учитывать, что находящееся в пище железо усваивается только на 10–20%, поэтому необходимо увеличение количества поступающего в организм железа в 5–10 раз, чтобы обеспечить суточную потребность [14].
При лечении ЖДА необходимо назначение сбалансированной диеты, в которой в оптимальных сочетаниях и достаточном количестве содержатся необходимые пищевые ингредиенты, в т.ч. железо и белок. При установлении причины ЖДА лечение должно быть направлено на ее устранение (коррекция алиментарной недостаточности, лечение гиповитаминоза С, заболеваний желудочно-кишечного тракта [ЖКТ] и др.) [15].
Патогенетическое лечение анемии и восполнение запасов железа проводятся при помощи препаратов, его содержащих. Американская коллегия акушеров и гинекологов рекомендует для лечения анемии препараты железа в дозе, соответствующей 200 мг/сут элементарного железа [16]. Парентеральный путь не имеет преимуществ усвоения и показан при нарушении всасывания в ЖКТ или необходимости срочного насыщения организма железом (тяжелая форма анемии, прогрессирующие нарушения, предстоящая кровопотеря) [17].
Расчет суточной и курсовой доз препарата осуществляется с учетом степени тяжести анемии, висцеральных поражений, уровня сывороточного железа и осуществляется в зависимости от запаса железа в депо по уровню сывороточного ферритина (SF) 1 мкг/л SF=8 мг железа. Нормальное содержание ферритина у здоровых женщин составляет 32–60 мкг/л, что соответствует 356–480 мг железа в депо. При уровне ферритина свыше 60 мкг/л прием препаратов железа не показан. Границей, определяющей явный дефицит железа, служит уровень ферритина менее 12 мкг/л. В то же время многие исследователи критически низким уровнем или даже отсутствием запаса железа у беременных считают его содержание менее 20–30 мкг/л [18]. При таком подходе число женщин, которым показан прием препаратов железа при подготовке и на протяжении беременности, возрастает.
Однако на практике эти рекомендации соблюдаются далеко не всегда. Так, в статье Э.Г. Арчеговой и соавт. приводятся результаты фармакоэпидемиологического исследования реальной практики профилактики и лечения ЖДА у беременных в медицинских организациях Республики Северная Осетия (Алания). Выявлены несоответствия врачебных назначений действующим клиническим рекомендациям. Согласно полученным данным, лечение ЖДА не получали 56,7% беременных в условиях стационара и 16,8% беременных при амбулаторном наблюдении, более чем 70% женщин не проводилась профилактика анемии. Врачи назначали препараты железа, противопоказанные в период беременности, использовали нерациональные комбинации указанных средств, не соблюдали рекомендации по продолжительности терапии, нарушали рекомендованный режим дозирования [19].
Препараты для лечения ЖДА могут быть отнесены в одну из двух групп: двухвалентного или трехвалентного железа. Первыми появились препараты в виде солей двухвалентного железа: сульфата, фумарата, глюконата, хлорида железа. Широкая распространенность препаратов на основе солей двухвалентного железа обусловлена в первую очередь высокой степенью растворимости и диссоциации, что и определяет хорошее всасывание в кишечнике. Вместе с тем пероральный прием железосодержащих препаратов нередко сопровождается побочными эффектами. Наиболее распространенными из них являются металлический привкус во рту, тошнота, рвота, боли в животе, запор или диарея. Реже встречаются такие побочные эффекты, как гипотензия и геморрой [20]. Обычно эти побочные эффекты зависят от дозы и проявляются при приеме натощак. Кроме того, обнаружено, что применение солевых препаратов двухвалентного железа, особенно с профилактической целью (перорально), сопровождается нарастающим оксидативным стрессом [21, 22].
В попытке избежать побочных эффектов предлагаются альтернативные режимы приема, в т.ч. прерывистые или низкодозированные, но они более эффективны как превентивные, а не лечебные схемы [23, 24].
Так как одной из главных причин плохой переносимости препаратов железа служат свободные ионы, входящие в их состав и освобождающиеся при всасывании простой соли в ЖКТ, в последние годы все большее распространение получают неионные препараты железа – трехвалентное железо в соединении с веществом большой молекулярной массы. К таким препаратам относится железа гидроксид полимальтозат (ЖГП). В связи с большой молекулярной массой гидроксид полимальтозат диффундирует через слизистую оболочку ЖКТ в 40 раз медленнее, чем двухвалентное железо, которое проникает по градиенту концентрации. Структура комплекса подобна таковой у естественного соединения железа (ферритина) и абсорбируется только путем активного всасывания (преимущественно в двенадцатиперстной и тощей кишке). Механизм активного всасывания не допускает передозировки или интоксикации препаратом. Комплекс ЖГП стабилен, в физиологических условиях не высвобождает ионы железа и не обладает прооксидантными свойствами, присущими солям железа-II. Этими качествами объясняются меньшая частота побочных эффектов и более высокий уровень приемлемости препаратов на его основе [9].
В ряде сравнительных исследований препаратов железа-II и -III показаны преимущества последнего по отношению к частоте побочных эффектов. Так, среди детей от 1 до 6 лет A.V. Bopche и соавт. выявили побочные эффекты у 17% против 7,6% соответственно [25], B. Yasa и соавт. обнаружили их двукратное превышение в группе, использовавших железо-II [26]. Аналогичные результаты получены J.E. Toblli и соавт. (34,1 против 14,9% соответственно; p <0,0001) [27]. В результате приемлемость ЖГП по шкале Wong–Baker достоверно лучше (1,63±0,56 против 2,14±0,75; p=0,001).
Фармакоэкономическая эффективность была рассчитана в работе С. Kambar и соавт., которые показали, что начальная меньшая стоимость железа-II по сравнению с -III нивелируется в последующем за счет необходимости использования лекарственных средств для купирования побочных эффектов, и в конечном итоге разница не была статистически значимой [28]. Снижение частоты побочных эффектов улучшает приверженность лечению (соблюдение пациентами режима приема препарата) и обеспечивает регулярное лечение. В результате, несмотря на бóльшую стоимость, лечение ЖГП экономически оправданно, особенно при сопутствующей патологии ЖКТ.
Исследование эффективности пероральной формы ЖГП (200–300 мг/сут) в лечении ЖДА у беременных показало, что первые признаки коррекции анемии появляются уже в конце первой недели лечения. В первую очередь это отмечено у женщин с легкой степенью анемии, у которых в 15% случаев был достигнут нормальный уровень Hb [29]. Через две недели показатели Hb нормализовались у 39,4% женщин. Через 28 дней только у 9,1% сохранились признаки анемии.
Профилактическое применение 100 мг ЖГП в группе риска позволяет предупредить развитие ЖДА у 87% женщин. Эффективная профилактика и лечение сочетаются с благоприятными клиническими результатами: быстрой динамикой разрешения клинических проявлений, меньшей частотой фетоплацентарной недостаточности и преэклампсии.
В исследовании В.А. Бурлева и соавт. показано, что прием 100 мг ЖГП беременными с латентным дефицитом железа позволяет поддерживать необходимые уровни сывороточного железа, ферритина в отсутствие изменений содержания трансферрина и коэффициента насыщения трансферрина железом. Прием 200–300 мг железа при ЖДА позволяет достоверно повысить уровни этих показателей [30].
В 2011 г. получены результаты многоцентрового рандомизированного контролируемого исследования эффективности и безопасности полимальтозного комплекса и сульфата железа у беременных с ЖДА [31]. Результаты показали, что после приема эквивалентных доз препаратов железа (III и II) прирост показателей Hb на 60-й и 90-й дни лечения был одинаковыми, тогда как концентрация ферритина оказалась выше в группе женщин, принимавших полимальтозат железа. Приверженность лечению (по числу возвращенных упаковок препаратов) была достоверно хуже в группе женщин, принимавших сульфат железа (1,53 против 2,97; р=0,015). Наконец частота побочных эффектов также оказалась достоверно выше при лечении солью двухвалентного железа (29,3 против 56,4%; р=0,015). Также более высокую переносимость, лучшую абсорбцию и предсказуемость гематологического ответа показал ЖГП по сравнению с фумаратом, аминохелатом, сукцинатом и глюконатом железа [32–34].
Таким образом, при одинаковой клинико-лабораторной эффективности препаратов с солями железа-II препараты ЖГП показывают более высокую степень переносимости, что в отсутствие риска передозировки и необходимости соблюдения режима приема препарата натощак повышает степень приверженности лечению и расширяет возможности применения для профилактики и лечения железодефицитных состояний у беременных.
Эффективность лечения контролируется по уровню трансферрина и ферритина сыворотки крови. Для восполнения запасов железа пероральный прием препаратов следует продолжать в течение 3 месяцев после коррекции анемии.
Медикаментозная профилактика ЖДА во время беременности, согласно рекомендациям ВОЗ, заключается в назначении 60 мг/сут элементарного железа не позднее начала II триместра беременности [3]. К группам высокого риска по развитию анемии беременных относятся пациентки с анемией в анамнезе; меноррагией в анамнезе; многорожавшие; женщины с экстрагенитальной патологией, хроническими инфекционными заболеваниями; беременные с уровнем Hb в I триместре <120 г/л; беременные с многоплодием; беременные с ранним токсикозом, преэклампсией [35]. В развивающихся странах, где частота ЖДА может достигать 80%, распространена рутинная профилактика, т.к. традиционная диета не обеспечивает женщинам достаточного количества железа, а некоторые инфекционные заболевания увеличивают риск железодефицита. В развитых странах предпочтение отдается селективной профилактике: индивидуальный подход основан на рациональном назначении железозаместительной терапии в зависимости от результатов лабораторных анализов, свидетельствующих о наличии железодефицита [36]. Однако и в развитых странах может использоваться рутинное назначение железа: так, Американская коллегия акушеров и гинекологов рекомендует 30 мг/сут элементарного железа всем беременным на протяжении II–III триместров, а Центры по контролю и профилактике заболеваний США и Американская ассоциация диетологов рекомендуют принимать 30–60 мг/сут элементарного железа всем беременным с момента первого обращения по беременности [37].
В настоящее время, согласно рекомендациям ВОЗ, во всех регионах в течение 6 месяцев (II и III триместры) беременная должна получать стандартный комплекс, состоящий из железа (60 мг) и фолиевой кислоты (400 мкг) [1, 3].
Согласно приказу Минздрава РФ «Об утверждении Порядка оказания медицинской помощи по профилю “акушерство и гинекология” (за исключением использования вспомогательных репродуктивных технологий)» № 572н от 01.11/2012, ведение беременных с анемией на амбулаторном этапе включает клинический анализ крови с лейкоцитарной формулой, подсчетом ретикулоцитов и тромбоцитов 1 раз в месяц; биохимический анализ крови (общий белок, сывороточное железо, ферритин, трансферрин, билирубин общий и прямой); другие исследования по назначению врача-терапевта. Ведение на стационарном этапе обследования и лечения включает назначение диеты, богатой белками, железом, витаминами и фолатами; препаратов, содержащих железо; лечение основного и сопутствующих заболеваний; выполнение спектра исследований для постановки диагноза ЖДА; консультации специалистов: врача-трансфузиолога (при снижении уровня Hb до 70 г/л и ниже) [38].
Таким образом, ЖДА является одновременно и медицинской, и социальной проблемой. Ее решение требует привлечения врачей различных специальностей, организаторов здравоохранения, научных работников. Широкая распространенность дефицита железа, особенно среди беременных женщин, тяжелые и часто необратимые последствия анемии для новорожденных и детей раннего возраста требуют более пристального внимания к данной проблеме на государственном уровне.



