Вцелом опухоли головного мозга (ОГМ) обусловливают 1–6 % случаев эпилепсии [1]. Примерно у 25 % пациентов с первичными и вторичными ОГМ заболевание проявляется впервые эпилептическими приступами [2]. Если опухоль не манифестирует приступами, в дальнейшем развитие эпилептических припадков отмечается у 20 % пациентов.
Частота эпилепсии при первичных ОГМ зависит от гистологических особенностей опухоли, скорости роста и локализации. При медленнорастущих ОГМ с неинвазивным ростом приступы отмечаются намного чаще, чем при опухолях с быстрым инфильтративным ростом. Механизмы эпилептогенеза у пациентов с ОГМ включают нарушение васкуляризации окружающей коры, морфологические изменения в нейронах, расстройства синаптических возбуждающих и тормозных влияний [3]. Эпилептические приступы наблюдаются в целом примерно у 50 % пациентов с супратенториальными опухолями [4]. Наибольшая частота эпилепсии имеет место при локализации ОГМ в центрально-височно-теменной области. Приступы встречаются при поверхностной и кортикальной локализации опухоли чаще, чем при глубоких некортикальных поражениях.
Приступы значительно снижают качество жизни пациента, приводят к травматизации, ограничивают свободу передвижения. Эпилептические припадки при ОГМ можно рассматривать, с одной стороны, как острые симптоматические приступы [5], т. к. их причина может быть устранимой, с другой – они могут быть проявлением симптоматической парциальной эпилепсии [1], требующей назначения терапии антиэпилептическими препаратами (АЭП).
Так как вероятность возникновения эпилептических приступов у пациентов с ОГМ достигает 50 % [2], в клинической практике часто ставится вопрос о назначении профилактической терапии АЭП. Однако данные об эффективности хронического назначения АЭП недостаточно систематизированы.
Наиболее типичными ситуациями, встречающимися в нейроонкологии, являются:
- ведение пациента без припадков до и после оперативного вмешательства;
- послеоперационное ведение пациента, которому АЭП были назначены до удаления опухоли;
- пациенты без приступов, не получающие АЭП, которым оперативное лечение не планируется;
- пациенты с текущими приступами.
По данным широкого опроса практикующих специалистов, в отношении первых двух сценариев единого подхода нет, в отношении третьего – большинство врачей склонны воздерживаться от назначения АЭП [6]. Нет сомнений в том, что последнюю группу пациентов следует лечить как больных симптоматической парциальной эпилепсией. Однако при этом при выборе АЭП необходимо особенно тщательно взвешивать его возможные нежелательные эффекты и лекарственные взаимодействия, с учетом того что большинство пациентов со злокачественными опухолями будут получать цитостатическую химио- и/или лучевую терапию.
1. Антиэпилептическая терапия в послеоперационном периоде
В послеоперационном периоде почти во всех клиниках традиционно проводится терапия АЭП. Однако единого мнения по поводу ее продолжительности и выбора препарата нет. После оперативного лечения ОГМ нередко встает также вопрос о необходимости продолжения лечения пациентов, у которых до операции отмечались приступы, по поводу которых они уже получают АЭП.
Было показано, что риск развития припадков и эпилепсии после краниотомии аналогичен таковому при травматическом повреждении ГМ, зависит от локализации и степени повреждения коры. При супратенториальных вмешательствах риск развития послеоперационных приступов в ближайшие 5 лет составляет около 17 % [7].
В 37 % случаев они отмечаются в течение первой недели после операции, у 77 % пациентов – в течение первого года, у 92 % – в течение первых 2 лет после вмешательства. Повторные приступы отмечены у 41 % больных. Одиночные приступы чаще наблюдаются при раннем развитии приступов.
Доказательных исследований по поводу эффективности профилактического применения АЭП после нейрохирургических вмешательств немного. Большинство исследований были ретроспективными, на небольших выборках, и их дизайн не позволял оценивать профилактическую эффективность АЭП. В одном из ретроспективных исследований, включившем 100 пациентов, 67 из которых профилактически получали фенитоин (PHT), а остальные 33 АЭП не получали, достоверных различий между группами на протяжении года выявлено не было [8, 9]. Проспективное исследование 276 пациентов с супратенториальными вмешательствами с последующим наблюдением в течение 3–8 лет показало, что профилактическое лечение PHT или карбамазепином (CBZ) в течение 6–24 месяцев (102 больных) не влияло на риск развития приступов [10]. Однако в более раннем исследовании [11] когорты из 281 пациента после супратенториального вмешательства, 141 из которых получал плацебо, а 140 – PHT, было показано, что приступы в раннем послеоперационном периоде при применении PHT отмечались реже, что также подтверждается результатами исследования S.T. Lee и соавт. [12]. Недавно был проведен мета-анализ эффективности послеоперационной профилактики приступов при использовании АЭП [13], который показал эффективность PHT в плане предотвращения ранних приступов, т. е. возникших в первые 7 дней после вмешательства, но эффективность PTH и CBZ в отношении поздних неспровоцированных приступов не была продемонстрирована. Аналогичные данные получены и в более позднем мета-анализе [6]. Таким образом, результаты профилактического назначения АЭП после нейрохирургических вмешательств идентичны таковым при черепно-мозговой травме. В настоящее время рекомендуется использование АЭП в течение 4 недель после супратенториальных вмешательств с последующей постепенной отменой, если не возникают спонтанные приступы [14].
В отношении выбора препарата также не выработано единого мнения. Во многих нейрохирургических клиниках для профилактики приступов в раннем послеоперационном периоде используют барбитураты, PHT и CBZ. Однако при выборе препарата необходимо учитывать следующее обстоятельство: пациенту может потребоваться длительный прием АЭП. Поэтому следует учитывать возможные его взаимодействия с последующим противоопухолевым лечением (лучевая терапия, химиотерапия).

В последние годы было показано, что при проведении краниальной лучевой терапии применение PHT, в меньшей степени – CBZ и фенобарбитала (PB) связано с повышенным риском тяжелой, потенциально фатальной кожной реакции (включая синдром Стивенса–Джонсона и буллезную мультиформную эритему). Описан синдром EMPACT (Erythema Multiforme associated with Phenytoin And Cranial radiation Therapy – мультиформная эритема, связанная с фенитоином и краниальным облучением) [15–19].
Весьма привлекательным с точки зрения профиля безопасности представляется АЭП леветирацетам (LEV), внутривенное введение которого в дозе 3000 мг/сут в открытом исследовании принесло обнадеживающие результаты: избежать приступов в раннем послеоперационном периоде удалось 84 % пациентов, а нежелательных эффектов отмечено не было [20]. Другим препаратом профилактики ранних послеоперационных пароксизмов с возможностью внутривенного введения является вальпроевая кислота (VPA). Кроме удобной лекарственной формы и отсутствия фатальных осложнений при сочетании с противоопухолевым лечением применение VPA делает привлекательным его потенциальная способность потенцировать клиническую активность гамма-излучения и темозоломида [21].
Среди пациентов, у которых эпилептические припадки отмечались до хирургического вмешательства, после операции приступы купируются в 83 % случаев [22]. Результат, как правило, зависит от типа опухоли, возможности ее удаления и функциональных связей фокуса [22–24]. Так, при астроцитомах приступы прекращаются в 70 % случаев [4], а при ганглиоглиомах – в 90 % [4, 25]. В связи с этим терапия АЭП в послеоперационном периоде, как правило, имеет краткосрочный характер.
2. Лечение неспровоцированных эпилептических приступов
При развитии неспровоцированных приступов в отдаленные сроки после удаления ОМГ и у пациентов, которым оперативное лечение не проводилось, АЭП назначаются в соответствии с общими принципами лечения симптоматических парциальных эпилепсий.
2.1. Общие принципы лечения симптоматических парциальных эпилепсий
При подборе АЭП учитывают не только его терапевтическую активность, но и профиль безопасности, а также особенности фармакокинетики [26–28].
До 1960-х гг. в лечении парциальных эпилепсий использовались барбитураты (фенобарбитал, бензобарбитал, примидон) и фенитоин. С 1960-х гг.
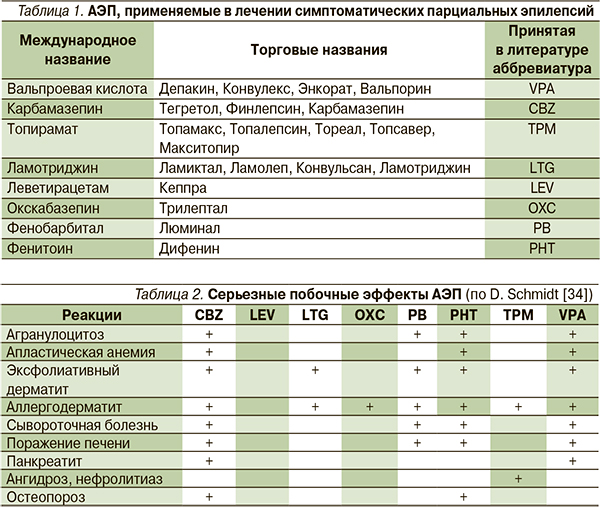
начинают использовать карбамазепин и препараты вальпроевой кислоты, а в 1980–1990-е гг. появляется сразу 9 новых АЭП (фелбамат, габапентин, ламотриджин, топирамат, тиагабин, вигабатрин, окскарбазепин, леветирацетам, зонизамид). В статье рассмотрены только зарегистрированные в РФ оригинальные АЭП, эффективные при криптогенных и симптоматических парциальных эпилепсиях (табл. 1).
2.1.1. Эффективность и переносимость АЭП
Эффективность VPA и CBZ оценивалась в сравнительных исследованиях как между собой, так и с барбитуратами, а также с PHT. Так, в исследовании М.de Silva и соавт. [29] эффективность этих препаратов при парциальных формах эпилепсии оказалась одинаковой, но переносимость была лучше у CBZ и VPA. Инструментом для сравнения новых препаратов часто служит метод мета-анализа, позволяющий после математической обработки результатов отдельных двойных слепых исследований сравнивать препараты по уровню ответа на терапию и частоте отмены. Уровень ответа отражает эффективность препарата, частота отмены — его переносимость. Существует взаимосвязь между эффективностью и переносимостью препарата: обычно, чем выше его эффективность препарата, тем более выражены побочные явления. Исключение составляет LEV, сочетающий высокую эффективность с неплохой переносимостью.
2.1.2. Тактика терапии
Лечение начинается с монотерапии. Согласно M. Brodie (2005), в Глазго за 20 лет из 780 пациентов с впервые диагностированной эпилепсией 56,1 % достигли ремиссии на первом или втором АЭП; приблизительно у 10 % был хороший начальный ответ на лечение, но потом развилась резистентность и у 35,4 % больных ремиссия никогда не была достигнута [30]. Таким образом, пациентов можно было разделить на поддающихся лечению и рефрактерных к АЭП уже при применении первых двух препаратов вне зависимости от того, какие лекарственные средства были назначены. Выбор АЭП для первой монотерапии симптоматической эпилепсии может определяться оценками возможных эффективности и риска побочных явлений конкретного препарата, скоростью достижения терапевтической дозы, экономическими соображениями. Так, например, скорость достижения терапевтической дозы для VPA, LEV, OXC достаточно высока, а при применении CBZ для снижения риска дозозависимых побочных явлений со стороны ЦНС рекомендуется титровать дозу от стартовой до терапевтической в течение нескольких недель. При титрации TPM и LTG необходимо строго следовать инструкциям по их применению. Медленная титрация дозы LTG снижает риск развития тяжелых поражений кожи (синдромов Стивенса–Джонсона и Лайелла) [31].
Четких правил по замене одного АЭП на другой не существует. Имеется рекомендация, согласно которой переход от первой ко второй монотерапии целесообразно осуществлять через этап комбинации двух препаратов, чтобы иметь возможность оценить эффективность политерапии. Однако, если отмена АЭП связана с его непереносимостью, возможна постепенная замена одного препарата на другой. В случае серьезных побочных явлений, таких как синдром Стивенса–Джонсона или синдром гиперчувствительности к антиконвульсантам, замена осуществляется немедленно – предпочтительно на один из АЭП, не требующих медленной титрации дозы. Замена CBZ на OXC может быть осуществлена в один день.
Фармакорезистентные пациенты должны получать рациональную политерапию [32], которая заключается в применении нескольких АЭП (чаще двух) с учетом их фармакодинамических и фармакокинетических взаимодействий. Совместное применение VPA и LTG позволяет снижать дозу последнего благодаря тому, что VPA повышает концентрацию LTG. Комбинация CBZ с TPM или LTG не рациональна из-за возможного снижения концентрации двух последних препаратов за счет индукции печеночных ферментов CBZ. Назначение комбинации из трех АЭП возможно лишь в исключительных случаях – при лечении наиболее злокачественных эпилептических синдромов. Если при терапии тремя АЭП приступы сохраняются, следует вернуться к монотерапии препаратом, наиболее эффективным и наименее токсичным из всех применявшихся в данном случае [32].
2.1.3. Роль лекарственного мониторинга (определения концентрации АЭП в крови)
Согласно I.E. Leppic [33], проведение измерения концентрации АЭП в крови целесообразно в 5 случаях:
- в начале терапии для установления связи между дозой и концентрацией;
- по достижении равновесной концентрации для оценки целевой дозы;
- ежегодно для оценки комплаентности;
- при развившемся после ремиссии приступе;
- при наличии признаков токсичности.
Для VPA терапевтическая концентрация лежит в пределах 50–100, для CBZ – 4–12 мг/л [33]. Терапевтическая концентрация LTG – 2–8 мг/л. LEV не взаимодействует с другими препаратами и имеет линейную кинетику, в связи с чем определение его концентрации в крови необязательно.
2.1.4. Нежелательные эффекты АЭП
Согласно C.P. Panayioutopoulos (2001), серьезными побочными эффектами обладают все АЭП, за исключением LEV. Одно из таких побочных явлений – синдром гиперчувствительности к антиконвульсантам. Он возникает при назначении препаратов ароматической структуры (CBZ, OXC, LTG, барбитуратов и PHT) с частотой 1 случай на 3000 больных, получавших соответствующий АЭП. Синдром проявляется на 2–8-й неделе после начала терапии в виде кожной сыпи, лихорадки, лимфаденопатии, агранулоцитоза, также могут развиваться гепатит, нефрит, миозит (табл. 2).
Требуется немедленная замена препарата, вызвавшего эти явления, на один из тех, для которых синдром гиперчувствительности нехарактерен. В дальнейшем необходимо исключать все АЭП, потенциально способные приводить к развитию синдрома гиперчувствительности.
Чаще встречаются менее тяжелые побочные явления (табл. 3). Не все из них требуют отмены АЭП, но часть диктует необходимость периодического аппаратного и лабораторного контроля.
2.2. Особенности антиэпилептической терапии нейроонкологических больных
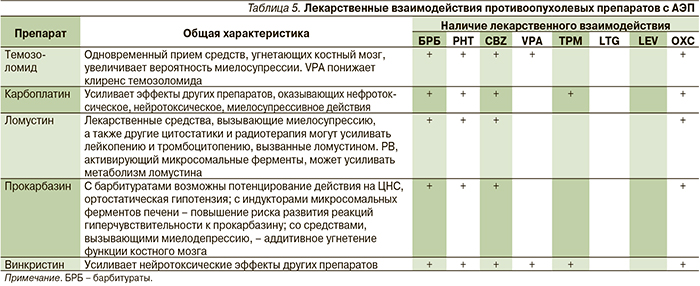
Основными трудностями в лечении эпилепсии у пациентов с ОГМ являются потенциальные взаимодействия АЭП с химиотерапевтическими средствами. Главные химиотерапевтические препараты, применяемые в нейроонкологии, представлены в табл. 4.
Очень важно, чтобы АЭП и цитостатический препарат не усиливали серьезные нежелательные эффекты друг друга. Необходимо также помнить о возможности потенциально фатальных кожных реакций пациентов, получающих лучевую терапию, на применение PHT, барбитуратов и CBZ.
Важное место в выборе АЭП пациентов, получающих химиотерапию, также занимают лекарственные взаимодействия. Так, у больных с глиобластомами при совместном применении химиотерапии и энзим-индуцирующих и энзим-неиндуцирующих АЭП была показана достоверно большая выживаемость среди пациентов, получавших VPA (13,9 месяца), по сравнению с больными, лечившимися CBZ (10,8 месяца). Эти результаты могут быть обусловлены изменением фармакокинетики химиопрепаратов – снижением концентрации под действием энзим-индуцирующего АЭП (CBZ) или увеличением концентрации под действием ингибитора микросомальных ферментов (VPA) [37–39]. Возможные лекарственные взаимодействия между АЭП и цитостатиками представлены в табл. 5.
Отдельного обсуждения требует возможность применения VPA нейроонкологическими больными. In vitro и в клинике показано наличие противоопухолевой активности данного препарата и установлена его способность повышать клиническую эффективность лучевого лечения и химиотерапии [21, 40–45]. С другой стороны, одним из нежелательных эффектов препарата является тромбоцитопения, что снижает привлекательность использования VPA. Было проведено контролируемое исследование влияния VPA на развитие тромбоцитопении на фоне стандартной терапии темозоломидом. Применение VPA и пожилой возраст могут быть дополнительными факторами риска развития тромбоцитопении при применении темозоломида, но критическая тромбоцитопения (< 100000 в мм3) не связана с использованием этого АЭП, поэтому исключение VPA при лечении темозоломидом не вполне оправданно, хотя данный риск все же следует иметь в виду, особенно пожилым пациентам [46].
На основании профиля безопасности АЭП и их лекарственного взаимодействия с химиотерапевтическими средствами первого выбора можно считать LEV, VPA, TPM и LTG [47]. Наиболее безопасным, а следовательно, предпочтительным является при этом назначение LEV [48]. При его неэффективности показан перевод на другой препарат. При лечении LEV, LTG или TPM целесообразно присоединение препаратов VPA с учетом их клинической активности в отношении пациентов с ОГМ [47].
Выводы
- Профилактически АЭП назначаются кратковременно для предотвращения приступов в первую неделю после операции по поводу ОГМ, но они неэффективны в отношении отсроченных неспровоцированных приступов.
- Применение фенитоина и в меньшей степени карбамазепина и фенобарбитала при проведении краниальной лучевой терапии связано с повышенным риском тяжелой, потенциально фатальной кожной реакции.
- Энзим-индуцирующие АЭП (фенитоин, карбамазепин, барбитураты) повышают клиренс и снижают клиническую эффективность противоопухолевых препаратов, которые метаболизируются через систему цитохрома P450.
- Новые АЭП, не влияющие на печеночный метаболизм, такие как леветирацетам, рекомендуются в качестве средств терапии первого выбора [50]. Другие препараты выбора – вальпроаты, ламотриджин, топирамат [47].



