Энцефалопатия с электрическим эпилептическим статусом в фазу медленного сна, или ESES (сокр. от англ. Encephalopathy with electrical status epilepticus during slow sleep), – состояние, при котором не столько эпилептические приступы (ЭП), а сама эпилептиформная (межприступная) активность способствует нарушению высших психических функций. Данное состояние характеризуется неоднородностью клинических проявлений и специфической электроэнцефалографической картиной в виде продолженной спайк-волновой активности в фазу медленного сна (сокр. CSWS от англ. Сontinuous spike and waves during sleep) [1]. В настоящее время границы двух определений ESES и CSWS стерты, они часто употребляются как синонимы [1–3]. ESES/CSWS – широкое понятие, объединяющее спектр близких по клинической картине эпилептических синдромов, к которым относятся непосредственно эпилептическая энцефалопатия с продолженной спайк-волновой активностью, синдром Ландау–Клеффнера (ЛКС) и атипичная эволюция доброкачественных фокальных эпилепсий детства (роландической и редко – синдрома Панайотопулоса).
При данной патологии основным неблагоприятным фактором прогноза являются не ЭП, которых в отдельных случаях может и не быть, а приобретенные интеллектуальные и двигательные нарушения, которые становятся необратимыми при продолжительности заболевания более 18 месяцев [2].
Цель лечения синдромов с ESES/CSWS – скорейшее подавление эпилептической активности и, соответственно, ЭП, что предупреждает дальнейшую нервно-психическую деградацию. Тем не менее, назначая лечение, следует понимать, что при чрезмерно длительном существовании ESES/CSWS улучшение на электроэнцефалограмме (ЭЭГ) уже не обеспечивает нормализацию психоречевого развития. В этом случае целью терапии будет уменьшение числа ЭП и/или предупреждение дальнейшего регресса. Вернуть нормальное психоречевое развитие ребенку в случае позднего начала адекватной терапии уже не удается.
Обоснование целесообразности применения и показания к гормональной терапии (ГТ)
Наиболее наглядным доказательством эффективности ГТ являются данные ретроспективного мета-анализа лечения 575 пациентов с ЕSES/CSWS, проведенного в 2015 г. (рис. 1) [3]. Исследование подтвердило, что наиболее эффективный подход – это применение именно ГТ, которая оказалась эффективнее антиэпилептических препаратов (АЭП), в т.ч. бензодиазепинов. В резистентных к ГТ случаях прибегают к хирургическому лечению, которое позволяет улучшать состояние большинства пациентов.

Согласно данным литературы, показаниями к назначению ГТ при синдромах с ЕSES/CSWS являются [2, 3]:
- неэффективность или недостаточная эффективность АЭП;
- частые ЭП и/или статусное течение приступов;
- нейрокогнитивный регресс, а именно появление двигательных, поведенческих или речевых нарушений (даже в отсутствие ЭП).
Возможные механизмы эффективности ГТ
Наиболее перспективным направлением в изучении точки приложения стероидов является разработка модели воспаления. В 2011 г. группой ученых были проведены исследования, доказавшие повреждение гематоэнцефалического барьера при эпилепсии [4]. При магнитно-резонансной томографии головного мозга было показано появление очагов изменения сигнала, напоминающих таковые при воспалении и соответствующих локализации эпиактивности на ЭЭГ. При изучении эпилептического статуса у крыс, предварительно получивших дексаметазон, количество особей с развившимся эпилептическим статусом сократилось, а время до его начала значительно увеличилось по сравнению с группой контроля, а также снизилась смертность экспериментальных животных. Результаты исследования позволили сформулировать гипотезу о том, что восстановление целостности гематоэнцефалического барьера может быть одним из механизмов, участвующих в противоэпилептическом действии глюкокортикостероидов (ГКС) [4].
Другая группа авторов в своих исследованиях сосредоточилась на эффектах нейростероидов [5]. Было высказано предположение, будто если эндогенные гормоны при катамениальной эпилепсии могут влиять на частоту возникновения судорог, то экзогенные гормоны также могут быть способными изменять возбудимость нейронов. В экспериментальных моделях эпилепсии были показаны возбуждающие нейрональные эффекты эстрогена и ингибирующее действие прогестерона [6]. Важно отметить, что влияние прогестерона на фармакоиндуцированные ЭП было дифференцированным в зависимости от пола: у самок прогестерон имел противосудорожные эффекты, в то время как у самцов эффект был проконвульсантным. Это можно объяснить влиянием многих факторов, в т.ч. наличием полового диморфизма в областях мозга, ответственных за генерацию и контроль ЭП, и в медиаторных системах [6].
По мнению других ученых, эффект применения ГТ может быть обусловлен увеличением периода полураспада АЭП, повышением их концентрации в крови, усилением постсинаптического действия, ингибированием высвобождения возбуждающих аминокислот и поддержанием стабильного мембранного потенциала [7].
Протоколы ГТ
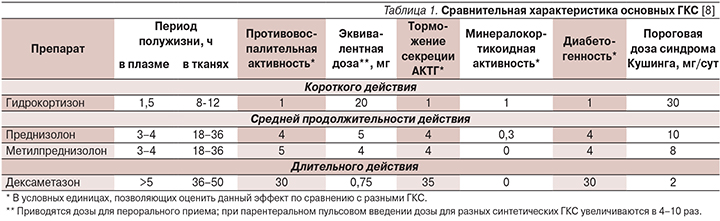
В лечении синдромов с продолженной спайк-волновой активностью применяют как гормоны коры надпочечников с преимущественно глюкокортикоидной функцией – гидрокортизон, так и их синтетические аналоги – преднизолон, метилпреднизолон, дексаметазон и в редких случаях – тетракозактид (синтетический адренокортикотропный гормон). Ниже приведена табл. 1, содержащая данные, позволяющие дифференцированно подходить к выбору препарата и его доз.
При разных ежедневных схемах приема ГКС следует назначать первую дозу в ранние утренние часы (между 6 и 8 часами); если же одноразовый прием невозможен из-за величины дозы, 2/3 дозы назначаются в 8 часов и 1/3 – днем (около полудня) [8].
Эффективность ГТ оценивается по уменьшению числа ЭП (или их полному прекращению) и по позитивной динамике на ЭЭГ – уменьшение спайк-волнового индекса во сне, а также по позитивной динамике психических и речевых функций и поведения ребенка.
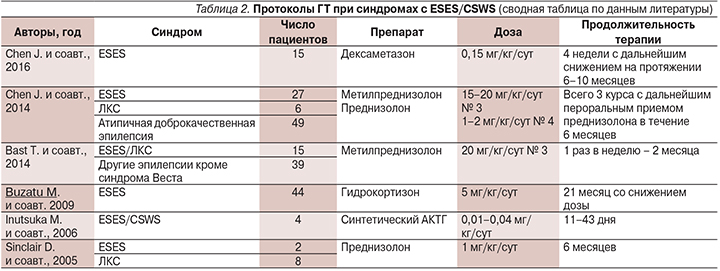
Среди применяемых препаратов лучше всего изучен метилпреднизолон. Последним и самым крупным является ретроспективное исследование J. Chen и соавт. (2014), включившее 82 пациента (табл. 2). Все они получили три курса метилпреднизолона в виде внутривенных инфузий в течение трех дней, с последующим пероральным приемом преднизолона в течение четырех дней. После трех курсов пероральный прием преднизолона был продолжен до 6 месяцев. Время персистирования CSWS cоставило от 2 до 10 лет. В результате общая эффективность достигла 83% с максимумом среди пациентов с синдромом Ландау–Клеффнера [9]. Эффективность метилпреднизолона была доказана и по результатам другого ретроспективного исследования, где предлагалась иная схема ГТ, причем не только для пациентов с ESES (табл. 2) [11]. Она включала четыре курса метилпреднизолона в дозе 20 мг/кг/сут по 3 дня каждую неделю. После четырех недель у 30 из 54 (56%) пациентов в общей выборке и у 11 из 15 (73%) – с ESES и синдромом Ландау–Клеффнера получен положительный эффект. Средняя продолжительность терапии составила 11 недель.
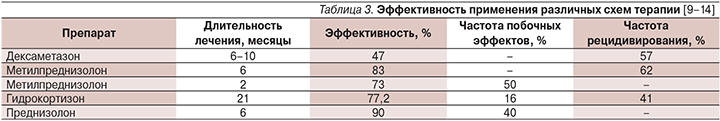
Данные по протоколам (выбор препарата, его доза и продолжительность лечения) остальных исследований по ГТ синдромов с ESES/CSWS также приведены в табл. 2. В табл. 3 представлены показатели эффективности лечения, частоты рецидивирования и развития побочных эффектов гормональных препаратов в зависимости от длительности курса.
Из данных, приведенных в табл. 3, следует, что гидрокортизон не уступает по эффективности метилпреднизолону и его применение вполне целесообразно [12]. Улучшение было достигнуто 34 из 44 (77,2%) пациентов, включая нормализацию ЭЭГ у 21 пациента, получавших лечение гидрокортизоном по 5 мг/кг/сут с постепенным снижением дозы на протяжении 21 месяца [12]. В то же время дексаметазон может по своей эффективности уступать метилпреднизолону.
Собственные данные по эффективности метилпреднизолона
Для оценки эффективности применения ГТ было проведено собственное ретроспективное исследование, включившее 43 пациента в возрасте от 2 до 14 лет с синдромами с ESES/CSWS (индекс продолженной спайк-волновой активности во сне составил 50% и более). Метилпреднизолон назначался сначала в виде пульсовой терапии: внутривенно капельно в дозах 25–30 мг/кг/сут в течение 3 дней, затем по 15 мг/кг/сут в течение 2 дней. Продолжительность пульсовой терапии в 5 дней обусловлена тем фактом, что именно в эти сроки (от третьего до пятого дня), как правило, происходит сокращение числа или прекращение ЭП. В те же сроки наблюдается сокращение частоты эпилептиформных разрядов, которое можно увидеть и на обычной рутинной 20-минутной ЭЭГ бодрствования (записывать ЭЭГ сна в такие короткие сроки в обычной клинической практике не всегда представляется возможным в силу трудоемкости исследования).
После первого курса пульс-терапии пациенты были разделены на две группы: в первую вошли дети без значительных нейрокогнитивных нарушений (n=17), во вторую – больные с выраженными нейрокогнитивными и/или речевыми нарушениями и тяжелым течением заболевания (n=26). Пациентам первой группы были проведены повторные курсы пульс-терапии 1 раз в месяц в аналогичных дозах на протяжении еще 5 месяцев. Пациентам второй группы после окончания первого курса инфузионной терапии был назначен пероральный прием метилпреднизолона по 1,5 мг/кг/сут с постепенным снижением дозы на протяжении 5 месяцев. Таким образом, общая продолжительность ГТ в обеих группах составила 6 месяцев. Положительная динамика оценивалась по сокращению числа ЭП более чем на 50% или их полному купированию, снижению индекса эпилептической активности, улучшению нейрокогнитивных функций и речи. Эффективность применения метилпреднизолона составила 76 и 80% в первой и второй группах соответственно, а в целом при эпилептических синдромах с ESES/CSWS – 79% (34/43).
Переносимость ГТ
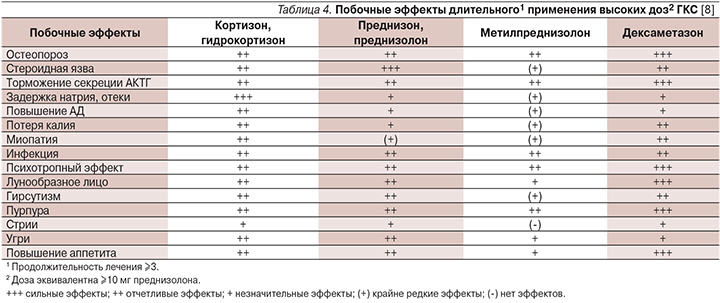
В табл. 4 представлены данные о возможных побочных эффектах ГТ и времени их появления. Родители детей, получающих ГТ, должны быть информированы о мерах профилактики побочных эффектов: соблюдение гипокалорийной рациональной диеты, прием препаратов калия, контроль уровня глюкозы в крови и артериального давления, раннее назначение антибактериальной терапии при инфекционных заболеваниях. Также необходимы контроль минерального обмена (биохимическое исследование крови) и ранняя профилактика остеопороза.
Жизнеугрожающих осложнений не отмечено ни в одном из исследований, представленных в табл. 4, все негативные реакции имели временный характер и полностью регрессировали по завершении лечения.

Продолжительность ГТ
По мнению большинства авторов, самый короткий курс ГТ не должен быть менее 3 месяцев, в среднем он занимает от 6 месяцев до 1,5 лет [1–3]. После 3 месяцев приема гормонов снова проводится оценка эффективности и при необходимости – коррекция терапии. Собственный опыт и литературные данные свидетельствуют о том, что неэффективность одного типа гормонального препарата не является предиктором резистентности к ГТ в целом. Смена препарата может позволить достигнуть положительного эффекта. Это наглядно показано на примере терапии дексаметазоном [10]. Из 15 пациентов с ESES/CSWS от 7 был получен эффект после 4-недельного лечения дексаметазоном. Важно отметить, что из 7 больных, ответивших на терапию, 5 ранее были резистентными к терапии преднизолоном в сравнимых дозах. Можно предположить, что это явление связано с отличиями в химической структуре метаболитов применяемых лекарственных средств и, соответственно, с различными механизмами их действия [10].
Негативной стороной ГТ синдромов с ESES/CSWS является значительная частота рецидивирования заболевания. После прекращения лечения частота рецидивов колеблется в диапазоне от 30 до 78%, и в основном они развиваются в течение 2 месяцев после прекращения терапии [10]. В таких ситуациях рекомендуется прибегать к повторным курсам ГТ. Пока нет данных о том, что повторная ГТ по выбору препарата или дозам должна отличаться от первоначального курса [10–14].
В заключение стоит отметить, что потенциальная польза от назначения ГТ при синдромах с продолженной спайк-волновой активностью во сне превосходит возможные побочные эффекты этого лечения. Она часто позволяет вернуть ребенку нормальную речь и когнитивные функции, а также позволяет контролировать ЭП. В отсутствие адекватного лечения синдромов с ESES/CSWS ЭП становятся реже или прекращаются только к периоду полового созревания, замещение продолженной спайк-волновой активности физиологическими паттернами наступает примерно к 11 годам, но приобретенные нейропсихологические нарушения различной степени выраженности сохраняются на всю жизнь.
Выводы
- ГТ является наиболее эффективным методом лечения синдромов с продолженной спайк-волновой активностью во сне. Прогноз заболевания тем лучше, чем раньше начато лечение и чем менее выражен нейрокогнитивный дефицит.
- Показаниями к ГТ при синдромах с ESES/CSWS являются неэффективность или недостаточная эффективность АЭП, частые ЭП и/или статусное течение приступов, нейрокогнитивный регресс (появление двигательных, поведенческих или речевых нарушений даже в отсутствие ЭП).
- Соотношение терапевтического потенциала и частоты побочных эффектов позволяет утверждать, что одним из препаратов выбора для длительной терапии синдромов с ESES/CSWS является метилпреднизолон.
- ГТ должна иметь длительный характер (не менее 6 месяцев). В отсутствие положительного эффекта через 3 месяца терапии необходимо прибегнуть к смене препарата (на другой ГКС).
- Строгая профилактика развития побочных эффектов ГТ может позволить минимизировать их частоту.
- После завершения гормонального лечения пациент в течение не менее 6 месяцев должен находиться под наблюдением невролога с регулярным проведением ЭЭГ сна и нейропсихологического тестирования.



