Введение
Инвазивные микозы (ИМ) остаются актуальной медицинской проблемой. Ежегодно примерно у 300 млн людей по всему миру регистрируются серьезные микотические инфекции, которые приводят как минимум к 1,5 млн смертей (www.gaffi.org). Грибковые патогены могут вызывать как легкие поверхностные формы инфекций (орофарингеальный или вульвовагинальный кандидоз), так и тяжелые клинические варианты, такие как инвазивный кандидоз, инвазивный аспергиллез, мукормикозы и др. ИМ, как правило, развиваются на фоне тяжелых фоновых заболеваний, включая ВИЧ-инфекцию, злокачественные новообразования, трансплантацию органов, терапию кортикостероидами, а к основным их возбудителям относятся грибы рода Candida, Aspergillus и Cryptococcus. Безусловно, для успешного лечения ИМ необходимо применение адекватной противогрибковой терапии. К сожалению, выбор антимикотиков (АМ) для системного применения очень ограничен, а основными мишенями действия существующих препаратов являются клеточная мембрана, клеточная стенка и биосинтез нуклеиновых кислот. Доступные классы АМ включают полиены, азолы, эхинокандины, флюоропиримидины и аллиламины. Несмотря на то что большинство из применяемых АМ зарегистрировано уже достаточно давно и всесторонне изучено, осведомленность врачей касательно ключевых аспектов клинической фармакологии АМ для системного применения, как показывает практика, зачастую оставляет желать лучшего. Цель данного обзора – изложение в сжатой форме ключевых клинико-фармакологических характеристик имеющихся системных противогрибковых препаратов, использующихся в различных клинических ситуациях среди гетерогенной популяции пациентов с ИМ [1–3].
Полиены
АМ класса полиенов являются одними из первых синтезированных противогрибковых препаратов. Несмотря на то что с середины прошлого века было получено более 200 различных молекул полиенов, проблемы, связанные с растворимостью, стабильностью, биодоступностью и переносимостью, обусловили внедрение в практику очень небольшого числа препаратов для системного применения, которые включают амфотерицин В (АмВ) и его липидные формы: липидный комплекс АмВ, коллоидную дисперсию АмВ и липосомальный АмВ [4].
Амфотерицин В
АмВ был синтезирован в 1955 г. при ферментации гриба Streptomyces nodosum и с 1957 г. применяется в клинической практике, оставаясь АМ с самым широким спектром действия и большим опытом клинического применения. АмВ обладает выраженной фунгицидной активностью с длительным постантифунгальным эффектом (ПАФЭ), достигающим 20 часов. Создает высокие концентрации в печени, селезенке, костном мозге, легких, почках; проходит через плацентарный барьер. У новорожденных и детей младшего возраста имеет место вариабельность фармакокинетики (ФК) АмВ с более продолжительным периодом полувыведения.
У недоношенных новорожденных проникновение АмВ в спинно-мозговую жидкость (СМЖ) достигает 40% от сывороточной концентрации, в то время как у взрослых этот показатель не превышает 2–4% [4, 5].
Ключевой причиной, ограничивающей применение АмВ, служат проблемы, связанные с его переносимостью и безопасностью. Нефротоксическое действие, тяжелые инфузионные реакции, электролитные нарушения, проявления со стороны центральной нервной системы (ЦНС) часто делают невозможным применение АмВ, хотя у детей раннего возраста переносимость препарата лучше таковой у взрослых. В тех ситуациях, когда по тем или иным причинам у нас нет возможности применять другие АМ (непереносимость, отсутствие активности, недоступность препарата), АмВ может стать единственным вариантом терапии. Помимо этого АмВ является, пожалуй, самым доступным с финансовой точки зрения АМ для системного применения, если не учитывать огромное число генериков сомнительного качества среди препаратов других групп. Для АмВ характерна очень низкая частота развития вторичной резистентности, однако проблемными патогенами могут быть Trichosporon beigelii, Aspergillus terreus, Pseudallescheria boydii, Fusarium spp., Candida lusitaniae и др. [4, 5].
АмВ сохраняет свое значение в качестве препарата глубокого резерва при терапии инфекций, вызванных чувствительными возбудителями, при невозможности применения других АМ. При комбинированной терапии криптококковой инфекции, в частности менингита, АмВ является препаратом выбора.
Липидные формы амфотерицина В
Липидные формы АмВ были получены в 1990-х гг., основная цель при их синтезе – улучшение переносимости АмВ при сохранении широты спектра его действия. Действительно, спектр активности липидных форм АмВ идентичен обычному АмВ, однако ФК и нежелательные лекарственные реакции (НЛР) данных препаратов определяют их основные различия, на которых необходимо остановиться подробнее.
Размер молекул и структура липидного компонента – определяющие для их ФК и как следствие – для особенностей применения. Липосомальный АмВ имеет наименьший размер молекул, что позволяет ему создавать высокие концентрации в крови, ЦНС, печени, селезенке; меньшие – в почках и легких. Липидный комплекс АмВ имеет самый крупный размер молекул, что приводит к их быстрому захвату макрофагами с последующим высвобождением в тканях. Это обусловливает относительно низкие концентрации в плазме, но при этом высокие концентрации, например, в легких. Липидный комплекс АмВ и коллоидная дисперсия АмВ создают высокие концентрации в межклеточном пространстве и органах ретикулоэндотелиальной системы. Максимальный концентрационно-зависимый эффект полиенов достигается, как правило, на фоне применения дозы 5 мг/кг, при этом увеличение концентрации в 2–3 раза не сопровождается увеличением эффективности, однако может приводить к увеличению токсичности, что, в частности, было показано в исследовании AmBiLoad при сравнении липосомального АмВ в дозах 3 и 10 мг/кг/сут [5–7].
Среди трех представителей липидных форм АмВ коллоидная дисперсия обладает наиболее неблагоприятным профилем переносимости. Это связано, в частности, с необходимостью применения относительно высоких доз препарата для достижения оптимальных терапевтических концентраций – от 4 мг/кг и выше. Однако при повышении этих значений отмечено возрастание риска нефротоксических и инфузионных реакций, частота которых приближается к таковой обычного АмВ [5].
На сегодняшний день показанием к применению липидных форм АмВ служат тяжелые рефрактерные формы ИМ, вызванные прежде всего мицелиальными грибами, а также эмпирическая терапия нейтропенической лихорадки и комбинированная терапия криптококковой инфекции [4, 6].
Азолы
Азолы в зависимости от времени своего появления, а также клинико-фармакологических особенностей подразделяются на азолы первого поколения (или «ранние» азолы) – кетоконазол, флуконазол и итраконазол, и азолы второго поколения – вориконазол и позаконазол. Механизм действия всех азолов связан с нарушением синтеза эргостерола за счет блокады активности фермента ланостерол-14α-деметилазы. Азолы обладают концентрационно-независимым действием с максимальным эффектом при концентрации, находящейся примерно на уровне МПК, превышение которой не увеличивает степень ингибирования роста грибов [8].
Клиническое значение азолов на сегодняшний день исключительно велико, при этом каждый из системных азолов как первого, так и второго поколения с учетом особенностей ФК, фармакодинамики и результатов проведенных клинических исследований имеет свою нишу в терапии ИМ.
Реально существующей проблемой служат вариабельные, но имеющие тенденцию к постоянному росту показатели вторичной резистентности среди грибов рода Candida. В России в настоящее время процент устойчивых к флуконазолу штаммов C. albicans варьируется в пределах 5–20%, однако для C. glabrata данный показатель может превышать 25%. Эта цифры в целом коррелируют с таковыми в Европе и США, но в некоторых случаях могут быть ощутимо ниже [9–11].
Флуконазол
Флуконазол является, пожалуй, самым широко изученным и наиболее применяемым среди производных азолов, однако его спектр активности ограничен дрожжевыми патогенами (Candida spp., Cryptococcus spp.), некоторыми дерматомицетами и диморфными грибами. Флуконазол не активен в отношении практически всех мицелиальных грибов, включая Aspergillus spp. [5, 12].
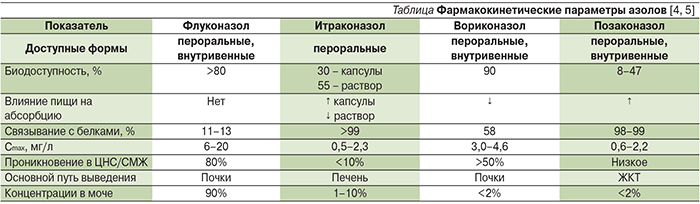
Обладает высокой биодоступностью (до 100%), не зависимой от приема пищи и внутрижелудочного рН, характеризуется длительным периодом полувыведения и низким связыванием с белками, что позволяет создавать высокие концентрации в биологических жидкостях (в моче до 80% от сывороточной). ФК флуконазола наименее вариабельна по сравнению с другими азолами (см. таблицу). У детей отмечается больший объем распределения, а у новорожденных флуконазол имеет особенности дозирования: препарат в первые 2 недели жизни вводится 1 раз в 72 часа, в течение 3-й недели – 1 раз в 48 часов, начиная с 4-й недели дозируется, как и у взрослых, ежедневно 1 раз в сутки [5, 12].
Флуконазол является своего рода «золотым» стандартом безопасности противогрибковой терапии, включая меньший риск развития лекарственных взаимодействий по сравнению с итраконазолом или вориконазолом. Основные НЛР флуконазола связаны с симптомами со стороны желудочно-кишечного тракта (ЖКТ; тошнота, рвота, диарея). Возможны НРЛ со стороны печени, кожи, ЦНС, но их частота редко превышает 1% [5, 12–14].
Основной сферой применения флуконазола являются поверхностные или инвазивные формы кандидозной инфекции, обусловленные чувствительными к флуконазолу штаммами, включая профилактику кандидоза. Он может использоваться для терапии криптококкоза, кокцидиоидомикоза и отдельных форм дерматомикозов. Говоря об инвазивном кандидозе, необходимо выделить те ситуации, когда от применения флуконазола следует воздериважаться: тяжелое состояние пациента, невозможность провести скрининг чувствительности к этому препарату, отсутствие видовой идентификации Candida spp., выделение C. krusei или C. glabrata, терапия азолами в анамнезе и высокий локальный уровень резистентности грибов рода Candida к азолам [15].
Итраконазол
Итраконазол был первым азолом, продемонстрировавшим активность в отношении грибов рода Aspergillus и ряда представителей Dematiaceous. Он обладает примерно одинаковой с флуконазолом активностью в отношении Сandida spp., однако более активен в отношении дерматомицетов и диморфных грибов. Поскольку итраконазол служит слабым основанием, для его оптимального всасывания при приеме внутрь необходима кислая среда. В этом причина вариабельной биодоступности, что наиболее характерно для капсул (≈30%) и в меньшей степени – для перорального раствора (≥55%) итраконазола, который наилучшим образом всасывается натощак и которому в настоящее время отдается предпочтение при терапии per os [13, 16].
Итраконазол является ингибитором и субстратом для Р-гликопротеина и CYP3А4, что приводит к снижению концентраций мидазолама, атазанавира, ритонавира, такролимуса, циклоспорина и некоторых других препаратов. Следует иметь в виду возможность возникновения НЛР со стороны ЖКТ, что характерно для перорального раствора, а также отрицательный инотропный эффект итраконазола, что требует осторожного его применения пациентами с сердечной недостаточностью. Форма для внутривенного введения итраконазола долгое время была зарегистрирована во многих странах, но в настоящее время уходит с рынка, в частности, в связи с нефротоксическим эффектом входящего в ее состав циклодекстрина [13, 17].
С учетом особенностей ФК и профиля безопасности итраконазол сохраняет свою роль при дерматомикозах, в т.ч. онихомикозах, эндемичных микозах (бластомикоз, гистоплазмоз), споротрихозе, а также при некоторых формах аспергиллеза, например аллергическом бронхо-легочном аспергиллезе. Пероральный раствор итраконазола может использоваться для терапии орофарингеального кандидоза, кандидоза пищевода и профилактики ИМ у пациентов групп высокого риска. Терапевтический лекарственный мониторинг (ТЛМ) сывороточных концентраций итраконазола считается рекомендованной процедурой в течение первой недели терапии в случае отсутствия ответа, появления прорывных грибковых инфекций, при нарушенной функции ЖКТ, а также при риске развития лекарственных взаимодействий [13, 18].
Вориконазол
Вориконазол – препарат выбора при терапии большинства форм инфекций, вызванных грибами рода Aspergillus. Обладая приблизительно одинаковой активностью с флуконазолом в отношении Candida spp. (кроме C. krusei, против которой вориконазол демонстрирует стабильно высокую активность), вориконазол действует на грибы рода Fusarium и Scedosporium, что кардинально отличает его от ранних азолов. В настоящее время есть данные о появлении перекрестной резистентности среди флуконазол-резистентных штаммов Candida spp. [5, 19].
Биодоступность пероральной формы вориконазола может превышать 90% при приеме натощак. Вариабельные сывороточные концентрации в связи с нелинейной ФК вориконазола, обусловленные пресистемным метаболизмом в печени, а также генетический полиморфизм CYP2C19 являются причиной появления НЛР, а также обусловливают необходимость проведения ТЛМ. Было показано, что менее 50% пациентов достигают целевых базальных концентраций вориконазола без проведения индивидуального ТЛМ [20]. Среди НЛР помимо характерных для других азолов (симптомы со стороны ЖКТ, гепатотоксичность) следует отметить нарушения со стороны органа зрения (блокада TRPM1 каналов биполярных ON-клеток сетчатки), кожные реакции, ментальные нарушения, случаи периостита, аллопеции, изменения ногтевых пластинок и др. [5, 21].
Для вориконазола характерна высокая внутри- и межиндивидуальная вариабельность ФК, при этом на клиренс препарата значимое влияние оказывает генотип CYP2C19. Осторожность следует соблюдать пациентам с почечной недостаточностью при применении вориконазола внутривенно в связи с входящим в состав внутривенной формы циклодекстрина. При клиренсе креатинина <50 мл/мин необходимо оценивать соотношение польза/риск для внутривенного применения вориконазола. Отдельное внимание следует уделить лекарственным взаимодействиям (CYP2С19, 2С9 и CYP3A4) с учетом метаболизма препарата в печени. Противопоказанные комбинации включают рифампин, длительно действующие барбитураты, карбамазепин, сиролимус, терфенадин и др. [5, 19].
Помимо аспергиллеза, о чем было сказано выше, вориконазол применяется при терапии инвазивного кандидоза, в т.ч. вызванного C. krusei. Может применяться при кандидозе пищевода. При фузариозе и сцедоспориозе вориконазол является пока единственным АМ с официальными показаниями. Разрешен к применению детьми старше 2 лет [13]. Появляется все больше данных о возможностях профилактической терапии вориконазолом пациентов групп высокого риска [22], однако официального показания касательно профилактики препарат в настоящий момент не имеет.
Позаконазол
Позаконазол первым среди всех АМ проявил значимую активность в отношении возбудителей мукормикозов (Mucorales). Активность в отношении грибов рода Candida, Aspergillus, Fusarium, Scedosporium сравнима с таковой вориконазола [23].
Долгое время позаконазол был доступен только в виде суспензии для приема внутрь, для которой характерна вариабельность ФК, что связано с изменяющейся абсорбцией препарата (8–50%) в зависимости от наличия пищи и рН в желудке. Причиной снижения абсорбции и как следствие – плазменной концентрации служат мукозит, прием препаратов подавляющих желудочную секрецию (ингибиторы протоновой помпы, Н2-блокаторы), а также тошнота, диарея и рвота.
В свою очередь повышение плазменной концентрации отмечается на фоне приема высококалорийной пищи. Регистрация Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) новых лекарственных форм позаконазола – таблеток и формы для внутривенного введения – открывают новые возможности терапии. Это связано со значимо лучшей ФК таблетированной формы (прием 1 раз в сутки, лучшая системная биодоступность, отсутствие зависимости абсорбции от приема пищи и рН в желудке), а парентеральная форма препарата позволит использовать позаконазол для ступенчатой терапии, однако необходимо отметить, что, как и у внутривенной формы вориконазола, в ее состав входит циклодекстрин, что может стать потенциальной причиной его аккумуляции при клиренсе креатинина < 50 мл/мин [5, 23, 24].
В целом ФК позаконазола одинакова для взрослых и детей старше 8 лет, в то время как для детей младше 8 лет ФК на настоящий момент изучена недостаточно полно. В отличие от итраконазола и вориконазола для позаконазола характерен меньший риск развития лекарственных взаимодействий, т.к. он метаболизируется при незначительном участии ферментов CYP450, однако возможны взаимодействия, обусловленные его ингибированием CYP3A4. В связи с высоким процентом связывания с белками (99%) препарат создает низкие концентрации в моче и СМЖ. Профиль переносимости позаконазола приближается к таковому флуконазола, и основные НЛР представлены симптомами со стороны ЖКТ. При терапии позаконазолом также рекомендовано проведение ТЛМ (отсутствие ответа, прорывные инфекции, нарушения функции ЖКТ, сопутствующая терапия) [5, 23, 24].
Учитывая его спектр активности и тот факт, что пока в РФ позаконазол доступен только в форме раствора для перорального применения, данный АМ используется для терапии тяжелых ИМ при неэффективности препаратов первой линии. Он может применяться как препарат выбора в качестве терапии орофарингеального кандидоза. Однако основной нишей позаконазола является профилактика ИМ у пациентов с высоким риском их развития, что было подтверждено результатами ряда клинических исследований, и в настоящее время в отношении данного показания он имеет наивысший уровень доказательности данных – АI. В отношении детей разрешен к применению с 13 лет [13, 25].
Эхинокандины
Эхинокандины – анидулафунгин, каспофунгин, микафунгин – представляют собой исключительно важный с клинической точки зрения класс АМ. Во-первых, эхинокандины обладают уникальным механизмом действия, связанным с ингибированием ферментов 1,3- и 1,6-β-D-глюкансинтетазы, ответственных за синтез β-D-глюкана, представляющего собой полимер глюкозы, обеспечивающий структуру и целостность клеточной стенки грибковых патогенов [26]. Поскольку данный фермент отсутствует в клетках человека, у эхинокандинов хороший профиль переносимости, включая низкую нефро- и гепатотоксичность. Во-вторых, эхинокандины обладают высокой фунгицидной активностью в отношении грибов рода Candida, включая штаммы, резистентные к азоловым АМ, а также демонстрируют активность в отношении биопленок Candida spp. Они также действуют на грибы рода Aspergillus, Pneumocystis jiroveci и некоторые мицелиальные грибы (Acremonium, Curvularia, Bipolaris и др.). В отношении грибов рода Aspergillus эхинокандины оказывают фунгистатическое действие за счет лизиса апикальных отделов гиф мицелия, изменяя их морфологию и структуру. В-третьих, эхинокандины обладают достаточно предсказуемым и маловариабельным профилем ФК, что безусловно облегчает достижение клинического эффекта. Эхинокандины имеют выраженный концентрационно-зависимый эффект с длительным ПАФЭ, при этом однократные высокие дозы обеспечивают быстрое достижение целевых показателей, в связи с чем все эхинокандины вводятся один раз в сутки. Обладая высокой молекулярной массой, все эхинокандины имеют низкую абсорбцию при приеме внутрь, а в связи с высоким (до 99%) связыванием с белками плохо проникают и, соответственно, создают низкие концентрации в ЦНС и глазном яблоке [5, 27–29].
С 2007 г. при определении чувствительности Сandida spp. к эхинокандинам использовался один критерий, предложенный Институтом клинических и лабораторных стандартов (CLSI), для всех препаратов этой группы применительно ко всем видам Candida – ≤2 мкг/мл. Однако появление за последние несколько лет случаев неэффективности терапии при выделении штаммов с относительно низкими значениями минимальной подавляющей концентрации (МПК), но при наличии у штаммов приобретенных мутаций генов FKS1 и FKS2, сделало необходимым пересмотр данного критерия, представленного CLSI в 2013 г., примерно в одно время с критериями интерпретации Европейского комитета по определению чувствительности к антимикробным препаратам (EUCAST). После внедрения в практику указанных критериев стали появляться данные о недостаточно четком их соответствии эффективности препаратов in vivo, когда при выделении штаммов со сниженной чувствительностью у пациентов, тем не менее, отмечалась клиническая эффективность терапии эхинокандинами. Наиболее часто это имело место при инфекциях C. glabrata-вида, который на сегодня является самым проблемным в плане чувствительности (рост числа устойчивых штаммов c 2–3% в 2001–2006 гг. до >13% в 2009–2010 гг.). Кроме того, было показано, что независимым предиктором клинической неэффективности терапии эхинокандинами инфекции C. glabrata является не МПК, а наличие у штамма мутаций генов FKS1 и FKS2. Вполне возможно, что в будущем это может потребовать определенного пересмотра критериев и стать основой разработки молекулярных методик определения чувствительности. Тем не менее в настоящее время проблем с устойчивостью грибов рода Candida к эхинокандинам в России нет, что, в частности, было показано в недавно проведенном исследовании КРИТ, где каспофунгин показал активность в отношении 100% штаммов с использованием критериев CLSI. В целом это говорит о том, что нам необходимы дальнейшие масштабные исследования оценки корреляции показателей активности эхинокандинов in vitro с имеющимися мутационными изменениями отдельных генов и, что наиболее важно, с клинической эффективностью препаратов, включая оценку режимов дозирования, продолжительности терапии, критериев ее отмены. Отдельным вопросом остаются высокие исходные показатели МПК эхинокандинов в отношении C. parapsilosis complex и C. guilliermondii. Указанная природная сниженная чувствительность не продемонстрировала связи с клинической эффективностью, т.к. случаи ИМ, обусловленных данными возбудителями, с успехом отвечают на терапию эхинокандинами [10, 30–33].
Показатели ФК, профиль лекарственных взаимодействий и показания к применению определяют основные различия между эхинокандинами, которые следует учитывать при их назначении.
Каспофунгин
Каспофунгин был первым зарегистрированным в 2003 г. АМ группы эхинокандинов и в настоящее время является наиболее изученным препаратом с большим опытом применения различными категориями пациентов. Каспофунгин разрешен к терапии инвазивного кандидоза и инфекций, вызванных грибами рода Candida (интраабдоминальные абсцессы, перитонит и инфекции плевры), кандидоза пищевода, и является единственным эхинокандином, показанным к эмпирической терапии нейтропенической лихорадки у пациентов группы высокого риска, а также для терапии инвазивного аспергиллеза при неэффективности препаратов первой линии [5, 13].
Каспофунгин обладает рядом клинически значимых лекарственных взаимодействий, включая рифампицин, эфавиренз, невирапин, фенитоин, дексаметазон и карбамазепин. Каспофунгин, как и другие эхинокандины, не требует коррекции доз при почечной недостаточности, однако в отличие от других представителей этой группы требует снижения дозы на 50% для пациентов с умеренной степенью печеночной недостаточностью. В отличие от микафунгина и анидулафунгина обладает нелинейной ФК. В отношении детей каспофунгин разрешен к применению с 3-месячного возраста [5].
Микафунгин
Микафунгин был зарегистрирован в 2005 г. и стал одним из немногих АМ, разрешенных к применению у детей с рождения. Имея аналогичные с каспофунгином показания касательно инвазивного кандидоза и кандидоза пищевода, микафунгин является единственным эхинокандином, показанным к профилактике ИМ, вызванных грибами рода Candida, пациентам с трансплантацией кроветворных стволовых клеток или у которых предполагается нейтропения (нейтрофилов <500 в мкл) в течение 10 и более дней [5, 13].
Микафунгин не требует коррекции доз при печеночной или почечной недостаточности. Из клинически значимых лекарственных взаимодействий следует отметить сиролимус и нифедипин. С учетом особенностей ФК микафунгина он не требует введения нагрузочной дозы в отличие от других эхинокандинов, однако для достижения равновесной концентрации ему требуется больший период времени (до 72 часов) [5, 13].
Микафунгин в инструкции по применению препарата в Европе имеет т.н. предупреждение в черной рамке (Black Box Warning). Это связано с результатами доклинических исследований длительного применении препарата у крыс в дозах, приводящих к созданию концентраций, близких к терапевтическим концентрациям у человека, которые показали возможность формирования локальных очагов измененных гепатоцитов и печеночно-клеточных опухолей у подопытных животных. Однако с момента получения этих данных и до настоящего времени ни одного случая подобных изменений у человека, в т.ч. и при использовании высоких доз микафунгина, отмечено не было. Кроме того, микафунгин не имеет различий с другими эхинокандинами по частоте появления изменений функциональных показателей печени на фоне терапии, а также не обнаружил изменений ФК у пациентов с фоновыми нарушениями функции печени [13, 34].
Анидулафунгин
Анидулафунгин был зарегистрирован последним из трех эхинокандинов и обладает рядом уникальных свойств. Прежде всего анидулафунгин характеризуется самым большим периодом полувыведения препарата, что потенциально может свидетельствовать о более продолжительном ПАФЭ, и объемом распределения, который говорит об активном накоплении препарата в органах с созданием высоких тканевых концентраций. Анидулафунгин подвергается спонтанной химической деградации, и в связи с отсутствием метаболизма препарата в печени у анидулафунгина нет известных лекарственных взаимодействий; в исследованиях совместное применение с циклоспорином приводило к некоторому увеличению концентраций анидулафунгина, но оно не было расценено как клинически значимое [5, 13, 35].
Анидулафунгин показан к терапии инвазивного кандидоза и кандидемии, а также кандидоза пищевода. Разрешен к применению с 18-летнего возраста [13].
Флюоропиримидины
Флуцитозин (5-фторцитозин)
К флюоропиримидинам относится один препарат – флуцитозин (5-фторцитозин, 5-ФЦ), синтезированный в 1957 г. в качестве, возможно, средства терапии злокачественных новообразований. В последующем на животных моделях была показана его активность при инфекциях, вызванных C. albicans и C. neoformans. Клиническое применение 5-ФЦ началось в 1968 г., в связи с чем это один из старейших из применяемых по сей день АМ. Механизм действия 5-ФЦ связан с подавлением синтеза рибонуклеиновых кислот за счет нарушения белкового синтеза и ингибирования тимидилатсинтетазы, участвующей в синтезе тимидина [4, 36].
5-ФЦ обладает высокой (80–90%) биодоступностью и создает высокие концентрации в СМЖ, костном мозге, синовиальной и в перитонеальной жидкостях, т.к. связывается с белками только на 2–4%. До 90% препарата выводится в неизменном виде через почки с периодом полувыведения от 2,5 до 6,0 часов. Обладает концентрационно-независимым эффектом в отношении Candida spp. с максимальной выраженностью при концентрации, близкой к МПК, с быстрым возобновлением роста при падении концентрации, в связи с чем рекомендовано частое введение небольших доз препарата. С максимальной концентрацией напрямую связана и токсичность, что требует дробного введения 5-ФЦ [4, 36].
Важными ограничивающими факторами применения являются плохая переносимость 5-ФЦ (НЛР со стороны ЖКТ, нефро-, гематотоксичность, неврологические нарушения) и высокий риск быстрого развития вторичной резистентности, в связи с чем препарат применяется только в комбинации с другими АМ [4, 36].
В настоящее время 5-ФЦ является препаратом выбора для комбинированной терапии криптококковой инфекции, в частности криптококкового менингита в сочетании с АмВ (или его липидными формами) или флуконазолом [13].
Аллиламины
Тербинафин
Тербинафин относится к классу аллиламинов и представляет собой препарат как для местного, так и для системного применения с преимущественно фунгицидным действием, связанным с нарушением синтеза эргостерола за счет подавления активности фермента скваленэпоксидазы. Спектр активности тербинафина включает грибы рода Trichophyton, Epidermophyton, Microsporum, что определяет основные показания к его применению. Активен в отношении Malassezia spp., Trichosporon spp., Candida spp., Aspergillus spp., Fusarium spp., возбудителей феогифомикозов (Hortae spp., Exophiala spp.), а также возбудителей эндемичных микозов, хотя это имеет ограниченное клиническое значение [4].
Кислотность и прием пищи не влияют на абсорбцию тербинафина. Он связывается с белками более чем на 90%, в связи с чем создает низкие концентрации в биологических жидкостях, но благодаря высокой липофильности активно накапливается в роговом слое кожи, волосяных фолликулах, волосах. Тербинафин метаболизируется в печени с периодом полувыведения примерно 17 часов [4, 13].
Основные НЛР связаны с симптомами со стороны ЖКТ: диарея, тошнота, абдоминальный дискомфорт, реже – нарушения вкуса, еще реже – нарушения функции печени. На фоне применения тербинафина имели место случаи тяжелых поражений кожных покровов, в частности токсический эпидермальный некролиз [4].
Тербинафин применяется прежде всего для терапии микозов кожи и ее придатков, вызванных дерматомицетами. Помимо этого используется для терапии хромомикоза – инфекций кожи и подкожной клетчатки, вызванных грибами рода Fonsecaea, Phialophora и др., а также при тяжелых рефрактерных инфекциях, вызванных Fusarium spp. и Scedosporium spp., в т.ч. S. prolificans, в комбинации с вориконазолом [13, 37].
Заключение
В данном обзоре мы постарались кратко остановиться на ключевых клинико-фармакологических характеристиках АМ для системного применения. Была дана характеристика показателей активности препаратов in vitro, рассмотрены особенности всасывания метаболизма, выведения и лекарственных взаимодействий, а также профиля безопасности. Определено место в клинической практике каждого из обсуждаемых АМ. Безусловно, данный обзор ни в коей мере не может претендовать на определение «полный», т.к. каждый из препаратов имеет огромное число нюансов, а обсуждение клинического опыта применения любого из АМ потребует колоссальных объемов изложения. Тем не менее мы надеемся, что этот обзор сможет оказать помощь практикующим врачам в непростом выборе системных противогрибковых препаратов при лечении ИМ.



