Внедрение современных диагностических технологий в клиническую микробиологию позволило обнаружить, что постоянство видового и количественного состава нормальной микрофлоры обеспечивает колонизационную резистентность влагалища и противостоит заселению биотопа патогенными микроорганизмами или чрезмерному росту собственной условно-патогенной микрофлоры и транслокации ее в локусы, несвойственные данным видам. Это достигается участием лактобацилл в создании биопленки при адгезии их на эпителиальных клетках влагалища и продукцией лактобактериями антимикробных протеиновых субстанций – бактериоцинов, а также молочной кислоты. Более того, вагинальный и цервикальный эпителий секретирует антимикробные пептиды (АМП), которые препятствуют колонизации экзогенными микроорганизмами [1, 2].
Известно более 500 АМП, которые защищают эпителиальные ткани человека и животных от внедрения бактерий, грибов, простейших, вирусов, оказывая антимикробное действие, поэтому их называют натуральными антибиотиками. Также они играют важную роль в развитии процессов воспаления, поддержании и регуляции адаптивной иммунной системы [1, 2].
Во влагалище обнаружены несколько видов АМП, которые представлены дефенсинами, кателицидинами, секреторным ингибитором лейкоцитарных протеаз (SLPI), элафином и лизоцимом. В настоящее время фундаментальные исследования, посвященные роли дефенсинов в противомикробной защите нижних отделов половых путей, активно внедряются в клиническую медицину. Описаны 2 группы дефенсинов человека – α и ß. α-дефенсины представлены в полиморфноядерных нейтрофилах и принимают участие в иммунологическом ответе. ß-дефенсины проявляют антиинфекционную активность в отношении грамотрицательных бактерий и дрожжеподобных грибов [3–5].
Антимикробные субстанции лактобацилл и антимикробные полипептиды влагалищного эпителия формируют защитный экологический барьер, препятствующий колонизации несвойственными данному биотопу видами микроорганизмов. Несмотря на это, около 75% женщин имеют вагинальную инфекцию, а 5–10% из них страдают рецидивирующим бактериальным вагинозом (БВ) [6–8]. Однако трудно оценить, что в большей степени влияет на реализацию иммунного ответа – прямое бактерицидное и противовирусное действие АМП на патогенные микроорганизмы или их иммуномодулирующий эффект.
Клинически доказано, что АМП угнетают рост грамположительных и грамотрицательных бактерий, грибов и некоторых вирусов, проявляя биологическую эффективность в репродуктивном тракте в содействии с другими факторами местного иммунитета.
На сегодня описаны два больших подсемейства класса АМП: дефенсины и кателицидины. Из множества АМП клетками-продуцентами и локусами α- и ß-дефенсинов являются лимфоциты, фагоциты и эпителиоциты респираторного, желудочно-кишечного и урогенитального тракта. Дефенсины на местном уровне одними из первых обеспечивают защиту организма в ответ на заражение бактериями, грибами и вирусами, так как продуцируются эпителием влагалища и шейки матки.
Принимая во внимание поиск новых подходов в диагностике и терапии БВ в период беременности, исследование защитных свойств антимикробных пептидов в ответ на инфекционные агенты при БВ является актуальным.
Цель исследования: сопоставление антимикробной активности вагинального отделяемого с характером течения БВ, состоянием рН влагалища и микробиологическими показателями.

Материал и методы исследования
В исследование были включены 53 беременные, из которых у 34 диагностирован БВ и у 19 – нормальный микроценоз влагалища.
Наличие и тяжесть БВ оценивали при помощи количественной шкалы Nugent (Nugent’s Diagnostic Criteria for Bacterial Vaginosis 1991, табл. 1). Критерием БВ являлось наличие 7 и более баллов. Оценка от 4 до 6 баллов рассматривалась как показатель промежуточного типа микробиоценоза, а от 0 до 3 считали показателем нормального микробиоценоза влагалища.
При микроскопическом исследовании мазков после окрашивания по Граму визуально оценивали наличие и обилие лактобацилл, бактероидов, грамположительных кокков и гарднерелл. Обилие выражали в баллах по 4-балльной шкале, где 0 – отсутствие данной группы микроорганизмов, 1 – единичные клетки в поле зрения, 2 – умеренное количество клеток, 3 – обилие клеток.
Беременные с верифицированным диагнозом БВ в последующем были разделены на 3 подгруппы, в зависимости от тяжести клинических проявлений заболевания. Нами была разработана балльная шкала оценки клинических симптомов БВ, в которую входили такие критерии, как зуд, жжение, гиперемия, отечность, боли при мочеиспускании, диспареуния, эрозивные поражения слизистой влагалища и вульвы, характер влагалищных выделений. По результатам анкетирования пациентка могла набрать от 0 до 18 баллов. В соответствии с полученной суммой баллов в 1-ю подгруппу вошли пациентки с легким течением БВ (сумма баллов 3–8), во 2-ю – средней степени тяжести (9–12 баллов) и в 3-ю – пациентки с тяжелым БВ (13–18 баллов). В каждой подгруппе было проведено микробиологическое обследование с обязательной оценкой рН влагалищной среды и исключением возможного инфицирования абсолютными патогенами.
 Для определения антимикробной активности эпителия влагалища исследовали образцы вагинального отделяемого. Противомикробную активность определяли следующим образом: клетки 3-суточной тест – культуры Escherichia coli инкубировали при 32оС и соотношении 40 мкл вагинального отделяемого/10 мкл бактериальной суспензии 104 КОЕ/мл.
Для определения антимикробной активности эпителия влагалища исследовали образцы вагинального отделяемого. Противомикробную активность определяли следующим образом: клетки 3-суточной тест – культуры Escherichia coli инкубировали при 32оС и соотношении 40 мкл вагинального отделяемого/10 мкл бактериальной суспензии 104 КОЕ/мл.
Из данной смеси сразу после смешивания и инкубации в течение 2 часов производили посевы. Результат вычисляли выражением процента клеток, убитых в процессе инкубации.
Противомикробная активность АМП определялась в группах беременных в зависимости от характера проявления клинических симптомов БВ.
Разделение белков в образцах вагинального отделяемого проводили методом SDS-электрофореза в градиенте 5–20% полиакриламидного геля. Образцы готовили в неденатурирующих условиях, смешивая 1 объем образца с 2 объемами буфера и нанося по 40 мкл образца на дорожку. Окрашивание проводили с помощью Кумасси R-250. В качестве стандартов молекулярной массы использовали смесь LMW («Амершам-Фармация»).
Статистическая обработка полученных результатов была проведена на персональном компьютере при помощи программного пакета SPSS Statistics 22.0 for Windows. Для определения статистической значимости различий применялись точный двухсторонний критерий Фишера и U-тест Манна–Уитни для несвязанных совокупностей. Отношение шансов (OR) приведено с 95% доверительным интервалом (CI).
Результаты исследования
После отбора пациенток и проведения необходимого спектра обследований нами была проведена оценка характера микрофлоры. Выявленные микроорганизмы были условно разделены на две группы: «облигатная микрофлора» (лактобациллы и бактероиды) и «факультативная микрофлора» (кокки и гарднереллы). Результаты комплексной оценки представлены в табл. 2.
Данные, представленные в таблице, показывают, что наиболее высокие значения баллов по облигатной микрофлоре находились в группе беременных с нормальным микроценозом влагалища, наиболее низкие – у беременных с тяжелой формой БВ. В свою очередь, в группе здоровых беременных показатель факультативной микрофлоры был наименьшим и наибольшим в группе с тяжелым БВ. Облигатная и факультативная микрофлора находились в обратной и тесной корреляционной взаимосвязи во всех группах беременных, при этом обилие факультативной микрофлоры положительно коррелировало с тяжестью БВ, тогда как обилие облигатной микрофлоры – имело обратную корреляционную связь.
 Поскольку показатель рН влагалища является результатом метаболизма молочнокислых бактерий, самый низкий рН был обнаружен в группе здоровых беременных, где наблюдалось обилие лактобацилл, в то время как наибольшие значения рН находились в группе пациенток с тяжелым течением БВ. Таким образом, значения показателя рН влагалищной среды на прямую зависели как от тяжести клинического течения БВ, так и от количественной оценкой микрофлоры данного локуса.
Поскольку показатель рН влагалища является результатом метаболизма молочнокислых бактерий, самый низкий рН был обнаружен в группе здоровых беременных, где наблюдалось обилие лактобацилл, в то время как наибольшие значения рН находились в группе пациенток с тяжелым течением БВ. Таким образом, значения показателя рН влагалищной среды на прямую зависели как от тяжести клинического течения БВ, так и от количественной оценкой микрофлоры данного локуса.
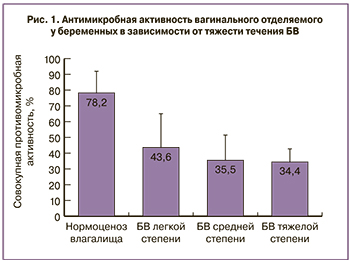
Исследование показало, что наиболее высокая активность АМП обнаружена в группе здоровых беременных, равная 78,2±13,6% (рис. 1).
По мере нарастания тяжести заболевания у инфицированных беременных совокупная активность АМП достоверно снижалась по сравнению с группой здоровых беременных, составляя 43,6±21,2% у женщин с легкой формой БВ, 35,5±15,6% с БВ средней степени тяжести и 34,4±8,2% – у беременных с тяжелым течением БВ (р<0,05). Коэффициент корреляции между противомикробной активностью АМП и степенью выраженности симптомов заболевания выявил отрицательную связь (r=-0,936).
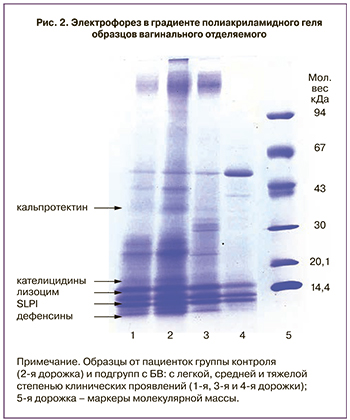
Для определения причины снижения антимикробной активности при БВ мы произвели разделение белков вагинального отделяемого в градиенте полиакриламидного геля (рис. 2).
В полученных образцах определяются полосы, соответствующие антимикробным пептидам. Дорожка № 2 соответствует образцу от беременной из группы контроля (антимикробная активность 100,0%). На дорожке различимы такие полипептиды, как кальпротектин с молекулярной массой порядка 37 кДа, кателицидин hCAP18 (18 кДа), SLPI (около 12 кДа), лизоцим (14,5 кДа), а также дефенсины (менее 5 кДа). Дорожка № 1 – легкая степень клинических проявлений БВ (сумма симптомов 7 баллов, антимикробная активность 66,7%). При этом отсутствует кальпротектин и различимы прочие белки, но полосы не такие интенсивные. Дорожка № 3 – средняя степень клинических проявлений (сумма симптомов 11 баллов, антимикробная активность 21,6%) – не обнаружен кальпротектин и слегка различимы дефенсины. Дорожка № 4 – тяжелый БВ (сумма симптомов 15 баллов, антимикробная активность 0,0%). В ней нет кальпротектина, определяется слабая полоса лизоцима, дефенсины отсутствуют.
Обсуждение
В слизистых репродуктивного тракта отмечается выраженная экспрессия факторов врожденного иммунитета. Отмечается постоянное взаимодействие факторов локальной защиты и условно-патогенной микробиоты влагалища.
Обязательной составной частью микроэкосистемы влагалища являются эндогенные катионные АМП. Они образуются эпителием барьерных тканей и клетками крови (нейтрофилами). Продукция АМП запускается в результате взаимодействия структур микробов с Толл-подобными рецепторами (TLR) клеток, что сопровождается интенсивным образованием провоспалительных цитокинов [9]. АМП кроме антимикробного действия участвуют в регуляции воспаления и в формировании приобретенного иммунитета.
Дисбаланс компонентов врожденного иммунитета: нарушение экспрессии гена ß-дефенсина 1 (HBD1) и TLR в эпителиальных клетках нижних отделов мочеполового тракта и в клетках плаценты является маркером реализации внутриутробной инфекции [9, 10].
Снижение концентраций АМП в отделяемом влагалища у беременных с БВ выявляли и ранее [11], однако изучение этих данных на фоне различной тяжести заболевания практически не проводилось. Из полученных нами результатов можно сделать вывод, что наиболее важными звеньями в противобактериальной защите влагалища у данных пациенток являются кальпротектин, дефенсины и лизоцим.
Изучение антимикробной активности отделяемого нижних отделов репродуктивного тракта у пациенток с БВ показало уменьшение концентраций дефенсинов у данного контингента пациенток по сравнению со здоровыми женщинами и пациентками с вульвовагинальным кандидозом [12, 13]. После проведения курса терапии отмечалась нормализация уровня дефенсинов. Снижение уровня антимикробных пептидов при БВ вызвано уникальной способностью Gardnerella vaginalis к изменению локального иммунного ответа. На клеточной поверхности гарднерелл отсутствуют липополисахариды, а пептидогликаны обнаруживаются в низкой концентрации, и, следовательно, не приводят к должной активации Толл-подобных рецепторов и выработке дефенсинов.
Таким образом, продукция эндогенных антибиотиков – АМП обеспечивает адекватную защиту от инфекционных агентов. Снижение активности АМП приводит к количественному возрастанию факультативной микрофлоры влагалища и истощению облигатной микрофлоры, что способствует более выраженному клиническому течению БВ.
Заключение
Расширение диагностических параметров в комплексе обследования беременных с воспалительными и дисбиотическими нарушениями в нижних отделах репродуктивного тракта, путем включения показателей системного и локального иммунитета, наряду с микробиологическим мониторингом с использованием интегральной оценки состояния микробиоценоза влагалища, позволит персонифицировать терапевтические подходы для каждой конкретной пациентки.



