Введение
За последнее десятилетие лечение немекоклеточного рака легкого (НМРЛ) претерпело значимые изменения. Появление таргетной терапии, а также иммунотерапии позволили предложить пациентам лечение, которое не только существенно увеличивает выживаемость, но и сохраняет качество жизни.
На сегодняшний момент все мировые стандарты обследования пациентов с аденокарциномой легкого подразумевают исследование опухолевой ткани на наличие драйверных мутаций с целью последующего использования нацеленных на них таргетных препаратов [1–3].
Одной из основных мишеней для таргетной терапии при НМРЛ стал тирозин-киназный рецептор ALK, который впервые был описан в качестве возможной терапевтической мишени в 2007 г. [4]. В случае транслокации между 2-й и 5-й хромосомами происходит прикрепление гена ALK к гену EML4, что приводит к продукции измененного рецептора ALK, не требующего лиганда для его стимуляции. Тестирование на наличие транслокации ALK входит в стандарт обследования пациентов с метастатическим НМРЛ и может быть проведено несколькими методами: FISH (fluorescence in-situ hybridization), ИГХ (иммуногистохимическое исследование), ПЦР (полимеразная цепная реакция) [5].
Транслокация выявляется примерно в 5% НМРЛ. Такая опухоль чаще имеет строение аденокарциномы и встречается у молодых некурящих пациентов. Эти характеристики не имеют существенного отличия от таковых у пациентов с мутацией EGFR, хотя в сравнительном проспективном исследовании было показано, что опухоли с транслокацией ALK чаще встречаются у мужчин и пациентов более молодого возраста [6].
На российской популяции И.А. Демидова и др. проанализировали особенности НМРЛ с транслокацией ALK [7]. Результат анализа подтвердил полученные выше данные. Кроме того, женщины с распространенным НМРЛ почти в 4 раза чаще, чем мужчины, имели транслокацию ALK.
Первый ингибитор ALK – кризотиниб – был одобрен FDA (Food and Drug Administration) в 2011 г. после подтверждения эффективности препарата во второй линии лечения. Позднее препарат изучался в качестве первой линии терапии в открытом рандомизированном исследовании PROFILE 1014, опубликованном в 2014 г. [8].
В настоящий момент в РФ одобрены 4 ALK-ингибитора: кризотиниб, церитиниб, алектиниб и лорлатиниб.
Церитиниб является высокоселективным ингибитором ALK 2-го поколения. Результаты доклинических исследований продемонстрировали, что церитиниб способен преодолевать резистентность к кризотинибу за счет большей аффинности к рецептору ALK (повышение аналогичного показателя для кризотиниба в 20 раз), а также за счет проникновения через гематоэнцефалический барьер (ГЭБ) [9, 10].
Клинические исследования церитиниба у предлеченных больных ALK+НМРЛ
Впервые церитиниб изучался в клиническом исследовании ASCEND-1, куда были включены пациенты с распространенными ALK-позитивными злокачественными опухолями, включая НМРЛ (в т.ч. получавшие ранее терапию ALK-ингибиторами). Первичной конечной точкой было определение максимально переносимой дозы, вторичными конечными точками стали оценка профиля безо-пасности, фармакокинетики и противоопухолевой активности церитиниба. В исследовании приняли участие 130 пациентов. В фазе эскалации дозы церитиниб назначали перорально 1 раз в сутки начиная с 50 мг и заканчивая 750 мг. С учетом дозолимитирующей токсичности, включая тошноту, рвоту, диарею, обезвоживание, повышение уровня аланинаминотрансферазы (АЛТ) и гипофосфатемию, максимально переносимая доза была определена как 750 мг/сут.
Среди 114 пациентов с НМРЛ, получавших как минимум 400 мг церитиниба в сутки, частота объективных ответов (ЧОО) составила 58% (95% доверительный интервал [ДИ]: 48–67). При этом у 80 испытуемых, которым ранее проводилась терапия кризотинибом, в т.ч. с метастазами в головном мозге (ГМ), объективный ответ был достигнут в 56% случаев (95% ДИ: 45–67). Общая медиана выживаемости без прогрессирования (ВБП) составила 7 месяцев (95% ДИ: 5,6–9,5) [11]. В апреле 2014 г. данные результаты послужили поводом к ускоренному одобрению церитиниба FDA для лечения пациентов с ALK-позитивным метастатическим НМРЛ [12], а в 2015 г. данный препарат также получил одобрение EMA (European Medicines Agency).
В 2016 г. в журнале The Lancet были опубликованы обновленные результаты исследования ASCEND-1 [13], в котором были проанализированы все пациенты с ALK-позитивным НМРЛ, получавшие церитиниб в дозе 750 мг/сут в рамках I фазы. Данные результаты подтвердили эффективность церитиниба в качестве лечения пациентов как не получавших, так и получавших ранее терапию ALK-ингибиторами, с точки зрения медианы продолжительности ответа и медианы ВБП.
Так, при медиане наблюдения в 11,1 месяца медиана продолжительности ответа в первой группе составила 17 месяцев (95% ДИ: 11,3 – не достигнута – НД) при медиане ВБП в 18,4 месяца (95% ДИ: 11,1–НД), а во второй группе – 8,3 месяца (95% ДИ: 6,8–9,7) при медиане ВБП 6,9 месяца (95% ДИ: 5,6–8,7). Кроме того, интракраниальный ответ наблюдался в 63% случаев у пациентов с отсутствием терапии кризотинибом в анамнезе и в 36% случаев у испытуемых, ранее получавших ALK-ингибиторы 1-го поколения. Важно отметить, что объективные ответы были отмечены также и в когорте пациентов, получавших ранее лучевую терапию на ГМ, что указывает на проникновение церитиниба через ГЭБ. Серьезные побочные эффекты наблюдались у 48% испытуемых, при этом наиболее частыми нежелательными явлениями (НЯ) 3–4-й степеней были повышение уровней АЛТ (30%) и аспартатаминотрансферазы – АСТ (10%), а также диарея (6%).
В исследовании ASCEND-6 [14] была отдельно проанализирована китайская популяция пациентов с распространенным ALK-позитивным НМРЛ, ранее получавших терапию кризотинибом. Фармакокинетика церитиниба у этих больных соответствовала результатам, полученным в ASCEND-1. Церитиниб продемонстрировал хорошую переносимость, а также длительные ответы у пациентов, имевших прогрессирование после одной или двух линий химиотерапии (ХТ), а также после терапии кризотинибом.
В открытом многоцентровом исследовании II фазы ASCEND-2 [15] приняли участие 140 испытуемых с распространенным НМРЛ с реаранжировкой ALK, получавших как минимум одну линию платиносодержащей ХТ и спрогрессировавших на фоне приема кризотиниба в качестве последней линии лечения. К участию допускались пациенты с бессимптомными и стабильными метастазами в ГМ.
Результаты исследования ASCEND-2 оказались сопоставимыми с ASCEND-1. При медиане наблюдения 11,3 месяца объективные ответы были достигнуты быстро (медиана времени до реализации эффекта – 1,8 месяца) и длились продолжительно: медиана длительности ответа – 9,7 месяца (95% ДИ: 7,1–11,1)). ЧОО составила 38,6% (95% ДИ: 30,5–47,2), по метастазам в ГМ – 45% (95% ДИ: 23,1–68,5)), при этом контроль заболевания достигался в 77,1% (95% ДИ: 69,3–83,8), а по метастазам в ГМ – в 80% (95% ДИ: 56,3–94,3) случаев. Медианы ВБП и общей выживаемости (ОВ) составили 5,7 (95% ДИ: 5,4–7,6) и 14,9 месяца (95% ДИ: 13,5 – НД) соответственно.
Среди НЯ лидировала гастроинтестинальная токсичность: диарея, тошнота и рвота, ассоциированные с лечением, присутствовали более чем у 75% испытуемых, с токсичностью 3–4-й степеней в 6,4%; 5,7 и 4,3% случаев соответственно. Прекращение терапии церитинибом из-за данных НЯ потребовалось в 2,1% пациентов. Кроме гастроинтестинальной токсичности наиболее часто встречались такие побочные эффекты, как повышение уровней АЛТ и γ-глутамилтрансферазы (ГГТ) 3–4-й степеней: в 15,7 и 9,3% случаев соответственно. Серьезные НЯ, ассоциированные с терапией церитинибом, были зарегистрированы у 17,1% пациентов. Среди них наблюдались пневмониты (1,4%) и удлинение интервала QT (7,9%), в т.ч. 3–4-й степеней у одного из испытуемых. Другие важные НЯ на фоне лечения церитинибом включали гипергликемию и брадикардию 1–2-й степеней.
Еще одно однорукавное исследование II фазы ASCEND-3 [16] было инициировано для оценки эффективности и безопасности применения церитиниба у предлеченных пациентов с распространенным ALK-позитивным НМРЛ, не получавших терапию ALK-ингибиторами, которым было проведено не менее трех линий ХТ. Как и в ASCEND-2, наличие бессимптомных и стабильных метастазов в ГМ, а также радиотерапия на ГМ в анамнезе, завершенная как минимум за 2 недели до начала приема церитиниба, допускались протоколом исследования.
В качестве первичной конечной точки была выбрана ЧОО. ВБП, ОВ и оценка безопасности вошли в число исследуемых вторичных конечных точек. Финальные результаты анализа ОВ и НЯ были опубликованы в 2019 г. По оценкам исследователей, ЧОО и уровень контроля заболевания составили 67,7% (95% ДИ: 58,8–75,9), по метастазам в ГМ – 20% (95% ДИ: 2,5–55,6) и 90,3%, по метастазам в ГМ – 80% (95% ДИ: 44,4–97,5) соответственно, при этом среди 124 пациентов было зарегистрировано 2 полных и 82 частичных ответа. Медиана ВБП достигла 16,6 месяца (95% ДИ: 11,0–23,2), а медиана ОВ превысила 4 года: 51,3 месяца (95% ДИ: 42,7–55,3). С точки зрения побочных эффектов по-прежнему лидировала гастроинтестинальная токсичность, а диарея, тошнота, рвота и снижение аппетита 3–4-й степеней были зарегистрированы в 3,2%, 8,1, 6,5 и 3,2% случаев.
В открытом рандомизированном исследовании III фазы ASCEND-5 [17] было проведено сравнение церитиниба в дозе 750 мг/сут с ХТ доцетакселом или пеметрекседом у пациентов с местно-распространенным или метастатическим ALK-позитивным НМРЛ, которые ранее получали терапию кризотинибом (в любой момент до включения в исследование), а также ХТ (включая платиновый дублет). В исследовании допускался кроссовер, т.е. в случае прогрессирования на фоне ХТ было разрешено начать лечение церитинибом. Первичной конечной точкой была ВБП, вторичными конечными точками стали ОВ, ЧОО, частота интракраниальных ответов, длительность ответа и частота контроля заболевания (в т.ч. со стороны метастазов в ГМ), а также время до реализации эффекта.
Исследование оказалось позитивным: медиана ВБП в исследуемой группе составила 5,4 месяца по сравнению с 1,6 в контрольной группе (отношение рисков [ОР]=0,49, 95% ДИ: 0,36–0,67; p<0,0001). ЧОО в группе церитиниба составила 39,1% (95% ДИ: 30,2–48,7) по сравнению с 6,9% в группе химиотерапии (95% ДИ: 3,0–13,1). Кроме того, контроль заболевания был достигнут в 76,5% (95% ДИ: 67,7–83,9) случаев в исследуемой группе и в 36,2% (95% ДИ: 27,5–45,6) случаев в контрольной. Различий с точки зрения ОВ на момент анализа данных продемонстрировано не было, однако это может быть объяснено тем, что 75% пациентов был назначен церитиниб после прогрессирования на фоне ХТ, что допускалось дизайном исследования. Частота и тип НЯ соответствовали результатам ASCEND-1, ASCEND-2 и ASCEND-3.
Отдельно следует отметить исследование ASCEND-7 [18], задачей которого стала оценка эффективности и безопасности терапии церитинибом у пациентов с ALK-позитивным НМРЛ с интракраниальными и/или лептоменингеальными метастазами. Все испытуемые были распределены в 5 групп в зависимости от предыдущего применения ALK-ингибиторов и радиотерапии на ГМ. Первичной конечной точкой стала ЧОО. Вторичными конечными точками были выбраны уровень контроля заболевания и частота интра- и экстракраниальных ответов. В первую группу (n=42) вошли пациенты, ранее получавшие как ALK-ингибиторы, так и радиотерапию (ЛТ), во вторую (n=40) – только предлеченные ALK-ингибиторами, в третью (n=12) – только пациенты с предшествовавшей ЛТ, а в последнюю группу (n=44) – пациенты без ЛТ и терапии ALK-ингибиторами в анамнезе. Отдельную группу (n=18) составили пациенты с лептоменингеальными метастазами (ЛММ).
Применение церитиниба привело к высокой ЧОО (95% ДИ) у испытуемых, ранее не получавших терапию ALK-ингибиторами, а именно 50% (21,1–78,9) и 59,1% (43,2–73,7) в третьей и четвертой группах соответственно, в то время как в первой и второй группах ЧОО 95% ДИ составила 35,7% (21,6–52,0) и 30% (16,6–46,5) соответственно. При этом контроля заболевания удалось достичь в 66,7% (50,5–80,4), 82,5% (67,2–92,7), 66,7% (34,9–90,1) и 70,5% (54,8–83,2) случаев в первой, второй, третьей и четвертой группах соответственно. Интракраниальные объективные ответы (95% ДИ) наблюдались у 39,3% (21,5–59,4) пациентов из первой, 27,6% (12,7–47,2) из второй, 28,6% (3,7–71,0) из третьей и 51,5% (33,5–69,2) из четвертой групп. В пятой группе ЧОО составила 16,7% (95% ДИ 3,6–41,4), а уровень контроля заболевания достиг 66,7% (95% ДИ: 41,0–86,7). Кроме того, результаты анализа спинномозговой жидкости и плазмы еще раз подтвердили, что церитиниб способен проникать через ГЭБ. Суммарные данные по исследованию представлены в таблице.
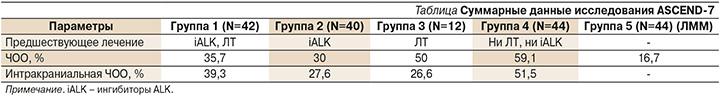
Таким образом, церитиниб продемонстрировал высокую эффективность в лечении больных ALK-позитивным НМРЛ с активными интракраниальными и/или лептоменингеальными метастазами и может рассматриваться в качестве терапии пациентов данной когорты. Стоит отметить, что наибольшую эффективность препарат имеет при использовании его на наиболее ранних этапах терапии.
Клинические исследования церитиниба в первой линии терапии ALK+НМРЛ
С целью изучения эффективности церитиниба в первой линии терапии было проведено рандомизированное исследование III фазы ASCEND-4 [19], в котором сравнивалось применение исследуемого препарата в дозе 750 мг/сут и ХТ пеметрекседом и цисплатином/карбоплатином с последующей поддерживающей терапией пеметрекседом больных, не получавших ранее лечения.
Первичной конечной точкой была выбрана оценка ВБП. В исследовании приняли участие 376 пациентов, которые были рандомизированы в соотношении 1:1: в группу церитиниба вошли 189 человек, в группу стандартной ХТ – 187.
Данное исследование достигло первичной конечной точки: медиана ВБП в группе церитиниба составила 16,6 месяца против 8,1 в контрольной группе. Применение церитиниба в первой линии лечения привело к снижению риска прогрессирования на 45% по сравнению со стандартной ХТ (ОР=0,55, 95% ДИ: 0,42–0,73; p<0,00001, см. рисунок). У пациентов без интракраниальных очагов (n=126; 34%) медиана ВБП в группе церитиниба составила 26,3 месяца против 8,3 в группе ХТ (ОР=0,48, 95% ДИ: 0,33–0∙69). В исследуемой группе с метастазами в ГМ (n=121; 32%) наблюдалась тенденция к увеличению медианы ВБП по сравнению с контрольной (10,7 против 6,7 месяца; ОР=0,70, 95% ДИ: 0,44–1,12]), однако результаты не достигли статистической значимости.
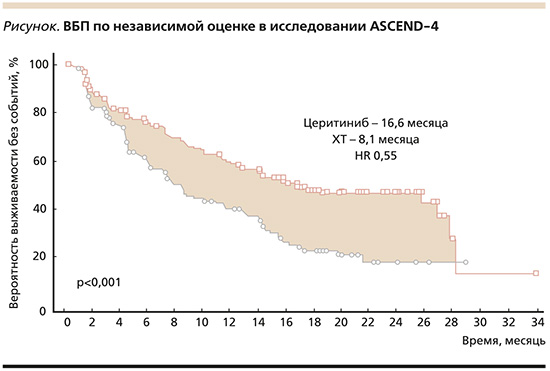
Тем не менее использование церитиниба привело к высокой частоте общего интракраниального ответа у пациентов с измеряемыми очагами в ГМ – 72,7% (49,8–89,3), в то время как на фоне ХТ ответ составил лишь 27,3% (10,7–50,2). ЧОО для всех пациентов составила 72,5% в исследуемой группе и 26,7% – в контрольной. Медиана времени до реализации эффекта составляла 6,1 недели для церитиниба и 13,4 – для ХТ. Таким образом, эффект таргетной терапии развивался быстрее, более чем в 2 раза. Профиль токсичности был сопоставимым с результатами предыдущих исследований.
Несмотря на то что не проводилось прямого сравнения препаратов 1-го и 2-го поколений, данные ASCEND-4 отражают значимую пользу при применении церитиниба в качестве первой линии. В связи с этим в 2017 г. препарат был одобрен FDA для первой линии лечения пациентов с ALK-позитивным метастатическим НМРЛ.
Клинические исследования церитиниба в различных дозовых режимах
Ранее при изучении других тирозинкиназных ингибиторов было доказано, что их прием вместе с пищей приводит к снижению токсичности со стороны желудочно-кишечного тракта [20]. В исследовании церитиниба на здоровых добровольцах было обнаружено, что употребление пищи с низким содержанием жиров повышает концентрацию препарата в плазме крови (Cmax), а также площадь под фармакокинетической кривой (AUC). Таким образом, необходимо избегать приема церитиниба в дозе 750 мг вместе с пищей, поскольку это может приводить к усилению токсичности [21].
С целью улучшения переносимости терапии церитинибом было инициировано рандомизированное исследование I фазы ASCEND-8 [22], в котором сравнивались различные дозовые режимы, а именно 450 мг, 650 и 750 мг в сутки, в т.ч. в сочетании с приемом нежирной пищи. Равномерно распределены в 3 группы были 137 пациентов. В первых двух группах (n=44 и n=47) испытуемые принимали церитиниб в дозах 450 и 650 мг соответственно вместе с приемом пищи пониженной жирности, а в третьей группе (n=46) – 750 мг церитиниба натощак. Ранее не получали противоопухолевого лечения 28,5% больных, всем остальным проводили как минимум 3 линии системной терапии, включая применение кризотиниба в 48,2% случаев.
Такие фармакокинетические показатели, как Cmax и AUC0–24, были сопоставимыми при применении дозы 450 мг вместе с пищей и 750 мг натощак. Для дозы 600 мг значения данных параметров оказались приблизительно на 25% выше. С точки зрения токсичности, прием дозы 450 мг был наиболее безопасным со стороны желудочно-кишечного тракта, при этом 43,2% гастроинтестинальных НЯ были 1-й степени. Диарея, тошнота и рвота развивались в 47,7%, 45,5 и 22,7% случаев соответственно, что на 15–20% меньше, чем при применении дозы 750 мг, при этом отсутствовала токсичность 3–4-й степеней, а также был зарегистрирован всего один случай прекращения терапии. Среди других НЯ встречались боли в животе (22,7%), повышение уровней ГГТ (25%), АЛТ (27,3%) и АСТ (25%), снижение аппетита (27,3%), снижение массы тела (20,5%) и общая слабость (11,4%). Стоит отметить, что частота гепатотоксичности оказалась примерно на том же уровне, что и при использовании дозы 750 мг. Таким образом, было доказано, что применение церитиниба в дозе 450 мг вместе с приемом пищи имеет сопоставимую с приемом дозы 750 мг натощак системную экспозицию, а также более благоприятный профиль безопасности.
Во второй части исследования ASCEND-8 [23] проводилось сравнение эффективности трех вышеуказанных дозовых режимов. В результате ЧОО составила 78,1%, 72,5 и 75,7% при использовании доз 450 мг, 650 и 750 мг соответственно. Кроме того, в группе пациентов, получавших 450 мг церитиниба, наблюдались самая высокая медиана относительной интенсивности дозы (100 против 78,5%, против 83,7%), наименьшая частота редукций дозы (24,1 против 65,1%, против 60,9%), а также наименьшая встречаемость гастроинтестинальной токсичности (75,9 против 82,6%, против 91,8%). На основании результатов данного исследования доза 450 мг/сут во время еды была внесена в российскую инструкцию по применению церитиниба [24], поскольку такая схема делает использование препарата не только более безопасным, но и более выгодным с финансовой стороны. Так, это позволяет сократить стоимость курса терапии в 2 раза по сравнению с использованием других ALK-ингибиторов как 1-го, так и 2-го поколенийй, зарегистрированных в РФ.
Клинические рекомендации
Согласно рекомендациям NCCN (v03.2023), церитиниб может быть рассмотрен в качестве первой линии терапии НМРЛ c транслокацией ALK, а также во второй линии после использования кризотиниба [1]. Аналогичные рекомендации по использованию препарата дает ESMO [2].
В рекомендациях Минздрава РФ, сформулированных АОР, использование церитиниба в дозе 450 мг/сут возможно в первой линии терапии НМРЛ с транслокацией ALK либо во второй линии при прогрессировании или развитии непереносимой токсичности на фоне терапии кризотинибом. Также отдельно отмечено, что, если в первой линии лечения применялся алектиниб при невозможности своевременного применения ингибитора протеинкиназ ALK 3-го поколения, показано использование церитиниба или ХТ [3].
Заключение
Церитиниб – это ALK-ингибитор 2-го поколения, демонстрирующий клиническую эффективность как в первой, так и в последующих линиях терапии НМРЛ с транслокацией ALK, что подтверждается данными рандомизированных клинических исследований. В связи с отсутствием прямого сравнения препаратов 2-го и 3-го поколений в первой линии лечения, невозможно однозначно высказаться о преимуществе какого-либо из них по этому показанию. В то же время следует отметить финансовую привлекательность церитиниба по сравнению с другими препаратами той же группы. Широкий спектр лекарственных опций увеличивает возможности лечения молодых и социально активных пациентов, страдающих ALK-позитивным НМРЛ.



