Введение
Цирроз печени (ЦП), необратимое нарушение архитектоники печеночной паренхимы, приводящее к различным осложнениям (портальной гипертензии, асциту, кровотечениям из варикозно расширенных вен пищевода и желудка и др.), является следствием хронического воздействия различных патогенных факторов, на первое место среди которых в настоящее время выходят алкоголь и вирусы гепатитов В и С.
Эпидемиология
По данным ВОЗ за 2010 г., употребление алкоголя в Европе возросло и в среднем составило 9,24 литра чистого спирта на душу населении. Употребление алкоголя является ведущей причиной заболеваний печени, в т. ч. ЦП. Смертность от ЦП с 1990 по 2006 г. оказалась самой высокой и продолжает расти в России, Белоруссии, на Украине, в Эстонии, Латвии, составив к 2005 г. примерно 60,5 на 100 тыс. мужского населения и 40 на 100 тыс. – женского. В странах западной Европы, а также в Болгарии, Польше, Сербии, Турции показатели смертности от ЦП ниже и остаются стабильными (20–40 на 100 тыс. мужского населения и 6–17 на 100 тыс. – женского) [28].
По данным отечественных авторов, в России с 1980 по 2001 г. уровень смертности от ЦП вырос в 2 раза (с 10,0 до 20,9 на 100 тыс. населения) [5]. Однако по данным Г.А. Ястребова, А.Н. Красилова, показатель смертности от ЦП за 2000–2002 гг. в России даже выше и составил 35,7 на 100 тыс. населения, уступив лишь “рекордсменам” по этому показателю – Венгрии, Украине, Румынии и Казахстану, где показатель равен 40 на 100 тыс. населения [12].
 По данным А.И. Хазанова, первое место по распространенности и частоте летальных исходов у стационарных больных занимает алкогольный ЦП (АЦП) [11]. С 1946 по 2005 г. шестикратный рост потребления алкоголя привел к увеличению числа больных АЦП в 8,5 раз, тогда как число всех больных ЦП возросло в 4,1 раза [9].
По данным А.И. Хазанова, первое место по распространенности и частоте летальных исходов у стационарных больных занимает алкогольный ЦП (АЦП) [11]. С 1946 по 2005 г. шестикратный рост потребления алкоголя привел к увеличению числа больных АЦП в 8,5 раз, тогда как число всех больных ЦП возросло в 4,1 раза [9].
По данным, представленным в постановлении РАМН “Современное состояние проблемы цирроза печени” в 2009 г., больные ЦП составили около 30 % больных хроническими диффузными заболеваниями печени, находившихся на лечении в специализированных стационарах. При этом частота АЦП была 40 %, ЦП вирусной этиологии – 28 % [7].
Последнее время все чаще встречаются работы, посвященные алкогольно-вирусному поражению печени [6, 15]. Так, около 25–28 % больных АЦП инфицированы НСV (Hepatitis C virus) и 30 % инфицированных НСV хронически злоупотребляют алкоголем [6, 24]. Данные литературы говорят, что сочетанное поражение печени сопряжено с более быстрым темпом развития ЦП, снижением циррогенной дозы алкоголя, более тяжелым течением болезни и высокой смертностью [10, 15].
Частота циррозов в многопрофильном стационаре за 14 лет (1996–2010) составила 0,44 %, при этом летальность от ЦП превысила общегоспитальную в 7,2 раза (9,8 против 1,36 %). Алкогольная этиология ЦП наблюдалась в 46,3 %, вирусная – в 41,1 %. Летальность при АЦП составила 14,1 %, при ЦП вирусной этиологии – 3,5–6,3 %.
Средний возраст лиц, умерших от ЦП, составил 57,8 года [1]. Высокая распространенность и крайне высокая смертность больных, страдающих ЦП, делают актуальным изучение эпидемиологических и прогностических аспектов заболевания.
Для изучения частоты, этиологии и причин смерти больных ЦП алкогольной и смешанной этиологии (алкогольной и вирусной В и С) нами был проведен анализ всех историй болезни пациентов, поступивших в гастроэнтерологическое отделение многопрофильного стационара в 2011 и 2012 гг.
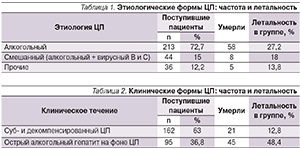
За два года в гастроэнтерологическое отделение поступили 2605 больных, из них с ЦП – 293 (11,24 %; из них мужчин – 176, женщин – 117; средний возраст – 50,31 ± 12,09 года). За исследуемый период умерли 80 больных, из них с ЦП – 71 (88,75 %; мужчин – 44, женщин – 27; средний возраст – 53,92 ± 11,96 года). Среди пациентов с ЦП АЦП наблюдался у 213 (72,7 %), из них умерли 58 (27,2%) человек; смешанный ЦП (алкогольный + вирусный В и С) – у 44 (15 %), из них умерли – 8 (18 %); прочие – у 36 (12,2 %), из них умерли – 5 (13,8 %). В структуре прочих циррозов: ЦП неуточненной этиологии – 19, ЦП вирусной (гепатит С) этиологии – 9, ЦП как исход стеатогепатита – 2, ЦП смешанный (алкогольный и кардиальный) – 4, ЦП смешанный (алкогольный и жировой) – 1, ЦП смешанный (вирусный В и С) – 1 (табл. 1).
Основные причины госпитализации наблюдаемых пациентов:
- Cуб- и декомпенсированные ЦП у пациентов с асцитом, отеками, удовлетворительными биохимическими показателями цитолиза и холестаза, но, как правило, выраженной печеночно-клеточной недостаточностью (гипоальбуминемией, гипокоагуляцией).
- Острый алкогольный гепатит на фоне ЦП у пациентов с выраженной желтушностью кожных покровов, как правило, быстро нарастающими печеночно-клеточной недостаточностью, синдромом цитолиза и энцефалопатией, развивающийся после алкогольных эксцессов.
Пациентов с суб- и декомпенсированными ЦП было 162 (63 %), из них умерли 21 (12,8 %); с острыми алкогольными гепатитами на фоне ЦП – 95 (36,8 %), среди них умерли 45 (48,4 %) (табл. 2).

Причиной смерти стали нарастающая печеночная недостаточность у больных острым алкогольным гепатитом на фоне ЦП – 34 больных; острая постгеморрагическая анемия – 10; печеночно-почечная недостаточность – 17; сочетанная патология – 5. Причины смерти от сочетанной патологии: острая сердечная недостаточность на фоне кардиомиопатии – 1, острая энцефалопатия–суицид – 1, рак легких, метастазы в головной мозг – 1, рак мочевого пузыря, раковая интоксикация – 1, абсцесс ягодичной области, септикопиемия – 1.
Таким образом, доля ЦП у гастроэнтерологических больных составила 11,24 %. Наиболее частым этиологическим фактором ЦП стали алкоголь (72,7 %), алкоголь и вирус гепатита В и С (15 %). Смертность больных ЦП составила 24,2 % (при алкогольном ЦП – 27,2 %, при ЦП смешанной этиоло-гии – 18 %). Ведущей причиной смерти была нарастающая печеночная недостаточность и портальная гипертензия, спровоцированные острым алкогольным гепатитом на фоне ЦП.
Прогностические аспекты
Как видно из результатов нашего исследования, причиной смерти 88,75 % больных был ЦП. Этот показатель превышал таковой летальности в отделении гастроэнтерологии в 8 раз. Эти данные показывают важность изучения прогностических аспектов заболевания с целью оптимизации лечения.
В настоящее время для прогноза и оценки тяжести течения ЦП используются прогностические индексы и модели. Их можно условно разделить на прогностические индексы (коэффициенты тяжести) острого алкогольного гепатита (индекс Меддрея, шкала Глазго, ABIC, Индекс Лилля) и непосредственно прогностические индексы исходов ЦП (Чайлд–Пью, MELD). Они были созданы разными методами и имеют определенные ограничения. Так, например показатели, используемые в критериях Чайлда–Пью, были выбраны эмпирически, не был доказан статистически значимый вклад каждого из них в исход заболевания [20]. Более того, эмпирически созданная модель не отражает вклада каждого фактора в исход заболевания, хотя влияние их может быть различным.
В критериях Чайлда–Пью присутствуют показатели, которые могут быть оценены субъективно, такие как наличие трудно- или легкоконтролируемого асцита, умеренной или выраженной энцефалопатии, что не только усложняет использование шкалы на практике, но и делает крайне нежелательным ее использование в исследованиях, снижает ее ценность при оценке адекватности терапии ЦП. Шкалы, которые используют начисление баллов за какие-либо показатели (Чайлд–Пью и Глазго), имеют еще одно существенное ограничение. Так, пациенты, имеющие уровень билирубина 55 и 600 ммоль/л по шкале Чайлда–Пью, при прочих равных условиях могут быть отнесены к одному и тому же классу цирроза [20], хотя для клинициста разница в этих показателях очевидна. При расчете индекса Меддрея и Чайлда–Пью также не учитываются показатели почечной функции (креатинин, мочевина), которые, по данным литературы последних лет, также существенно влияют на прогноз больных ЦП [13, 17]. Ни один из вышеперечисленных индексов не учитывает наличия кровотечения в анамнезе, хотя, по отечественным данным, после первого эпизода кровотечения умирает каждый второй пациент, более чем у половины из числа выживших в течение первого года возникает рецидив кровотечения, от которого погибают около 30 % больных [7].
Это послужило основанием к разработке индекса, прогнозирующего исход госпитализации пациентов с ЦП с использованием рутинных лабораторных и объективных методов.
Материал и методы
 Был проведен анализ историй болезни 134 пациентов с ЦП алкогольной (81,4 %) и смешанной (алкогольной и вирусной В и С; 18,6 %) этиологии, проходивших лечение в гастроэнтерологическом отделении многопрофильного стационара в 2011–2012 гг. Среди них мужчин – 87, женщин – 47, средний возраст – 50,4 ± 11,7 года. Из них 92 пациента выписались, 42 – умерли в период госпитализации. Средний срок госпитализации составил 23,88 ± 7,49 дня.
Был проведен анализ историй болезни 134 пациентов с ЦП алкогольной (81,4 %) и смешанной (алкогольной и вирусной В и С; 18,6 %) этиологии, проходивших лечение в гастроэнтерологическом отделении многопрофильного стационара в 2011–2012 гг. Среди них мужчин – 87, женщин – 47, средний возраст – 50,4 ± 11,7 года. Из них 92 пациента выписались, 42 – умерли в период госпитализации. Средний срок госпитализации составил 23,88 ± 7,49 дня.
Включение пациентов в исследование осуществлялось при наличии алкогольного анамнеза, портальной гипертензии по данным УЗИ (расширение воротной или селезеночной вен) и/или ЭГДС (варикозное расширение вен пищевода), наличии срока госпитализации не менее 10 дней при условии выписки. При этом наличие маркеров вирусных гепатитов не стало критерием исключения. Из исследования исключались пациенты, у которых отсутствовали какие-либо показатели, выбранные в качестве предикторов.
В качестве предикторов, влияющих на исход госпитализации, были выбраны возраст пациента, рутинные показатели общего анализа крови: эритроциты – ЭР, гемоглобин – Hb, лейкоциты – ЛЦ, тромбоциты – ТЦ, средний объем эритроцитов – MCV, среднее содержание гемоглобина в эритроците – MCH; показатели биохимического анализа крови: уровни глюкозы, общего билирубина, аспартатаминотрансферазы – АСТ, аланинаминотрансферазы – АЛТ, γ-глутаматтрансферазы – ГГТ, щелочной трансферазы – ЩФ, альбумина, креатинина, мочевины, общего белка; показатели коагулограммы: протромбиновое время – ПВ, протромбиновый индекс – ПТИ, международное нормализованное отношение – МНО, активированное частичное тромбопластиновое время – АЧТВ, группа крови; резус-фактор; наличие асцита на момент госпитализации; наличие кровотечения на момент госпитализации или развившегося за время госпитализации; наличие пневмонии на момент госпитализации или развившейся во время госпитализации; пол пациента; наличие маркеров вируса гепатита В и/или С.
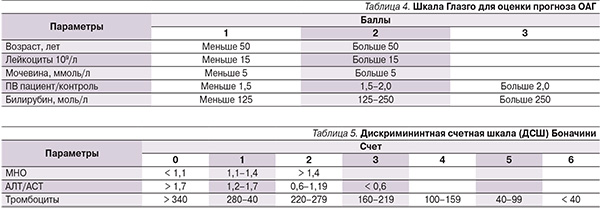
В качестве предикторов были также рассчитаны индексы фиброза (Боначини; табл. 4), тест APRI [27], тест MDA [14], тест GUCI [22], тест HALT-C [25] и прогностические индексы (индекс Меддрея [26], шкала Глазго [18, 19], MELD [23]. ABIC [16].
Способы расчета индексов представлены в табл. 3. Все лабораторные показатели, выбранные в качестве предикторов, были взяты на момент госпитализации.
Индекс по шкале Глазго рассчитывали в зависимости от величины показателей, представленных в табл. 4. За каждый показатель начислялся 1, 2 или 3 балла, далее все баллы суммировали [19].
Индекс Боначини рассчитывался следующим образом: в зависимости от показателей пациента (МНО, коэффициента де Ритиса, числа тромбоцитов) подсчитывали число баллов по табл. 5, баллы за каждый показатель суммировали [2].
Анализ данных проведен с использованием программных пакетов SPSS 13 Statistica 6.
Статистическая обработка данных
В качестве метода обработки данных была выбрана бинарная логистическая регрессия, поскольку наблюдалось два исхода госпитализации: смерть или выписка.
 Вероятность летального исхода: (P) = Exp (z)/[Exp (z) + 1]; Z = b1 × X1 + b2 х Х2 + ...+ bn x Xn + a, где X1 — значения независимых переменных, b1 – коэффициенты, расчет которых является задачей бинарной логистической регрессии, а – некоторая константа.
Вероятность летального исхода: (P) = Exp (z)/[Exp (z) + 1]; Z = b1 × X1 + b2 х Х2 + ...+ bn x Xn + a, где X1 — значения независимых переменных, b1 – коэффициенты, расчет которых является задачей бинарной логистической регрессии, а – некоторая константа.
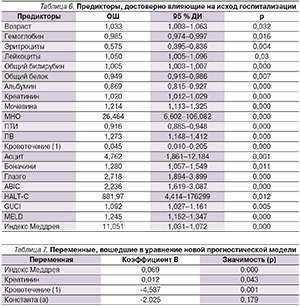
Сначала была проведена моновариантная логистическая регрессия для всех предикторов, в результате которой были отобраны предикторы, влияющие на исход госпитализации (p < 0,05). Для них были вычислены 95 % доверительный интервал (ДИ), отношения шансов (ОШ) и статистическая значимость (p), указанные в табл. 6.
Далее предикторы, достоверно влияющие на исход госпитализации (p < 0,05), были включены в многовариантную логистическую регрессию. Предварительно из анализа исключали взаимозависимые предикторы. В анализ программой были включены 110 пациентов из 134 (79 – выписавшихся, 31 – умерший), поскольку в отсутствие данных происходило построчное удаление случая.
Методом прямой селекции в уравнение были последовательно включены переменные, демонстрирующие сильную корреляцию с зависимой переменной (исходом), были вычислены константа уравнения и коэффициенты независимых переменных. В табл. 7 представлены независимые переменные, выбранные методом прямой селекции, их коэффициенты и значимость. Подставив коэффициенты, полученные для переменных в уравнение, получим:
Вероятность летального исхода: (P) = Exp (z)/(Exp (z) + 1); Z = -2,025 + 0,069 × (Индекс Меддрея) + 0,012 × (креатинин) - 4,537 × (Кров),где Индекс Меддрея – число баллов по уравнению 4,6 х (ПВ больного – ПВ контроля) + сывороточный билирубин (мг%).
Креатинин – уровень сывороточного креатинина (ммоль/л).
Кров – наличие кровотечения за время госпитализации. Если кровотечения не было, коэффициент умножали на 1, если было – на 0.
Подставив Z в формулу (Р), получим вероятность летального исхода за время госпитализации. Если Р стремится к 0, исход госпитализации благоприятен, если Р стремится к 1, высока вероятность летального исхода.
По первым буквам переменных, входящих в уравнение, модели была дана аббревиатура КИМК (кровотечение, индекс Меддрея, креатинин).
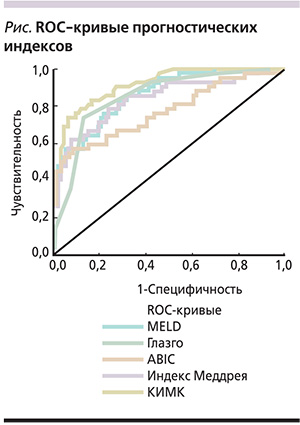
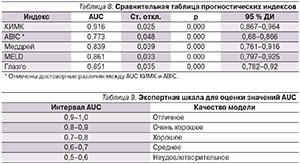
Вероятность летального исхода по разработанной формуле была определена для 134 больных ЦП, после чего для известных нам прогностических индексов были построены ROC-кривые (см. рисунок) и посчитана площадь под кривой (AUC – Area under the curv) (табл. 8).
Поскольку AUC для КИМК лежит в интервале от 0,9 до 1,0, качество модели можно оценить как «отличное» по экспертной шкале для оценки значений AUC (табл. 9) [21].
Выводы
Разработанный индекс (КИМК) для прогноза госпитальной летальности пациентов с ЦП показал сильную зависимость высокого уровня госпитальной летальности от гипербилирубинемии, состоявшегося желудочно-кишечного кровотечения, функции почек, а также синтетической функции печени.
 Лечение больных ЦП можно считать эффективным, если оно приводит к улучшению прогноза заболевания. Мы использовали КИМК для оценки эффективности терапии пациентов с ЦП алкогольной этиологии, проходивших лечение препаратом Ропрен (Solagran Ltd., Австралия), обладающим гепато- и нейропротективным действиями [3, 4].
Лечение больных ЦП можно считать эффективным, если оно приводит к улучшению прогноза заболевания. Мы использовали КИМК для оценки эффективности терапии пациентов с ЦП алкогольной этиологии, проходивших лечение препаратом Ропрен (Solagran Ltd., Австралия), обладающим гепато- и нейропротективным действиями [3, 4].
К исследованию приняты 30 больных алкогольным ЦП класса А по Чайльд–Пью – 10, класса В – 13, класса С – 7. Мужчин было 20, женщин – 10, средний возраст составил 48,3 ± 10,2 года. Препарат назначали в дозе 144 мг 3 раза в сутки в течение 4 недель. Лечение препаратом Ропрен привело к достоверному снижению показателей цитолиза (АСТ, АЛТ), холестаза (билирубина, ЩФ, ГГТ), степени энцефалопатии по цифровому тесту, индекса фиброза Боначини, выраженности симптомов нейропатии по шкале Янга и нейропатическому симптоматическому счету [3]. Ретроспективное определение КИМК до и после лечения показало, что наблюдалось его достоверное снижение с 0,0123 ± 0,0178 до 0,0096 ± 0,0164 (р = 0,027). Полученные данные свидетельствует о том, что назначение препарата Ропрен на стационарном этапе лечения достоверно улучшает краткосрочный прогноз пациентов с АЦП.
Заключение
Проведенное эпидемиологическое исследование показало крайне высокую госпитальную летальность больных ЦП алкогольной и смешанной (алкогольной и вирусной) этиологии. С целью оптимизации лечебной тактики были изучены предикторы, высококоррелирующие с исходом госпитализации, и разработан прогностический индекс (КИМК) госпитальной летальности пациентов. Определение данного индекса до и после лечения позволяет проводить оценку эффективности терапии ЦП, основанную на степени ее влияния на прогноз заболевания.



