Введение
В современной медицине растет количество исследований, посвященных острым нарушениям сознания у госпитализированных пациентов. Одним из таких нарушений сознания является делирий. В настоящее время большинство исследователей и практикующих врачей рассматривают делирий как осложнение пребывания в ОРИТ.
При этом непосредственно само понятие «делирий» определяется как состояние острого помрачения сознания, главным признаком которого является резкое нарушение когнитивных функций [1–2, 31].
Согласно определению DSM-V, делирий представляет собой глобальную дисфункцию мозга, поэтому когнитивные нарушения, возникающие при этом состоянии, весьма разно-образны [1]. Показано, что нарушается сразу несколько когнитивных функций: память, ориентация, внимание, зрительно-пространственные функции, аффективная сфера, возникают нарушения цикла сна и бодрствования [1, 31]. По психомоторным проявлениям делирий делится на три типа: гиперакитвный, гипоакивный и смешанный делирий [2]. Гиперактивный делирий характеризуется психомоторным возбуждением, беспокойством, эмоциональной лабильностью и иногда ошибочно принимается за первичный психоз, манию или деменцию. Гипоактивный делирий характеризуется психомоторной заторможенностью, вялостью, снижением уровня бодрствования и часто пропускается или ошибочно диагностируется как депрессия. Смешанный делирий характеризуется чередованием признаков, характерных как для гипоактиного, так и для гиперактивного типа дилирия. По данным J. Peterson, именно смешанный делирий является самым частым (составляя 54,1% от всех случаев), на втором месте – гипоактивный делирий (43,5%). При этом гипоактивный делирий часто (в 66–84% случаев) остается невыявленным и, соответственно, эти пациенты не получают должного лечения [3–4].
Актуальность проблемы
Делирий по определению является психиатрическим расстройством и зачастую требует консультации психиатра, однако врачи практически всех специальностей сталкиваются с проблемой делирия. Частота делирия у госпитализированных пациентов составляет 20–70% [5–6], при этом у пожилых пациентов эта цифра выше, достигая 87% [7]. В отделении реанимации и интенсивной терапии частота делирия достигает 80% и самые высокие показатели частоты делирия отмечаются у пациентов, находящихся на аппарате искусственной вентиляции легких, достигая 85% [6, 8, 9]. Так же остро стоит проблема послеоперационных делириев, кроме того, у пациентов, которым осуществляется лечение по случаю заболеваний и травм костно-мышечной системы, периферической и центральной нервной системы; частота делирия колеблется у них от 9 до 87%, показывая прямую корреляцию с объемом оперативного вмешательства [10–11].
Делирий в ОРИТ является независимым предиктором более длительного пребывания в стационаре [5–8]. Дополнительно в ряде исследований показано, что делирий увеличивает пребывание в ОРИТ на 1 день и пребывание в стационаре на 2 дня [2].
В работах E.W. Ely и Z. Zhang показано что, делирий приводит к росту числа койко-дней пребывания на ИВЛ, а также к повышению смертности среди пациентов в ОРИТ [13, 14]. Вместе с тем среди осложнений делирия важную роль играет значительное повышение частоты непреднамеренного удаления катетеров, эндотрахеальных трубок, мочевых катетеров, увеличиваются риски травм, связанных с психомоторным возбуждением пациента [15–17].
Кроме того, в долгосрочных исследованиях установлено, что у госпитализированных пациентов с делирием наблюдаются стойкие когнитивные нарушения [18, 19]. В недавнем исследовании, проведенном Aaron Jason Bilek, показано, что делирий ухудшает реабилитационный прогноз и негативно влияет на показатели функциональной независимости у пациентов с инсультом [20]. Кроме того, немаловажны экономические последствия делирия: повышая койко-день в ОРИТ и в стационаре, делирий увеличивает экономические расходы на стационарное лечение.
Факторы риска возникновения делирия
Согласно проведенному анализу литературных данных, факторы риска возникновения делирия можно разделить на две основные группы: модифицируемые и немодифицируемые. Кроме того, дополнительно определены факторы риска, специфические для отделений реанимации (табл. 1). Важно отметить, что те факторы риска, на которые медицинский персонал ОРИТ может влиять, должны быть устранены в кратчайшие сроки [29].

Необходимо отменить, что гипер-активный делирий наиболее часто встречается у пациентов вне отделения интенсивной терапии, в свою очередь гипоактивный (от 24,5 до 43,5%) и смешанные (54,1%) типы делирия чаще характерны для пациентов отделения интенсивной терапии [17]. По данным M. Ali, гиперактивный делирий в отделении интенсивной терапии составляет около 23% случаев [17]. Он характеризуется ажитацией, беспокойством, эмоциональной лабильностью, а также позитивными психотическими чертами, такими как галлюцинации, иллюзии, которые часто мешают оказанию медицинской помощи и порой приводят к самоповреждению пациента. При этом гипоактивный делирий обычно характеризуется спутанностью сознания, седацией, апатией, снижением реакции, замедлением двигательных реакций, вялостью и сонливостью. Данный тип делирия часто недооценивается, но при этом ассоциируется с худшим прогнозом. Наблюдается повышенная 6-месячная смертность по сравнению с пациентами, ранее страдавшими другими подтипами делирия [21]. Смешанный делирий представляет собой сочетание двух вышеописанных форм делирия. Клинически он проявляется сменой в течение суток гипо- и гиперактивных типов делирия. Основные критерии диагностики делирия, согласно DSM-V, представлены в табл. 2.

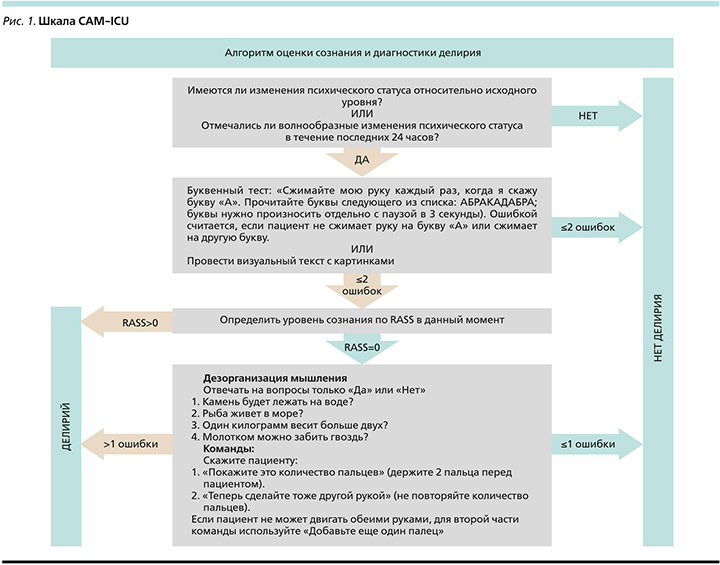
Согласно проведенному анализу литературных данных, посвященных проблеме делирия в ОРИТ, наиболее целесообразно в ходе его оценки применить шкалу CAM-ICU, представленную на рис. 1. Следует отметить, что данная методика может быть использована как врачами, так и средними медицинским персоналом. Оценка по CAM-ICU требует предварительной оценки уровня сознания по шкале RASS.
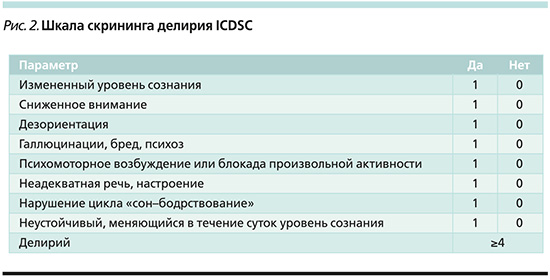
Представленная шкала скрининга делирия ICDSC (рис. 2) представляет собой контрольный список из восьми пунктов на основе критериев DSM и особенностей делирия: измененный уровень сознания, оценка уровня внимания, ориентации, наличие галлюцинаций или бреда, психомоторное возбуждение или заторможенность, нарушение цикла сна/бодрствования и колебания ментального статуса [32].
Согласно результатам проведенных ранее представленных мета-анализов, показана высокая чувствительность (80%) и специфичность (95,9%) шкалы CAM-ICU и несколько меньшая чувствительность (74%) и специфичность (81,9%) шкалы ICDSC у пациентов, находящихся в тяжелом состоянии в отделении реанимации и интенсивной терапии (ОРИТ) [22].
Патофизиология делирия
В основе делирия лежит дисрегуляция активности нейронов головного мозга, к которой приводят изменения в синтезе и функционировании нейромедиаторов и нейротрасмиттеров. Существует несколько гипотез, объясняющих механизмы возникновения делирия. Каждая из гипотез содержит в основании патологический процесс на уровне нейромедиаторов (например, гипотеза избытка дофамина и/или норадреналина или дефицита ацетилхолина или мелатонина) или факторы внешней среды, которые считаются пусковым механизмом (депривация сна, интраоперационная гипоксия, пожилой возраст, использование специфических фармакологических средств). На наш взгляд, одна гипотеза не может объяснить этиологию делирия и, вероятнее всего, имеет место пересечение одновременно нескольких механизмов. Возникновение делирия является следствием взаимодействия между изначальными характеристиками пациента (когнитивный статус, наличие делирия в анамнезе, наличие стресса) и физиологическими нарушениями.
На сегодняшний день существует ряд гипотез развития делирия.
Нейровоспалительная гипотеза
Нейровоспалительная гипотеза предполагает, что в ответ на некий системный воспалительный процесс (инфекционной, хирургической или травматической этиологии) возникает воспалительная реакция в тканях головного мозга и экспрессия провоспалительных цитокинов, фактора некроза опухоли и медиаторов воспаления в центральной нервной системе (ЦНС), что приводит к нейрональной и синаптической дисфункции, которая клинически выражается в аффективных и нейрокогнитивных нарушениях [23]. Также, согласно этой гипотезе, в процессе имеет место нарушение гематоэнцефалического барьера. Воспаление снижает мозговой кровоток из-за образования микроагрегатов фибрина, тромбоцитов, нейтрофилов, эритроцитов в микрососудах головного мозга.
Гипотеза окислительного стресса
Гипотеза окислительного стресса предполагает, что делирий служит следствием нарушения церебрального метаболизма вследствие дефицита оксигенации. Мозг очень восприимчив к гипоксии, к воздействию реактивных форм кислорода, оксида азота, поскольку характеризуется высокой скоростью окислительного метаболизма и низкой антиоксидантной способностью. Как известно, реактивные формы кислорода и оксид азота вызывают окислительный стресс. Окислительный стресс усиливает повреждение мозговой ткани, приводя к когнитивному снижению и развитию стойкого делирия. Неадекватный церебральный метаболизм, вызванный окислительным стрессом, инициирует каскад, приводящий к развитию делирия: неспособность поддерживать ионные градиенты, нарушение метаболизма нейромедиаторов, выработка свободных радикалов, торможение устранения побочных нейротоксических продуктов [24]. Эта гипотеза подтверждается данными исследований, в которых обнаружена корреляция между интраоперационным насыщением кислорода и послеоперационной когнитивной дисфункцией. Среди группы пациентов, перенесших кардиохирургические вмешательства, те, у кого развился делирий, имели более низкий предоперационный и интраоперационный уровень насыщения головного мозга кислородом, а также более низкий уровень гемоглобина до операции по сравнению с пациентами, у которых делирий не развился [24].
Нейротрансмиттерная гипотеза
Согласно этой гипотезе, делирий рассматривается как состояние, возникающее в результате снижения центральной холинергической передачи в сочетании с повышением дофаминергической передачи. Установлено, что избыток дофамина и истощение ацетилхолина связаны с делирием [23]. Другие нейротрансмиттеры, такие как глутамат, гамма-аминомасляная кислота, серотонин и эндорфины, также играют определенную роль. Кроме того, нейротрасмиттерная гипотеза пересекается с гипотезами окислительного стресса и нейровоспаления: нарушения концентрации нейромедиаторов и/или чувствительности к ним рецепторов могут быть вызваны изменениями в окислительном метаболизме головного мозга. Глутамат также высвобождается в условиях нейровоспаления. Существует тесная связь и между гипоксией, а также нарушением синтеза аминокислот, приводящим к снижению уровня ацетилхолина, что позволяет предположить наличие общего механизма в возникновении делирия.
Нейроэндокринная гипотеза
Нейроэндокринная гипотеза предполагает, что делирий представляет собой реакцию на острый или хронический стресс, опосредованную аномально высоким уровнем глюкокортикоидов (ГК). В нормальных условиях ГК помогают организму справляться со стрессовым событием, мобилизуя запасы энергии и подавляя нежизненно важные функции организма. Важно то, что физиологическая реакция на стресс предполагает быстрое возвращение ГК к дострессовому уровню. ГК оказывают широкое действие в ЦНС, начиная от регуляции транскрипции генов, модуляции синаптической структуры, глиальной функции и заканчивая поведением. Согласно нейроэндокринной гипотезе, постоянно высокие уровни ГК снижают способность нейронов выживать после различных метаболических повреждений, возможность адекватного восстановления после стресса [25]. Наибольшее количество рецепторов к ГК в мозге имеет гиппокамп, который и становится мишенью для негативного воздействия высоких уровней ГК, что, по-видимому, и обусловливает когнитивные нарушения.
Авторы статьи полагают, что существует некоторое перекрестное взаимодействие между теориями развития делирия, объясняющее различные фенотипические проявления делирия (гиперактивного, гипоактивного и смешанного), однако необходимы дальнейшие исследования в области патофизиологии этого состояния.
Лечение делирия
Первоочередную роль в лечении делирия играют нелекарственные технологии, которые должны применяться до старта фармакологической терапии. В связи с этим цель применения нелекарственных технологий – устранение модифицируемых факторов, влияющих на развитие делирия (боль, инфекции, электролитные нарушения), восстановление осознания пациентом окружающей обстановки, оптимизация сна. Стратегии, направленные на восстановительную терапию, показали свою эффективность в лечении делирия [26]. Также к методам нефармакологической коррекции относятся ранняя мобилизация, психологическая консультация, устранение факторов внешней среды (громкий шум, свет).
В качестве фармакологических методов лечения делирия чаще всего используются препараты группы нейролептиков. Эти препараты устраняют симптомы психомоторного возбуждения, однако не уменьшают продолжительности делирия. Кроме того, фармакологическое лечение делирия сводится к симптоматической коррекции симптомов.
Препаратом выбора в лечении делирия является галоперидол [27]. Доза галоперидола зависит от возра-ста пациента, наличия коморбидных сердечно-сосудистых заболеваний, психомоторного возбуждения пациента. Среди самых частых побочных эффектов галоперидола встречаются удлинения интервала QT и экстрапирамидные расстройства (особенно у пожилых пациентов).
Также в качестве дополнения или альтернативы галоперидолу используются атипичные антипсихотические препараты (оланзапин, кветиапин). Они обладают благоприятным профилем кардиологической безопасности по сравнению с галоперидолом, также реже вызывают экстрапирамидные нарушения.
Дексмедетомидин – селективный агонист α2-адренорецепторов, который помимо анксиолиза и седации может способствовать регуляции цикла «сон–бодрствование». В лечении делирия этот препарат используется относительно недавно, и его применение при этом состоянии изучается. В недавно проведенном Кокрановском анализе получены следующие данные: дексмедетомидин может сокращать продолжительность делирия и пребывание в отделении интенсивной терапии [28].
Реже для лечения делирия используются препараты группы фенотиазонов (например, аминазин) в связи с недостаточной эффективностью и большим количеством побочных эффектов.
Профилактика делирия
Устранение модифицируемых факторов риска возникновения делирия (табл. 1) снижает частоту и среднюю продолжительность делирия. Также на частоту возникновения делирия положительно влияет воздействие факторов, специфичных для ОРИТ: коррекция сенсорной депривации (календари, часы, улучшение ориентации в месте), ранняя мобилизация, устранение внешних раздражителей. Кроме того, обязательны стратегии профилактики инфекционных осложнений, обезвоживания, запоров и гипоксии [29]. Отказ от делириогенных препаратов или сведение их к минимуму так же важны, как и использование неделириогенных седативных средств. Например, дифенгидрамин, который часто назначают для сна, может вызывать или способствовать развитию делирия из-за своих антихолинергических свойств.
В настоящее время ни одно фармакологическое средство не может быть рекомендовано в качестве профилактики делирия в связи с отсутствием доказательств эффективности.
Для оценки и профилактики делирия также используется мнемоника ABCDEF [30].
- A = ежедневное пробуждение с прерыванием седации;
- B = проведение проб спонтанного дыхания;
- C = координация периодов пробуждения и спонтанного дыхания с участием физиотерапии; выбор оптимального препарата для седации и профилактики делирия;
- D = оценка, профилактика и купирование делирия;
- E = ранняя активизация;
- F = вовлечение семьи и расширение ее возможностей, привлечение семьи к уходу за пациентом.
Заключение
Делирий – это тяжелое состояние пациентов в ОРИТ, которое имеет как медицинские последствия в виде ухудшения когнитивного статуса пациента, так и экономические в виде повышения затрат на пребывание пациента в ОРИТ. Делирий – широко распространенное состояние, и у большинства пациентов в ОРИТ на определенном этапе госпитализации развивается это состояние. На наш взгляд, именно профилактика является наиболее эффективной стратегией снижения заболеваемости, смертности и затрат на здравоохранение, связанных с делирием. Поскольку причина делирия, как правило, многофакторная, наиболее эффективными оказываются подходы к профилактике делирия, направленные на устранение нескольких факторов риска.
Дополнительная информация. Работа подготовлена в рамках гранта от Московского центра инновационных технологий в здравоохранении: Научно-практический проект в сфере медицины: «Программа профилактики делирия и осложнений длительного пребывания пациентов в ОРИТ на этапе ранней медицинской реабилитации с помощью виртуальной реальности».



