Железодефицитная анемия (ЖДА) является заключительным этапом железодефицитных состояний и возникает при снижении гемоглобинового фонда железа [1]. ЖДА проявляется симптомами анемии и гипосидероза. Железодефицитные состояния (ЖДС) у беременных развиваются при любом сроке гестации вследствие повышенного потребления и/или недостаточного поступления железа в организм. По данным литературы, в мире насчитывается 60 млн беременных, имеющих манифестный дефицит железа (МДЖ). Частота МДЖ или ЖДА у беременных в развивающихся странах колеблется от 35 до 75 %, а в развитых составляет 18–20 % [2–4]. По данным Минздрава России, частота ЖДА у беременных в России составляет около 42 % [1]. Однако частота ЖДС, предшествующих МДЖ, безусловно значительно выше [2, 5, 6].
Основные свойства ЖДС – их обратимость и возможность предупреждения, чем и объясняется их меньшая частота в развитых странах. Даже в самой ранней, латентной, стадии дефицит железа имеет биохимические признаки, позволяющие его выявлять. Согласно проведенным отечественными авторами исследованиям, отсутствие лечения беременных с латентным дефицитом железа приводит 65 % из них к развитию МДЖ [5].
ЖДА принадлежит одно из ведущих мест в структуре экстрагенитальной патологии, оказывающей неблагоприятное влияние на течение беременности и родов, послеродового периода, состояние плода и новорожденного. К последствиям, которые могут повлечь за собой дефицит железа и крайняя его степень ЖДА, относят увеличение частоты угрозы прерывания беременности и преждевременных родов, плацентарной недостаточности; задержку развития плода, развитие преэклампсии. В послеродовом периоде дефицит железа, наблюдавшийся во время беременности, отрицательно сказывается на процессах инволюции матки, лактации (гипогалактии), эмоциональной сфере (раздражительность, депрессия), частоте развития инфекционных осложнений и анемии в пуэрперии (практически у каждой третьей родильницы развивается МДЖ) [7–9].
У плода и новорожденного при наличии ЖДА у матери отмечаются снижение запасов железа, высокая частота латентного и манифестного дефицита железа в неонатальном периоде, гипотрофия, низкая оценка состояния по шкале Апгар, более высокий уровень заболеваемости, высокая частота недоношенности. Дефицит железа у матери во время беременности и лактации приводит к метаболическим повреждениям у детей не только в неонатальном периоде, но и в отдаленном будущем. На фоне дефицита железа у детей происходит изменение метаболизма клеточных структур, гемоглобинообразования, иммунного статуса [10–12]. Каждая беременность сопровождается развитием дефицита железа, который усугубляется в послеродовом периоде.
К причинам, обусловливающим развитие ЖДА при беременности и после родов, относятся:
1. Истощение баланса железа до наступления беременности (у 40–60 % женщин детородного возраста запасы железа снижены).
2. Увеличение потребления экзогенного железа в связи с интенсификацией эритропоэза.
3. Увеличение эритроцитарной массы и возрастание потребностей плода за счет материнского депо железа.
4. Кровопотеря в родах и при операции кесарева сечения в объеме свыше 1000 мл, которая возникает у 5 % всех родильниц [3, 13].
По данным зарубежных и отечественных авторов, у беременных и родильниц при развитии ЖДС имеет место снижение уровня коэффициента адекватности продукции эритропоэтина пропорционально стадии дефицита железа. Частота неадекватной продукции эритропоэтина в среднем выявляется среди 47,2 % беременных с МДЖ легкой степени, а у родильниц – пропорционально степени тяжести МДЖ (у 12 % родильниц при легкой степени тяжести, у 50 % – при средней и у 80 % – при тяжелой степени тяжести МДЖ). При адекватном уровне эритропоэтина эффективность лечения в 2,5 раза выше по сравнению с таковой у пациенток с неадекватным уровнем, в связи с чем им помимо препаратов железа рекомендуется проводить заместительную терапию с помощью стандартных доз рекомбинантного эритропоэтина [1, 7, 14].
Диагноз ЖДА основывается на клинических и гематологических признаках, среди которых снижение уровня гемоглобина (Hb) представляется ведущим. По определению Всемирной организации здравоохранения, анемией у родильниц следует считать состояние, при котором уровень Hb составляет менее 100 г/л; у беременных – менее 110 г/л в I и III триместрах и менее 105 г/л – во II [15].
Особое место в развитии ЖДА занимают витамины. Железо – не единственный микроэлемент, участвующий в кроветворении. Велика роль и других незаменимых микроэлементов, а также витаминов: меди, марганца, цинка, цианокобаламина, фолиевой и аскорбиновой кислот, ретинола, пиридоксина, рибофлавина и других, недостаточность которых в организме играет определенную роль в развитии ЖДС, включая латентный дефицит железа и ЖДА у беременных и родильниц [5, 16, 17]. Поэтому в лечении ЖДА рекомендуют использовать комплексные препараты, содержащие помимо элементарного железа еще и витамины, оказывающие положительное действие на процессы синтеза Hb.
Целью исследования явилась оценка клинической и гематологической эффективности применения препарата Ферро-Фольгамма в лечении ЖДА легкой степени тяжести у беременных и родильниц.
Материал и методы
Под наблюдением находились 255 больных. Их них – 115 беременных с ЖДА (группа 1) и 140 родильниц с ЖДА (группа 2). У всех больных выявлена анемия легкой степени тяжести.
Критерии включения беременных в группу:
• одноплодная беременность,
• концентрация Hb 110 г/л и ниже, сывороточного железа – 12,5 мкмоль/л и ниже, ферритина ≤ 20 мкг/л.
Критерием анемии у родильниц служило возникновение анемии только в послеродовом периоде, проявляющееся снижением содержания Нb в крови менее 100 г/л. До назначения Ферро-Фольгаммы лечение данных пациенток другими железосодержащими препаратами не проводилось. Длительность ЖДА к моменту начала лечения была различной: от нескольких недель до нескольких месяцев. Срок гестации колебался от 14 до 32 недель, причем препараты железа больные принимали и после завершения беременности.
Как известно, диагностика ЖДА основывается на определении у беременных уровня Hb, числа эритроцитов (RBC), гематокрита (Ht), содержания сывороточного железа (СЖ), коэффициента насыщения трансферрина железом (КНТ), содержания ферритина (СФ); а у родильниц – Hb, RBC, Ht, в связи с тем что определение уровня ферритина сыворотки в диагностике ЖДА у родильниц имеет ограниченное значение, т. к. в послеродовом периоде уровень ферритина при МДЖ может повышаться в 2,9 раза по сравнению с аналогичным показателем до родов [1].
В обеих группах пациентки принимали препарат Ферро-Фольгамма (“Вёрваг Фарма”, Германия), содержащий сульфат железа 112,6 мг, цианкобаламин 0,010 мг, фолиевую кислоту 5 мг, аскорбиновую кислоту 100 мг по 1 капсуле 2 раза в день. Средняя продолжительность лечения беременных составила 44,3 ± 2,7; родильниц – 41 ± 3,5 дня.
Данный препарат был выбран в качестве лечения в связи с тем, что по своему фармакологическому действию он является многофакторным гемопоэтиком со всеми необходимыми компонентами, обеспечивающими стимуляцию структурного синтеза Hb и повышающими продукцию RBC красным ростком костного мозга. Универсальность препарата связана с его избирательно стимулирующим действием на синтез железосодержащей и белковой частей Hb. Так, сульфат железа обладает высоким коэффициентом всасывания в желудочно-кишечном тракте и практически не образует в последнем малодоступных сложных соединений. Абсорбционный коэффициент в значительной степени усилен присутствием в препарате аскорбиновой кислоты. Активные компоненты препарата Ферро-Фольгамма находятся в капсуле, которая обеспечивает их всасывание главным образом в верхнем отделе тонкой кишки. Отсутствие местного раздражающего действия на слизистую оболочку желудка способствует хорошей переносимости препарата со стороны желудочно-кишечного тракта. Кроме того, выбор препарата Ферро-Фольгамма для исследования был обусловлен наличием клинических исследований его эффективности. Было показано, что препарат действительно хорошо переносится пациентками (отсутствовали диспепсические явления или другие жалобы) и по этой характеристике он входит в группу препаратов с наименьшей частотой побочных эффектов [7, 18].
Возраст обследованных пациенток колебался от 19 до 38 лет и в среднем составлял 28,7 ± 1,5 года для беременных и 26,7 ± 2,2 года для родильниц.
У каждой беременной до начала приема препарата Ферро-Фольгамма и через 4 и 6 недель после начала лечения определяли гематологические параметры Hb, Ht, RBC; феррокинетические параметры СЖ, СФ, уровень трансферрина (ТФ), а также высчитывался КНТ; уровень фолиевой кислоты и цианокобаламина (В12) в сыворотке. Для каждой родильницы до начала лечения, затем через 4 и 6 недель на фоне терапии определяли Hb, Ht, RBC и СЖ.
Все пациентки до начала лечения, в конце 4-й и 6-й недель терапии заполняли специально разработанную анкету для оценки клинических проявлений анемического синдрома (слабость, утомляемость, головокружение, шум в ушах, учащенное сердцебиение, одышка при физической нагрузке). Каждый клинический симптом оценивали в баллах в зависимости от степени его выраженности: 1 балл – слабо выражен, 2 балла – умеренно выражен, 3 балла – значительно выражен. При сумме баллов от 1 до 6 отмечали слабовыраженные, от 7 до 12 баллов – умеренно выраженные, от 13 баллов и выше – значительно выраженные проявления анемического синдрома. После окончания исследования все пациентки оценивали также переносимость препарата и частоту возникновения побочных эффектов.
Число RBC, концентрацию Hb в периферической крови, показатель Ht определяли на приборе Micros 60 (Франция). Определение концентрации CЖ, СФ и TФ в сыворотке осуществлялось на биохимическом анализаторе “Коnе Ultra” (Финляндия) с использованием стандартных реактивов. КНТ, отражающий процент насыщения ТС железом, определяли по стандартной формуле. Определение концентрации цианокобаламина и фолиевой кислоты в сыворотке осуществляли с помощью стандартных наборов реактивов для одновременного изотопного определения их в исследуемом образце (“Amersham”, Великобритания).
Статистическую обработку полученных результатов выполняли с использованием пакета прикладных программ для статистической обработки Excel, версия 7.0, раздел программы “Анализ данных”. Различия между сравниваемыми величинами признавали статистически достоверными при уровне значимости р < 0,05.
Результаты исследования
Всем пациенткам проведен анализ течения беременности, родов и послеродового периода, оценена эффективность терапии ЖДА препаратом Ферро-Фольгамма.
При анализе течения беременности у 115 пациенток группы 1 наиболее частыми осложнениями были угроза прерывания беременности (в ранние сроки наблюдалась у каждой второй беременной), токсикоз легкой и средней степеней тяжести (наблюдался у 27 [23,5 %] пациенток), плацентарная недостаточность (выявлена у 14 [12,2 %]), хроническая гипоксия плода (по данным кардиотокографии, наблюдалась в 94 [7,8 %] случаях); у 18 (15,7 %) пациенток выявлены нарушения маточно-плацентарного кровотока при сохранении фетоплацентарного кровотока. Следует отметить, что при возникновении осложнений течения беременности все пациентки получали соответствующую терапию. Через естественные родовые пути произошли роды у 82 (71,3 %) беременных, 14 (28,7 %) произведено кесарево сечение. У 115 женщин родились 115 живых детей, из них 108 (93,9 %) доношенных, 7 (6,1 %) – недоношенных. Средняя масса тела составила 3120 + 69 г; длина тела – 51,2 + 0,3 см.
Объем кровопотери у родильниц (группа 2) в среднем составил 523 ± 55 мл. При этом у женщин с анемией после самопроизвольных родов кровопотеря составила 353 ± 33 мл, что достоверно ниже, чем у пациенток с анемией после кесарева сечения: 780 ± 70 мл (р < 0,001). Одними из самых распространенных послеродовых осложнений у пациенток группы 2 были субинволюция матки (6,1 %) и лактостаз (4,3 %), встречавшиеся примерно с одинаковой частотой. Только в группе 2 у одной пациентки был диагностирован послеродовой эндометрит, что потребовало назначения комплексной патогенетической терапии.
Основные жалобы больных анемией беременных и родильниц сводились к слабости, повышенной утомляемости, головокружению, шуму в ушах, мельканию мушек перед глазами, сердцебиению, одышке при физической нагрузке. До лечения, по данным анкетирования, отмечены умеренно выраженные проявления анемического синдрома (число баллов варьировалось от 9 до 12) у 84 (73,0 %) пациенток группы 1 и 113 (80,7 %) – группы 2. Значительно выраженные проявления анемического синдрома (более 13 баллов) были выявлены у 18 (15,6 %) беременных группы 1 и 21 (15,0 %) группы 2; слабовыраженные проявления регистрировались у 13 (11,3 %) группы 1 и у 6 (4,3 %) пациенток группы 2. Данные анкетирования представлены в табл. 1.
* р > 0,05.
Как видно из табл. 1, после начала курса лечения препаратом Ферро-Фольгамма количество жалоб больных значительно снизилось, одышка и мышечная слабость исчезли у большей части пациенток. Субъективная оценка пациентками своего состояния с помощью анкетирования выявила, что через 4 недели терапии имели место слабовыраженные проявления анемического синдрома (сумма баллов не превышала 6) у 111 (96,5 %) в группе 1 и у 136 (97,1 %) в группе 2. Следует сказать, что прием препарата Ферро-Фольгамма достоверно снизил степень выраженности клинических проявлений ЖДА как у беременных, так и у родильниц (р < 0,05). При этом клиническое улучшение предшествовало нормализации показателей красной крови. Препарат обеспечивал наибольшую скорость нарастания уровня Hb, быстро нормализовал число эритроцитов, уровень сывороточного железа. Нормализация уровня Hb и феррокинетических показателей была получена через 4 недели лечения у 85 (73,9 %) больных в группе 1 и у 106 (75,7 %) в группе 2. Средний показатель Hb до начала лечения в группе 1 составлял 100,8 ± 1,1, в группе 2 – 92,1 ± 2,8 г/л, число RBC в группе 1 – 3,2 ± 0,02 × 1012/л, при этом в группе 2 – 2,9 ± 0,08 × 1012/л. Через 28 дней после применения препарата Ферро-Фольгамма средние показатели Hb и RBC составили 108,3 ± 0,52 г/л и 3,42 ± 0,04 × 1012/л в группе 1 и 101,3 ± 0,9 г/л и 3,13 ± 0,48 × 1012/л в группе 2 соответственно. Однако это не стало основанием к прекращению антианемической терапии. Как известно, нормализация уровня Hb происходит через 1,0–1,5 месяца в зависимости от степени тяжести анемии, показатели обмена железа восстанавливаются постепенно – не ранее чем через 4–6 недель после начала терапии [1, 3, 19].
Уровень Нb, число RBC, показателей Ht, СЖ, ТФ, СФ, фолиевой кислоты и цианокобаламина в сыворотке крови у обследованных женщин с анемией до и на фоне лечения Ферро-Фольгаммой приведены в табл. 2, 3.
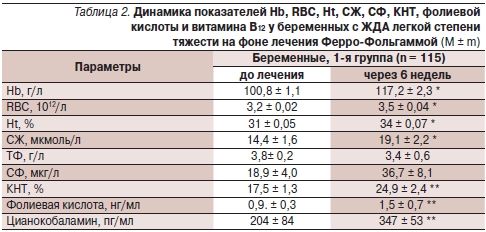
* р > 0,01; ** р > 0,05.
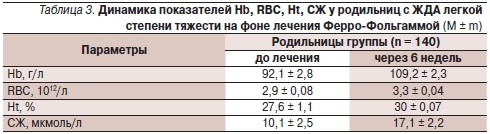
* р > 0,01; ** р > 0,05.
Как видно из табл. 2, 3, у беременных и родильниц, получавших терапию по поводу анемии препаратом Ферро-Фольгамма, обнаружено достоверное повышение гематологических показателей: уровня Hb, числа RBC и показателя Ht; показателей обмена железа в сыворотке: уровней CЖ, СФ, КНТ; а также фолиевой кислоты и цианокобаламина в сыворотке по сравнению с исходными данными.
Через 6 недель после окончания терапии хорошую переносимость препарата Ферро-Фольгамма отметили 113 (98,2 %) беременных и 137 (97,9 %) родильниц. Побочные эффекты препарата имели место у двух беременных и одной родильницы, которые не потребовали отмены препарата и прекращения лечения.
В течение месяца после прекращения приема препаратов у пациенток, получавших препарат Ферро-Фольгамма, не наблюдалось повторного снижения уровня Hb – даже имелась тенденция к продолжению его нарастания в сочетании со снижением общей железосвязывающей способности, что свидетельствовало о продолжающейся нормализации содержания железа и усиленной абсорбции пищевого железа (вследствие быстрого и полноценного восстановления функции энтероцитов на фоне комплексного влияния препарата Ферро-Фольгамма).
Таким образом, у беременных и родильниц с ЖДА на фоне лечения препаратом Ферро-Фольгамма происходит достоверное увеличение содержания Hb, числа эритроцитов, показателя Ht, уровней CЖ, СФ, фолиевой кислоты, витамина В12. Вследствие этого улучшается оксигенация тканей, уменьшается тканевая гипоксия, что приводит к благоприятным изменениям в организме беременных и родильниц с анемией и клиническому эффекту.
Таким образом, полученные результаты показывают, что уникальное соотношение между оптимальным содержанием элементарного двухвалентного железа, фолиевой кислоты и цианкобаламина в одной капсуле позволяет добиваться хороших результатов в лечении железодефицитной анемии беременных и родильниц. Наличие в препарате фолиевой кислоты и цианокобаламина является дополнительным преимуществом, т. к. эти компоненты влияют на разные звенья гемопоэза и эритропоэза, что значительно повышает эффективность лечения. Наличие аскорбиновой кислоты улучшает всасывание и усвоение железа. Микрокапсулированная форма препарата исключает местное раздражение желудка и кишечника. Мы убедились в целесообразности и высокой эффективности применения Ферро-Фольгаммы в акушерской практике.



