Введение
Злокачественные новообразования (ЗН) – широко распространенные заболевания, возникающие практически во всех органах организма. ЗН возникают в результате множественных взаимодействий между генами и окружающей средой и служат одной из ведущих причин смертности во всем мире [1–3], в т.ч. и в Российской Федерации [1]. Так в 2018 г., по данным Московского НИИ онкологии им. П.А. Герцена, в Российской Федерации выявлено 624 709 первичных случаев ЗН (в т.ч. 285 949 и 338 760 у пациентов мужского и женского пола соответственно). Прирост дан-ного показателя по сравнению с 2017 г. составил 1,2%. На конец 2018 г. в территориальных онкологических учреждениях России на учете состояли 3 762 218 пациентов (в 2017 г. – 3 630 567). Совокупный показатель распространенности составил 2 562,3 на 100 тыс. населения.
Факторы, способствующие интоксикации больных ЗН
Онкологические заболевания сопровождаются накоплением значительного количества токсичных метаболитов в результате гибели клеток, провоспалительных факторов, продуцируемых лимфоидными и нелимфоидными клетками и др. Ограниченные детоксикационные возможности печени при заболевании, снижение активности микросомальных ферментов и выделительных систем организма не позволяют эффективно выводить токсины. При этом традиционные противоопухолевые виды лечения, такие как химио- и лучевая терапия, которая, к примеру, используется более чем 50% больных раком как в лечебных, так и в паллиативных целях, также сопровождаются развитием массы побочных эффектов вследствие накопления в организме высокотоксичных соединений. Такая комбинация/сочетание токсических эффектов лечения и токсичности, вызванной неизлечимой болезнью, ставит под угрозу функционирование жизненно важных систем организма пациента и приводит к быстрому ухудшению его физического состояния. Для пациентов, проходящих химиотерапию, системная токсичность к тому же служит и основным ограничением для адекватного дозирования фармакотерапевтических препаратов. Общий уровень интоксикации онкологического больного в раннем послеоперационном периоде при комбинированном лечении в сочетании с интраоперационной лучевой терапией складывается из интоксикации, связанной с опухолевым процессом, последствий хирургического вмешательства, действий электронного облучения на фоне повреждающего воздействия операционной травмы и препаратов наркоза. Развитие ЗН приводит к стресс-индуцированным реакциям, нарушению всех видов обмена, активации протеолиза, дисбалансу в системе перекисного окисления, энергодефициту. На фоне хирургического воздействия на опухолевые и окружающие здоровые ткани происходит повреждение клеток, что ведет к образованию в крови продуктов их жизнедеятельности, а также биологически активных веществ [4–8].
Синдром эндогенной интоксикации (СЭИ) относится к числу наиболее распространенных в клинической онкологии, скорость развития и степень манифестации которого зависят от локализации процесса и его стадии [9, 10]. У больных распространенным раком СЭИ выявляется в 100% случаев, при раке почки III–IV стадий – у 31,3–42,7% больных [11]. Тяжесть СЭИ коррелирует с таковой патологического процесса. Так, при раке молочной железы СЭИ более выражен при II–III стадиях, чем при I стадии [12].
Известно, что метаболиты – это не просто субстраты метаболизма, которые могут быть элиминированы из организма, но и сигнальные молекулы, контролирующие широкий спектр клеточных процессов. В настоящее время известно, что раковые клетки «чувствуют» и модифицируют свои метаболические сети для поддержки биогенеза, что приводит к нарушению регуляции различных метаболических процессов. Недавние исследования показали, что передача сигналов метаболитов участвует в регуляции злокачественной трансформации и пролиферации клеток и др. Кроме того, передача сигналов формирующихся межклеточных метаболитов модулирует воспалительную реакцию и иммунный надзор микроокружением опухоли [13].
Человеческий организм обладает колоссальными механизмами саморегуляции, которые являются безусловно самовосстанавливающимися, и здоровый организм способен выводить токсичные соединения-метаболиты, которые образуются в результате его нормального функционирования. Однако если накопление токсичных метаболитов нарушает деятельность органов детоксикации и выведения, организм накапливает эти вещества в тканях, что приводит к затруднению в решении их задач в регуляции функций организма и его защиты от факторов интоксикации. Детоксикация – решающий шаг на пути восстановления регуляторных механизмов организма и, возможно, возвращения мутированных раковых клеток в состояние нормальных клеток. Нормальные клетки запрограммированы на смерть (апоптоз), когда они «выполнили свою задачу». При этом крайне важно восстановление функций печени, выполняющей множество жизненно важных задач и представляет собой главную систему детоксикации организма. Печень инактивирует и удаляет токсичные экзотоксины и эндотоксины, в частности метаболиты, образующиеся в результате кишечного брожения и гниения, распада опухолевых клеток, обусловленного влиянием полихимиотерапии и облучения.
В связи с этим при онкологической патологии крайне важным является снижение нагрузки токсичных метаболитов и токсинов, накапливаемых в тканях печени, что повышает ее способность к детоксикации. Следует отметить, что и кишечник в значительной мере обеспечивает выведение токсинов благодаря защитной роли слизистой оболочки и ее иммунной системе.
Нарушение пищевого статуса больных ЗН
Общепризнанно, что нарушение пищевого статуса – одно из наиболее частых проявлений метаболических расстройств у больных ЗН, тесно связанных с повышением заболеваемости, смертности и снижением качества жизни.
Необходимо также отметить, что диетическая профилактика онкологических заболеваний возможна в двух направлениях: защита организма человека от поступления с пищей канцерогенных веществ и насыщение организма пищевыми веществами, препятствующими развитию опухолей [14, 15].
В настоящее время известно множество пищевых факторов, способствующих развитию опухолевых образований. Так, например, избыточные калорийность пищи и потребление жира служат благоприятным фактором развития некоторых онкологических заболеваний. Риск возникновения рака молочной железы, тела матки, предстательной железы и толстой кишки возрастает при избыточной калорийности пищи за счет повышения количества потребления жиров. Минимизация поступления в организм человека этих веществ – важная составная профилактики онкологических заболеваний [16, 17].
Основные причины нарушенного потребления питательных веществ больными с онкологическими заболеваниями [17]:
- ухудшение вкуса, запаха и аппетита как следствие развития опухоли и/или терапии;
- измененные предпочтения в еде, отвращение к еде;
- проблемы с питанием (стоматологические проблемы с зубами, жевание);
- дисфагия, ощущение боли при прохождении пищи или частичная/полная желудочно-кишечная непроходимость;
- раннее чувство сытости, тошнота и рвота;
- болезненность, ксеростомия, липкая слюна, болезненное горло, тризм;
- поражения полости рта и эзофагит;
- воспалительный процесс слизистой оболочки полости рта, обусловленный лучевой или химиотерапией;
- острый или хронический энтерит, развивающийся во время и после лучевой терапии;
- депрессия, беспокойство;
- болевой синдром.
Нутритивная поддержка больных ЗН
Когда пероральное питание неадекватно или его недостаточно, следует рассмотреть вопрос об искусственном питании. Критериями для применения оптимизированной нутритивной поддержки являются:
- ожидаемое неадекватное потребление пищи (<50% от потребностей) в течение более 10 дней вследствие хирургического вмешательства или химио-, лучевой терапии;
- если потребление пищи составляет менее 50% в течение более одной- двух недель;
- если ожидается, что недоедающие пациенты не смогут есть и/или принимать достаточное количество питательных веществ в течение длительного периода времени из-за противоопухолевого лечения.
Возникающие при онкологических заболеваниях метаболические проблемы многообразны и характеризуются умеренным расходованием энергии, снижением толерантности к глюкозе, сниженным уровнем инсулина и инсулинорезистентностью, повышением глюконеогенеза из аланина, лактата и глицерола, истощением жировых запасов вследствие повышенного липолиза и снижения липогенеза. Все это приводит к снижению белкового синтеза и повышению катаболизма в мышцах и другим нарушениям питания (недоедание, саркопения и кахексия), что влияет на выживание и выздоровление онкологических больных [16, 19, 20]. Большинству больных ЗН свойственна прогрессирующая потеря массы тела. От 15 до 40% пациентов сообщают о потере массы тела при постановке диагноза [20]. Белково-энергетическая недостаточность при онкологических заболеваниях – одно из наиболее частых осложнений у больных ЗН. Причины потери массы тела и возникающей кахексии обусловлены снижением общего потребления нутриентов онкологическим больным, т.к. большинство онкологических заболеваний сопровождается анорексией [21].
Развившаяся вследствие заболевания или побочных эффектов проводимой фармако- или лучевой и хирургической терапии кахексия приводит онкологических больных к белково-энергетической недостаточности. Происходит потеря массы тела, истощение соматических и висцеральных белковых запасов с повреждением ферментативных и структурных функций. Дефицит белка снижает гуморальный и клеточный иммунитет, что способствует увеличению частоты осложнений, развитию вторичных инфекций. Кахексия при раке характеризуется снижением мышечной массы, которое встречается более чем у 50% вновь диагностированных больных раком по сравнению с 15%-ной распространенностью среди здоровых людей того же возраста. Кахексия характеризуется непроизвольной устойчивой потерей массы тела и скелетных мышц, с/без потери жировой массы, необратимых при обычной нутритивной поддержке больных [22]. Поскольку и мышечная масса, и жировая ткань играют роль в онкологических заболеваниях, стратегия оптимизации состава тела являются важной частью успешной терапии рака. Следовательно, основной целью вмешательства в области питания считается благоприятное влияние на состав тела, что может улучшить результаты лечения рака, заболеваемость и в конечном итоге – прогноз [23].
Как было указано выше, помимо самого заболевания противоопухолевая фармакотерапия и/или оперативное вмешательство оказывают существенное влияние на питание пациентов. Во время химио- и лучевой терапии более 50% пациентов испытывают нарушение вкуса, тошноту, рвоту и воспалительные заболевания слизистой оболочки полости рта. Также установлено, что плохое состояние питания увеличивает частоту послеоперационных осложнений [24].
Установлено, что при проведении правильной нутритивной поддержки больные лучше переносят и лучевую, и химиотерапию. Нормализация питания при комплексном лечении новообразований оказывает положительное влияние и на прогноз заболевания.
В связи с этим принципиально важным вопросом при проведении нутритивной поддержки онкологического больного является выбор метода питания. Правильное питание может облегчить бремя симптомов, улучшить состояние здоровья, поддержать выживаемость при раке, является отличительной чертой успешного лечения рака [16, 17].
Лечебное питание (ЛП) при раке – один из важных факторов, который может предотвращать появление кахексии и белково-энергетического дефицита. ЛП поддерживает онкологических больных при прохождении химио- или лучевой терапии. Также ЛП назначают онкологическим больным после обширных операций по удалению злокачественных опухолей.
Правильное ЛП онкологических больных должно соответствовать следующим критериям [15, 25]:
- обеспечивать физиологические потребности онкологического пациента в питательных веществах;
- в основе ЛП лежит правильный расчет количества необходимых питательных веществ в зависимости от пола, возраста, анализов и сопутствующих болезней онкологического пациента;
- задачей ЛП служит обеспечение пациента углеводами, жирами, витаминами, незаменимыми жирными кислотами и минеральными веществами;
- ЛП должно обеспечивать полное соответствие между назначаемой пищей и физиологическими возможностями онкологического пациента, а также соответствовать эстетическим, вкусовым и физиологическим потребностям;
- ЛП должно содержать коферменты и другие биологически активные вещества, в т.ч. антиоксиданты, обеспечивающие процесс детоксикации (разрушения, обезвреживания и выведения токсинов, а также продукты, обладающие антимутагенной активностью, влияющие на неопластическую трансформацию клеток-промоторов).
Новые диетические продукты лечебного и профилактического питания
В ранее проведенных исследованиях [25] по изучению эффективности применения специализированного диетического лечебно-профилактического питания в комплексном лечении больных раком гортани IV стадии T4aN0M0 показана его высокая клиническая эффективность. В исследовании были проанализированы эффекты новых диетических продуктов ЛП и профилактического питания: Коктейль белковый детоксикационный и Коктейль белковый, восстанавливающий для онкологических больных производства отечественной компании ООО «ЛЕОВИТ нутрио», которые содержат белки, витамины, микроэлементы и другие коферменты системы детоксикации.
До начала проведения клинического исследования наиболее часто выявлялись жалобы на отсутствие аппетита, боли, особенно при глотании, быструю утомляемость, тошноту. Добавление к стандартным питательным смесям специализированного диетического ЛП и лечебно-профилактического питания для снижения интоксикации пациентов ЛЕОВИТ ONCO (ООО «ЛЕОВИТ нутрио», Россия) способствовало более быстрому восстановлению физической активности 70% больных в послеоперационном периоде, снижению общетоксических побочных эффектов проводимой химиотерапии, уменьшению числа жалоб на отсутствие аппетита (у 50% больных), изменению отношения к приемам пищи, выражавшееся желанием чаще принимать пищу и более быстрым появлением чувства голода (70% пациентов), значительному снижению тошноты (у 2/3 больных), остановке снижения массы тела у 60% больных. Указанные положительные эффекты были обусловлены компонентным составом назначаемых детоксикационных продуктов питания, в составе которых содержится детоксикационный комплекс, представленный такими соединениями, как таурин, витамины (С, Е, РР, А, В2, В6), L-цистеин, экстракты растений с антиоксидантной, общетонизирующей, противовоспалительной, иммунотропной, противоопухолевой активностями (гранат, зеленый чай, лимонник, расторопша, корень лопуха, одуванчик, свекла, куркума) а также кофеин, янтарная кислота, минеральные вещества (цинка сульфат, селенит натрия, марганца глюконат).
Эффективность диетического детоксикационного питания была подтверждена и лабораторными исследованиями: 2–3-недельный прием продуктов уменьшал выраженность воспаления, сопровождающего онкологический процесс, о чем свидетельствовало значительное снижение концентрации С-реактивного белка, уровень которого снизился на 37,1%. Было установлено, что обогащенный детоксикационным продуктом рацион питания пациентов через 2 месяца приема приводит к повышению концентрации общего белка на 11,5% и улучшению показателей протеинограммы. Так, уровень в крови альбуминов повысился на 19%, а α-1- и α-2-глобулинов – на 18 и 37% соответственно. Более чем на 26% увеличилась концентрация γ-глобулинов, что свидетельствует о стимулирующем влиянии продукта на белковый обмен, что также важно для нормализации иммунных процессов (см. таблицу).
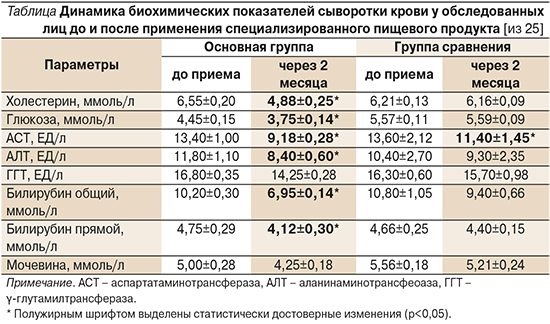
Доказательством детоксикационной активности специализированных продуктов питания служит и их нормализующее влияние на концентрацию в крови важнейших ферментов антитоксической защиты печени (АЛТ и АСТ, ГГТ, общий и прямой билирубин, мочевина) и результаты ранее проведенных нами исследований об улучшении большинства показателей перекисного окисления липидов в крови при приеме специализированных детоксикационных продуктов питания [26, 27]. Так, в указанных исследованиях было выявлено достоверное снижение концентрации первичных продуктов перекисного окисления, в частности диеновых конъюгатов, кетодиенов и карбонилов на фоне повышения общей антиокислительной активности в 1,25 раза. В то же время в группе сравнения наблюдалось только статистически достоверное снижение концентрации карбонилов (p<0,05). Эти данные позволяют говорить и о выраженной антиоксидантной активности продуктов питания для детоксикации, их способности уменьшать последствия окислительного стресса – важнейшего фактора многочисленных патологических процессов в организме. Выше приведенные данные позволяют говорить о том, что дополнительное включение диетических детоксикационных продуктов в рацион питания онкологических больных клинически эффективно и способствует улучшению антитоксической активности печени, снижению воспалительных процессов в организме больных онкологическими заболеваниями и снижению негативного влияния факторов окислительного стресса, как следствие – к улучшению качества жизни больных ЗН.
Заключение
В заключение необходимо отметить не только клиническую эффективность, но и безопасность, а также хорошую переносимость специализированных диетических продуктов ЛЕОВИТ ONCO для питания онкологических больных. Необходимо особо подчеркнуть, в каких случаях должна быть рекомендована дополнительная нутритивная поддержка с включением в рацион питания онкологических больных специализированных диетических продуктов для детоксикации. Подобная нутритивная поддержка необходима:
1. Пациентам, длительно получающим системную противоопухолевую терапию (химио-, таргетная, иммунотерапия).
2. Пациентам с нарушением прохождения пищи (стеноз пищевода, желудка или кишечника) или всасывания питательных веществ (карциноидный синдром).
3. При длительной лучевой терапии дополнительное питание необходимо для более быстрого восстановления поврежденных тканей и восстановления костномозгового кроветворения.
4. Онкологическим пациентам, перенесшим объемные полостные операции, приводящим к послеоперационной интоксикации, что крайне важно, поскольку существуют строгие временные рамки, в которые необходимо начинать послеоперационную химио- или лучевую терапию.
Наконец важно подчеркнуть, что детоксикационная нутритивная поддержка рекомендуется не только в период заболевания и проводимой в стационаре терапии, но и в длительный реабилитационный период после выписки из стационара с целью более эффективного и быстрого восстановления жизненно важных функций организма и существенного улучшения качества жизни больных.



