Одной из наиболее частых причин аномальных маточных кровотечений в перименопаузе является гиперплазия эндометрия (ГЭ) [1]. ГЭ – это заболевание, характеризующееся увеличением соотношения железистого компонента и стромального по сравнению с нормальным пролиферативным эндометрием. Общепризнано, что в основе развития ГЭ лежат гормональные нарушения, которые проявляются как абсолютной, так и относительной гиперэстрогенемией [2, 3]. В дополнение к индукции пролиферативных процессов в эндометрии эстрогены вызывают морфометрические изменения, которые включают изменения количества и форм желез просветного и железистого эпителия, соотношения железа/строма, а также изменение морфологии эпителиальных клеток [4, 5].
Жировая ткань играет ключевую роль в формировании гиперпластических процессов эндометрия и рака эндометрия [5, 6]. Вклад жировой ткани в патогенез ГЭ и рака неясен. Исследование проясняет роль адипоцитов в патогенезе рака эндометрия, демонстрируя, что адипоцит-кондиционированная среда (ACM) увеличивает пролиферацию, миграцию и выживаемость раковых клеток эндометрия по сравнению с преадипоцит-кондиционированной средой (PACM). Экспрессия фактора роста эндотелия сосудов (VEGF) повышается в висцеральной жировой ткани у пациентов с ожирением, что коррелирует с повышенным ростом опухоли на модели ксенотрансплантата in vivo [7].
Общепризнано, что ГЭ в перименопаузе подлежит хирургическому лечению, при отказе пациентки от операции при ГЭ без атипии возможно местное и системное назначение гестагенов, что не всегда является эффективным, а также может иметь ряд побочных эффектов [5, 8]. В последние годы рассматриваются альтернативные подходы к лечению пролиферативных заболеваний. Так, уделяется большое внимание химическим профилактическим средствам, воздействующим на эпигеном: овощи крестоцветных, включая индолкарбинол [9]. Не вызывает сомнений наличие четкой взаимосвязи между активностью метаболитов эстрогена и формированием эстрогензависимых опухолей. В настоящее время удалось выделить ряд соединений, которые активно участвуют в регуляции метаболизма эстрогенов. Индолкарбинол является одним из соединений, корректирующих соотношение 2-гидроксиэстрона (2-ОНЕ1) и 16-гидроксиэстрона (16-ОНЕ1) [10].
На экспериментальной модели показан канцеропротективный, кардиопротективный [11] и гепатопротективный эффекты индолкарбинола [12]. Более того, исследование Perez-Chacon и соавт. [13] доказало, что индолкарбинол способствует апоптозу вируса Эпштейна-Барр и влияет на радиочувствительность клеток рака легкого [14].
В исследовании Kundi A. [15] показано, что аналог индолкарбинола представляет собой новый мощный маломолекулярный ингибитор передачи сигналов Wnt/β-catenin в клетках меланомы, который координирует клеточную пролиферацию и нарушает экспрессию транскрипционного фактора транскрипции. Кроме того, эта группа химических соединений является мощным низкомолекулярным ингибитором активности у биквитинлигазы NEDD4-1, подавляя пролиферацию клеток меланомы человека [16, 17]. В исследовании Tin A.S. и соавт. [18] показана антипролиферативная активность индолкарбинола в отношении клеток рака молочной железы (РМЖ) у человека.
Цель исследования – оценить возможность применения индолкарбинола для лечения пациенток в перименопаузальном возрасте с простой, без атипии ГЭ.
Материалы и методы
Исследование, одобренное Этическим комитетом Кемеровского государственного медицинского университета, проводили на базе гинекологического отделения Кемеровской областной клинической больницы имени С.В. Беляева.
Дизайн исследования: проспективное когортное. В исследование включены 68 женщин от 45 до 53 лет (средний возраст 47,9±2,6 года) с аномальными маточными кровотечениями (АМК). В 1-ю группу вошли 34 женщины в периоде менопаузального перехода, согласно классификации STRAW [19], с подтвержденной по данным гистологического исследования простой, без атипии ГЭ. Критерий невключения: гормональная терапия половыми стероидами в течение последних 6 месяцев. Во 2-ю группу вошли 34 пациентки аналогичного возраста без ГЭ по данным гистологического исследования эндометрия. Пациентки 1-й и 2-й групп имели сходный индекс массы тела (ИМТ) – 29,7±2,5 кг/м² и 30,2±3,5 кг/м² соответственно (p=0,230). Более половины пациенток 1-й группы – 29/34 (85,3%) и 17/34 (50,0%) пациенток 2-й группы страдали рецидивирующими АМК. Миома матки (ММ) выявлена в 1-й и 2-й группах у 22/34 (64,7%) и 17/34 (50,0%), аденомиоз – у 4/34 (11,7%) и 3/34 (8,8%) соответственно. У 11/34 (32,3%) и 2/34 (5,9%) пациенток ранее в анамнезе имелась ГЭ (р=0,048).
Всем пациенткам с АМК была проведена гистероскопия 4-миллиметровым гистероскопом (Karl Storz, Германия) с мануальной вакуум-аспирацией содержимого полости матки (Ipas, США). После получения результатов гистологического исследования пациентки были распределены в две группы: пациентки с наличием (1-я группа) и с отсутствием (2-я группа) простой, без атипии ГЭ. Всем пациенткам проведено физикальное обследование. Ультразвуковое исследование (УЗИ) органов малого таза проводили аппаратом Siemens ACUSON S2000 (2016). Количественное определение в моче соотношения метаболитов эстрогена (2-ОНЕ1/16α-ОНЕ1) проводили методом иммуноферментного анализа с использованием набора Estramet 2/16 Elisa (США) по стандартной методике при помощи анализатора MULTISKAN EX (Финляндия) на 2–5-й день менструального цикла. Содержание общего эстрогена (Е1+Е2+Е3) в моче рассчитывали по формуле: (Е1+Е2+Е3)= 0,85×(2-ОНЕ1+16α-ОНЕ1) [20].
Пациенткам 1-й группы, подписавшим информированное согласие на участие в интервенционном исследовании (n=20), была назначена терапия индолкарбинолом в дозе 300 мг/сутки в течение 3 месяцев, с повторным проведением ультрасонографии (УСГ) органов малого таза и гистероскопии с биопсией эндометрия в I фазу менструального цикла (5–7-й день), количественным определением в моче метаболитов эстрогена 2-ОНЕ1 и 16α-ОНЕ1 на 2–5-й день менструального цикла. Проводили оценку первичных исходов (частота рецидивов ГЭ по данным гистологического исследования биоптата эндометрия через 3 месяца терапии) и вторичных исходов: уровень общих эстрогенов в моче, содержание 2-ОНЕ1, 16α-ОНЕ1, 2ОНЕ1/16αОНЕ1.
Результаты
Количество общих эстрогенов в моче, уровни метаболитов эстрогенов 2-ОНЕ1 и 16α-ОНЕ1 и их соотношения 2-ОНЕ1/16α-ОНЕ1 у пациенток с АМК с наличием и отсутствием ГЭ в период менопаузального перехода представлены в табл. 1.
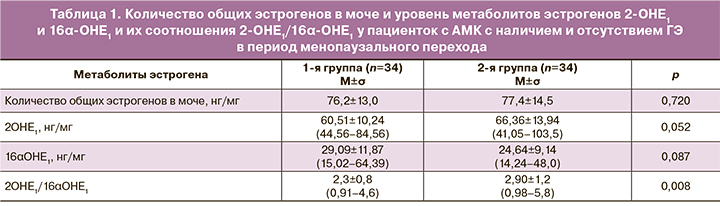
Количество общих эстрогенов в моче, 2-ОНЕ1, 16α-ОНЕ1 у пациенток обеих групп статистически значимо не различалось, однако зарегистрирован более низкий уровень соотношения 2-ОНЕ1/16α-ОНЕ1 (р=0,008).
Подписавшим информированное согласие на участие в исследовании 20 пациенткам 1-й группы была назначена пероральная терапия индолкарбинолом в течение 3 месяцев в суточной в дозе 300 мг/сутки перорально. По окончании курса терапии были оценены первичные и вторичные исходы лечения. Всем пациенткам были проведены УСГ, биопсия эндометрия и определение уровней метаболитов эстрогенов в моче.
Проведена оценка первичных исходов лечения через 3 месяца после лечения индолкарбинолом. Жалобы на АМК за этот период отсутствовали у всех женщин, включенных в исследование. По данным УСГ, на 5–7-й день менструального цикла толщина эндометрия у всех обследованных находилась в пределах нормативных показателей и составила в среднем 4,1±0,3 мм. Результаты гистологического исследования аспирата эндометрия свидетельствовали об отсутствии рецидива ГЭ в 100% случаев: у 3 (15%) женщин выявлены морфологические признаки хронического эндометрита и у 17 (75%) – фаза пролиферации. В настоящее время доказано, что биопсия эндометрия в отношении диагностики его пролиферативных заболеваний достаточно информативна и имеет сходную чувствительность и специфичность с дилатацией и кюретажем [20, 21].
Вторичные исходы – количество общих эстрогенов и уровень метаболитов эстрогенов 2-ОНЕ1 и 16α-ОНЕ1 и их соотношения 2-ОНЕ1/16α-ОНЕ1 в моче у пациенток с ГЭ в период менопаузального перехода до и после лечения индолкарбинолом представлены в табл. 2.
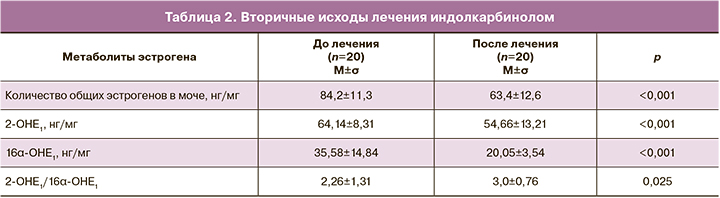
Определение уровней метаболитов эстрогенов в суточной моче после проведенной терапии индолкарбинолом у пациенток с ГЭ в перименопаузе показало статистически значимое снижение количества общих эстрогенов, уровней метаболитов эстрогенов 2-ОНЕ1 и 16α-ОНЕ1, а также достоверное увеличение коэффициента 2-ОНЕ1/16α-ОНЕ1 относительно его исходного уровня.
Обсуждение
Проведенное исследование показано, что применение индолкарбинола может быть эффективной интервенцией у пациенток пременопаузального возраста с ГЭ. Вероятно, механизм действия препарата реализуется через коррекцию соотношения метаболитов эстрогенов 16α-ОНЕ1 и 2-ОНЕ1. Результаты проведенных ранее исследований показали, что индолкарбинол способен корректировать пролиферативные процессы в репродуктивной системе женщины. Противоопухолевое действие индолкарбинола объясняется его способностью блокировать все основные пути трансдукции внутриклеточных сигналов, которые стимулируют клеточный рост, а также избирательной индукцией апоптоза опухолевых клеток. Ряд исследований продемонстрировал нормализацию метаболизма эстрогенов под воздействием индолкарбинола. При назначении этого препарата отмечено снижение уровня «агрессивного» метаболита 16α-ОНЕ1 [22, 23].
Эффективность индолкарбинола доказана в первую очередь в исследованиях, проводившихся у пациенток с доброкачественной дисплазией молочной железы [23–26]. У женщин с простой, без атипии ГЭ назначение индолкарбинола в дозе 300 мг/сут в течение 3 месяцев непрерывно приводило к достоверному снижению уровня 16α-ОНЕ1, а также повышению соотношения 2-ОНЕ1/16α-ОНЕ1.
Индолкарбинол является фитонутриентом, содержащимся в овощах семейства крестоцветных, а также в разных видах капусты. Результаты проведенных ранее исследований по применению индолкарбинола при гормонозависимых заболеваниях позволили предположить, что основой профилактики этой патологии может являться блокада каналов поступления сигналов, стимулирующих пролиферацию при гормонозависимых заболеваниях [14]. В исследовании Tsiskarishvili N.V. и соавт. [27] показана эффективность индолкарбинола в течение 90 дней в дозе 200 мг в сутки в комбинированном лечении пациентов с рецидивирующими, клинически тяжелыми формами генитального вируса папилломы человека (ВПЧ). Новый продукт Гарде 150 (ООО «Си Эс Си ЛТД») содержит 150 мг индолкарбинола, таким образом, прием 2 капсул в день позволяет достичь оптимальной суточной дозы индолкарбинола в 300 мг, что обеспечивает хорошую комплаентность пациенток.
Заключение
Таким образом, опыт применения индолкарбинола у женщин с простой, без атипии ГЭ в перименопаузе показал отсутствие ГЭ у всех пациенток через 3 месяца терапии, снижение уровня 16α-ОНЕ1 и повышение соотношения 2-ОНЕ1/16α-ОНЕ1.



