Внастоящее время инфекционный фактор считается одним из основных в ряду многочисленных причин, приводящих к развитию хронических воспалительных заболеваний верхних отделов желудочно-кишечного тракта [1]. Этим инфекционным факторам, безусловно, служит бактерия Helicobacter pylori. Результаты эпидемиологических исследований в Российской Федерации свидетельствуют о высокой частоте инфицирования хеликобактериозом. В различных регионах России инфекция Н. pylori обнаруживается у 65–92% взрослого населения [2].
И пока в отличие от ряда западных популяций тренд к снижению распространенности Н. pylori в нашей стране не прослеживается. Клиническая значимость инфекции Н. pylori определяется ее ведущей ролью в формировании язвенной болезни, хронического гастрита, MALT-лимфомы и рака желудка [3].
К настоящему времени опубликован ряд работ, в которых отмечается, что больные сахарным диабетом 2 типа (СД2) относятся к группе риска по инфицированию Н. pylori. Это связывают с нарушением моторно-эвакуаторной и секреторной функций гастродуоденальной зоны, неудовлетворительной компенсацией углеводного обмена, ослаблением иммунитета [4, 5]. Стоит отметить, что исследования степени инфицирования Н. pylori больных СД2 в отечественной и зарубежной литературе встречаются исключительно редко. В некоторых из них доказана высокая встречаемость данной инфекции среди этих пациентов, особенно страдающих хроническими гастродуоденальными заболеваниями (ХГДЗ): от 70 до 90% [6]. По данным немногочисленных исследований, частота патологических изменений желудочно-кишечного тракта у больных СД2 выше, чем в общей популяции. До 75% пациентов с СД2 при обследовании сообщали о наличии клинически значимых гастроинтестинальных симптомов [7, 8].
Основным постулатом лечения патологии, ассоциированной с инфекцией Н. pylori, служит принцип эрадикации возбудителя. В соответствии с международным консенсусом Маастрихт-V (2015), Киотским консенсусом (2015), рекомендациями Российской гастроэнтерологической ассоциации (РГА) по диагностике и лечению инфекции Н. pylori у взрослых (2012) регламентированы стандарты антихеликобактерной терапии (АХБТ) [3, 9]. Однако, как свидетельствуют многочисленные отечественные и зарубежные исследования, за последнее десятилетие эффективность классических схем первой и второй линий эрадикации упала [10]. Это связано с рядом проблем, главные из которых рост резистентности Н. pylori к метронидазолу и кларитромицину, побочные эффекты ингибиторов протонной помпы и антибакте-риальных препаратов [11].
Для больных СД2 с ХГДЗ вопрос об эрадикации Н. pylori не менее актуален. Работ, посвященных изучению эффективности АХБТ для больных СД2, немного, их результаты противоречивы. В некоторых исследованиях различий в эффективности эрадикационной терапии у больных СД2 и без СД2 не было обнаружено [12]. В других работах авторы отмечали, что у больных СД2 в сочетании с хроническим гастритом или язвенной болезнью степень эрадикации H. pylori при применении классической тройной 7- или 10-дневной терапии (ТТ) составила лишь 50–60% [6, 13].
Подобная неоднозначность данных об эффективности АХБТ для больных с сочетанием ХГДЗ и СД2, небольшое число исследований и послужили предпосылкой к дальнейшему изучению данной проблемы с позиции доказательной медицины.
Целью настоящего исследования стало изучение эффективности и безопасности различных современных схем АХБТ для больных ХГДЗ и СД2.
Материал и методы
В открытое сравнительное рандомизированное исследование по принципу случайной выборки были включены 138 пациентов, страдавших различными ХГДЗ и инфицированных Н. pylori, средний возраст которых составлял 53,7±6,4 года. Все больные страдали СД2, на момент обследования – в стадии компенсации или субкомпенсации. От пациентов было получено письменное согласие на обследование и лечение, согласно приказу № 173/1 «Об информированном добровольном согласии на медицинскую помощь» от 25.07.2012.
ХГДЗ были диагностированы согласно имеющимся стандартам обследования с привлечением специальных методов: эзофагогастродуоденоскопия (ЭГДС), взятие биопсии слизистой оболочки желудка и 12-перстной кишки с гистологическим исследованием. Инфицированность H. pylori определяли уреазным тестом и бактериоскопическим методом (в биоптатах, минимум из двух мест – тела и антрума желудка) и методом иммуноферментного анализа (ИФА) с моноклональными антителами для выявления антигенов возбудителя в кале. Причем последний метод был обязателен для контроля за эрадикацией и использовался через месяц после окончания лечения.
Исходя из задач нашего исследования, были отобраны пациенты со следующими ХГДЗ: хронический неэрозивный гастрит/гастродуоденит (ХНЭГД), хронический эрозивный гастрит/гастродуоденит (ХЭГД), язвенная болезнь. Данные заболевания были в фазе обострения.
Из обследования были исключены лица, страдавшие тяжелыми декомпенсированными заболеваниями сердца, легких, печени, поджелудочной железы, кишечника, почек, декомпенсированные по СД2, с тяжелыми осложнениями СД, принимавшие в последние 6 месяцев антибиотики по любой причине, пациенты, которым ранее проводилась неэффективная АХБТ.
Все пациенты были разделены на 4 группы в зависимости от схемы АХБТ: в 1-ю вошли больные, получавшие классическую 10-дневную ТТ (омепразол 40 мг/сут, кларитромицин 1 г/сут, амоксициллин 2 г/сут); 2-ю группу составили пациенты, принимавшие оптимизи-рованную ТТ (ОТТ). Данная оптимизация мотивирована рекомендациями Маастрихт-V и Экспертного совета РГА (2017) [2, 9]. В схему ОТТ включены рабепразол 20 мг 2 раза в сутки, кларитромицин 1 г/сут, амоксициллин 2 г в сутки. Продолжительность лечения – 14 дней. В 3-ю группу вошли больные, которым назначалась усиленная схема ОТТ (УОТТ). Она предполагала добавление на весь срок АХБТ висмута трикалия дицитрата по 240 мг 2 раза в сутки и пробиотического препарата из бактерий Saccharomyces boulardii – 500 мг 2 раза в сутки. В 4-ю группу вошли пациенты, которым в качестве первой линии лечения назначалась квадротерапия без препарата висмута или сочетанная терапия, также рекомендованная Маастрихтом-V и РГА. По примеру схемы УОТТ мы усилили сочетанную терапию (УСТ) пробиотиком из бактерий S. boulardii, в ее состав входили рабепразол 20 мг 2 раза в сутки, кларитромицин 1 г/сут, амоксициллин 2 г/сут, метронидазол 1500 мг/сут, S. boulardii 500 мг 2 раза в сутки. Длительность лечения – 14 дней.
Помимо схем АХБТ наши пациенты получали антациды и спазмолитики, а после курса эрадикации еще в течение месяца им назначали ингибитор протонной помпы, который входил в схему эрадикационной терапии.
Для корректного сравнения результатов лечения больных ХГДЗ и СД нами проведена рандомизация всех четырех групп обследованных. Учитывались социально-демографические, клинические и другие параметры. В табл. 1 представлена сравнительная характеристика различных групп наблюдения.

Как следует из табл. 1, пациенты четырех групп наблюдения не различались по таким показателям, как средний возраст, распределение по полу, ИМТ, частота ХГДЗ, средний стаж этих заболеваний, частота сопутствующей гастроэнтерологической патологии, стаж СД2, особенности течения СД2. Таким образом, данные группы были рандомизированы в соответствии с задачами исследования, и основным различием между ними было лечение разными схемами АХБТ.
В задачи работы входило определение клинико-эндоскопической и лабораторной эффективности эрадикационных схем. Для оценки клинической эффективности использовали методику оценки гастроэнтерологических жалоб по системе GSRS (Gastrointestinal Simptom Rating Scale), разработанную I. Wiklund [14]. Русскоязычная версия опросника GSRS была создана исследователями Межнационального центра исследования качества жизни (Санкт-Петербург) [15]. Суть методики заключалась в опросе больных по 5 шкалам: DS – диарейный синдром, IS – диспептический синдром, CS – констипационный синдром, AP – синдром абдоминальных болей, RS – рефлюксный синдром. За каждый синдром можно получить от 14 до 28 баллов в зависимости от частоты симптомов. Для общей оценки жалоб баллы разных шкал суммировались. Эндоскопическая эффективность определялась исчезновением эндоскопических и гистологических признаков обострения заболевания по данным ЭГДС через месяц от окончания лечения. Лабораторной эффективностью эрадикационных схем считались отрицательные результаты ИФА на антигены Н. pylori в кале через месяц после окончания лечения.
Результаты исследования были обработаны с помощью пакета прикладных программ «Statistic 10», «Excel 2014». Абсолютные величины сравнивали с расчетом средних значений, ошибки средних, с использованием критерия Стьюдента. Для относительных величин применяли точный критерий Фишера. Различия считались статистически значимыми при достигнутом уровне p<0,05.
Результаты и обсуждение
На первом этапе исследования проведено сравнение клинических и эндоскопических результатов лечения больных разными вариантами АХБТ. Оказалось (табл. 2), что все изученные схемы приводили большинство больных к эндоскопической ремиссии. Наименьший положительный результат по этому показателю имела классическая схема ТТ – 71,8%. При назначении ОТТ частота эндоскопической ремиссии была выше, но статистической значимости по сравнению с ТТ достигнуто не была. Наибольшую эффективность по данному параметру показала схема УСТ – 97,2%, что было достоверно выше, чем при схемах ТТ и ОТТ. При использовании схемы УОТТ ремиссия в виде заживления язв и эрозий, стихания активности гастрита была достигнута в 91,2% случаев, что достоверно отличало ее только от схемы ТТ.
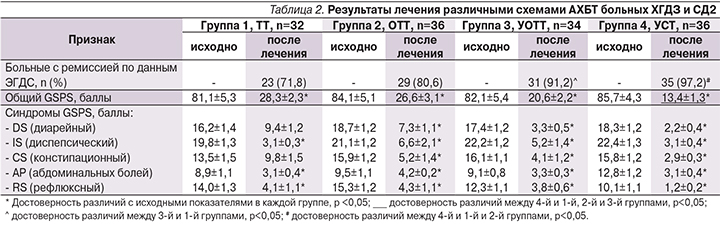
Клиническая эффективность лечения имела место при назначении любой из четырех схем терапии. Общий показатель GSRS достоверно уменьшался по отношению к исходному по окончании лечения во всех группах, но больше всего при лечении схемой УСТ.
В этом случае итоговый общий GSRS был достоверно ниже, чем в группах ТТ, ОТТ и УОТТ. По всем отдельным анализируемым в работе синдромам GSRS отмечен достоверный положительный эффект по окончании терапии ОТТ, УОТТ и УСТ. Исключение составила схема ТТ, при применении которой достоверная положительная динамика диарейного и констипационного синдромов не выявлена.
Особое значение в работе придавали итоговой эрадикации Н. pylori при использовании различных схем АХБТ. Наименьшую эффективность с этих позиций показала схема ТТ (см. рисунок): лишь 68,7% пациентов достигли эрадикации Н. pylori. Несколько большая (недостоверно) частота эрадикации (80,6%) была достигнута при применении схемы ОТТ.

По результатам элиминации хеликобактерной инфекции наиболее эффективной себя показала УСТ – 97,2%, что достоверно выше, чем при использовании схем ТТ и ОТТ. Схема УОТР обеспечивала чуть меньший процент эрадикации (94,1%), чем при УСТ, достоверно превосходя схемы ТТ и ОТТ.
Оценив эффективность изучаемых эрадикационных схем терапии инфекции Н. pylori, была поставлена задача изучить их безопасность. Для этого провели анализ всех нежелательных явлений, возникших в процессе эрадикационной терапии и в течение месяца после ее окончания. В основном речь шла о таких явлениях, как тошнота, изменение вкуса, вздутие и боли в животе, диарея, зуд в заднем проходе, головная боль, артралгия, глоссит/стоматит, аллергическая сыпь. При общей оценке нежелательных явлений по каждой из четырех групп установлено, что наибольшая их частота отмечена у больных 2-й группы (табл. 3), получавшей схему лечения ОТТ. В группе 1 при назначении схемы ТТ частота нежелательных явлений была меньше, но недостоверной по отношению к схеме ОТТ. Наиболее безопасной оказалась терапия УОТТ с частотой нежелательных явлений – 23,5%, что достоверно отличало ее от групп 1 и 2. У больных ХГДЗ и СД2, получавших УСТ, частота побочных эффектов была несколько выше (27,8 %), но недостоверной по отношению к схеме УОТТ и при этом достоверно меньше, чем в группах 1 и 2.

Только 4 (2,9%) пациентам из 138 пришлось прервать лечение из-за возникновения аллергической сыпи, всем остальным нежелательные явления не помешали закончить лечение.
Таким образом, результаты нашего исследования позволили сравнить эффективность тройной схемы АХБТ и ее модификаций, а также модифицированной сочетанной схемы лечения больных ХГДЗ и СД2. Наличие СД2 у наших пациентов придавало особый интерес и сложность проведения данного лечения. Следует отметить, что согласно рекомендациям, посвященным проблеме хеликобактериоза, задача терапии заключается в более чем 80%-ной эрадикации возбудителя, оптимальным результатом считаются 85–90%, высоким – более 90% [3]. Однако, как свидетельствуют многочисленные отечественные и зарубежные исследования, за последнее десятилетие эффективность классических схем первой и второй линий упала и редко обеспечивает необходимый процент эрадикации [10]. Как показало наше исследование, в группе классической 10-дневной ТТ, частота эрадикации H. pylori не достигала 70%. Необходимый 80%-ный барьер преодолела схема лечения ОТТ, но и этот результат можно считать достаточно низким. И только две схемы – УОТТ и УСТ – обеспечили достижение высокого показателя эрадикации инфекции H. pylori – более 90%, при этом наиболее результативной оказалась УСТ – 97,2 %. Причина столь высокой эффективности схем УОТТ и УСТ, вероятно, связана с наличием в их составе пробиотика, препарата висмута (в УОТТ), метронидазола (в УСТ). По той же причине схемы УОТТ и УСТ оказались более эффективными с позиций уменьшения клинической симптоматики и получения эндоскопической ремиссии ХГДЗ по сравнению со схемами ТТ и ОТТ. Наши результаты согласуются с данными литературы, посвященной лечению хеликобактериоза, где неоднократно отмечалось, что добавление к классическим схемам первой линии эрадикации H. pylori препаратов висмута и пробиотиков позволяло повышать эффективность лечения на 10–15% [16, 17]. С наличием пробиотиков и препаратов висмута в схемах лечения УОТТ и УСТ, вероятно, связано и достоверно меньшее количество нежелательных явлений в процессе эрадикации H. pylori по сравнению со схемами ТТ и ОТТ.
Следует отметить, что в данном исследовании схемы ОТТ, УОТТ и УСТ впервые были применены в АХБТ в отношении больных ХГДЗ в сочетании с СД2.
Выводы
- У пациентов с сочетанием ХГДЗ и СД2, инфицированных H. pylori, наиболее эффективными схемами эрадикационной терапии определены УОТТ и УСТ, которые позволили добиться более чем 90%-ной элиминации возбудителя. Эти схемы оказались высокоэффективными и с позиций достижения клинической и эндоскопической ремиссий данными больными.
- Схемы УОТТ и УСТ были более безопасными с точки зрения нежелательных явлений, возникавших в процессе эрадикации H. рylori, по сравнению с классической ТТ и схемой ОТТ.



