Введение
На сегодняшний день известно, что клиническая значимость инфекции Helicobacter pylori (H. pylori) определяется ее ведущей ролью в формировании хронического гастрита, дуоденита, язвенной болезни желудка и двенадцатиперстной кишки (ДПК), MALT-(mucosa-associated lymphoid tissue)-лимфомы, а также аденокарциномы желудка [13]. Несмотря на то что хронический гастрит развивается у всех инфицированных H. pylori, какие-либо клинические проявления имеются далеко не в каждом случае, более того, примерно 80% лиц остаются асимптоматичными [3, 4]. Важно, что именно хронический гастрит является наиболее существенным фактором риска развития более грозных H. pylori-ассоциированных заболеваний, перечисленных выше, склонных к формированию жизнеугрожающих осложнений [3, 5]. При этом хронический дуоденит, являющийся одним из самых распространенных, если не самым распространенным, заболеванием ДПК, а вместе с гастритом и всего желудочно-кишечного тракта, чаще всего остается в тени перечисленной выше патологии.
В 2015 г. состоялся Киотский консенсус, целью которого была систематизация накопленных за последние несколько лет данных об этиологии, тактике диагностики и лечения воспалительных изменений слизистой оболочки желудка (СОЖ) и ДПК – гастрита и дуоденита [6]. Экспертный совет широко обсуждал вопросы, связанные с актуализацией текущих систем классификации хронического гастрита, дуоденита, анализировал роль данной нозологической единицы в формировании и прогрессировании предраковых изменений СОЖ, а также возможности эрадикационной терапии (ЭТ) в качестве метода канцеропревенции.
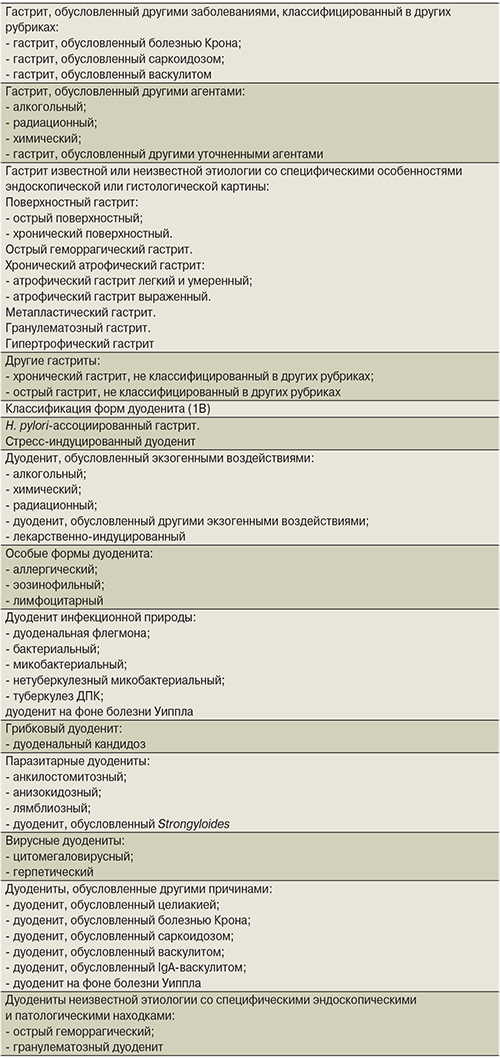
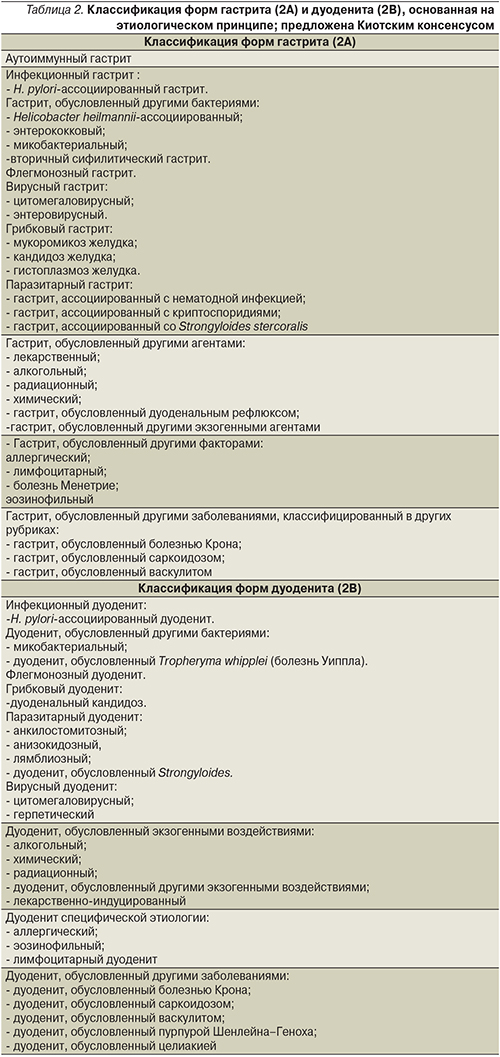
Важно отметить, что Киотский консенсус – это существенный вклад экспертного сообщества гастроэнтерологов в модификацию Международной классификации болезней (МКБ). Как известно, международная конференция по 10-му пересмотру МКБ (МКБ-10) была проведена Всемирной организацией здравоохранения (ВОЗ) в Женеве в 1989 г. и одобрена на 43-й сессии Всемирной Ассамблеи здравоохранения в 1990 г. Система МКБ-10 до сих пор служит ведущей статистической и классификационной основой в здравоохранении в мире. Однако в силу недостаточности данных об этиологической роли инфекции H. pylori на момент разработки данной системы форма гастрита, ассоциированная с данной инфекцией, не была включена в классификационную сетку. Своей работой Киотский консенсус внес важный вклад в совершенствование предложенной несколько ранее классификации форм гастрита (2А) и дуоденита (2В) по МКБ-11β (табл. 1), которая в настоящее время еще не утверждена и продолжает активно обсуждаться.
В настоящей статье представлены основные положения Киотского консенсуса, снабженные как оригинальными, так и собственными комментариями. Предложенные материалы знакомят российских гастроэнтерологов с мировыми трендами в области тактики ведения пациентов с гастритом и дуоденитом.

Утверждения Киотского консенсуса
В процессе обсуждения в рамках Киотского консенсуса экспертным советом было сформулировано 24 утверждения различного класса рекомендаций и уровня доказательности.
Утверждение 1. Текущая классификация гастрита в системе МКБ-10 является устаревшей, т.к. не отражает данных об этиологической роли инфекции H. pylori (класс рекомендаций: сильный; уровень доказательности: высокий).
Классификация гастрита (К29) по системе МКБ-10 была предложена в 1989 г. и к настоящему времени используется в большинстве стран – членов ВОЗ. В ее основе лежит подразделение форм гастрита с позиций достаточно ограниченного списка макроскопических и гистоморфологических изменений. Данная классификационная система не дает информации о широкой этиологической структуре гастрита, известной к настоящему времени. Более того, единственным этиологическим фактором гастрита в системе МКБ-10 выделяется лишь алкоголь (К29.2). Открытие этиологической роли инфекции H. pylori не было принято во внимание в силу недостаточной доказанности на момент составления классификации. Исследования последующих лет позволили детерминировать ведущую этиологическую роль H. pylori в формировании гастритических изменений, позволив открыть новую главу в изучении этой проблемы [7, 8]. В настоящее время ни одна из систем классификации гастрита не может рассматриваться как актуальная без выделения формы заболевания, ассоциированной с H. pylori.
Утверждение 2. Новая редакция классификации гастрита и дуоденита по системе МКБ-11β представляет собой улучшенный вариант, т.к. базируется на этиологических факторах (класс рекомендаций: сильный; уровень доказательности: умеренный).
Процесс пересмотра системы МКБ-10 был запущен ВОЗ в 2007 г. в связи накоплением новых научных данных. Сформулированный на сегодняшний день вариант МКБ-11β (от января 2011 г.) является неокончательной версией этой системы и в настоящее время не утвержден ВОЗ.
В МКБ-11β принципиально переработана классификация гастрита и дуоденита: подчеркнута роль этиологических факторов. Классификация гастрита в системе МКБ-11β базируется в первую очередь на каузативных факторах и включает три основные формы гастрита: (a) H. рylori-ассоциированный, (b) лекарственно-индуцированный, (с) аутоиммунный. Предложенная классификация гастрита определяет лечебную тактику при каждой из описанной в ней форме.
Экспертный совет Киотского консенсуса предложил обновленную версию классификации гастрита и дуоденита в системе МКБ-11β, также базирующуюся на этиологическом факторе, однако структурированную по несколько другому принципу (табл. 2). Данная система также представляется актуальной, однако для ее внедрения в клиническую практику необходима широкая валидизация в различных странах мира.
Утверждение 3. Целесообразно классифицировать H. pylori-ассоциированный гастрит по локализации, поскольку развитие рака желудка и язвенной болезни коррелирует с вовлеченным в патологический процесс отделом органа (класс рекомендаций: сильный; уровень доказательности: высокий).
Локализация H. pylori-ассоциированного гастрита наряду с активностью воспалительного процесса позволяет прогнозировать индивидуальный риск развития серьезных гастродуоденальных осложнений, в частности рака желудка [9, 10].
В зависимости от локализации воспалительного процесса изменяется кислотообразующая функция желудка, варьируясь от гипер- до гипосекреции и даже ахлоргидрии, потенцируя различные риски формирования других патологий органа [11, 12]. Пациенты с выраженным атрофическим гастритом (с или без кишечной метаплазии) в теле желудка имеют повышенный риск развития рака желудка как кишечного, так и диффузного типа [10, 13].
В той же когорте пациентов наблюдается увеличенный риск язвенной болезни желудка, напротив, у пациентов с антральным гастритом выше риск развития язвенной болезни ДПК [2, 14]. Локализация патологических воспалительных изменений также важна для выявления групп пациентов, требующих дальнейшего скринингового наблюдения после проведенной ЭТ [15].
Утверждение 4. Целесообразно классифицировать гастрит по гистологическим признакам, поскольку развитие рака желудка на фоне H. pylori-ассоциированного гастрита варьируется в зависимости от распространенности и активности воспалительного процесса и выраженности явлений атрофии (класс рекомендаций: сильный; уровень доказательности: высокий).

Обновленная Сиднейская система оценки гастрита на настоящий момент внедрена в клиническую практику во многих странах мира [16]. Данная гистологическая система позволяет подробно проанализировать патоморфологические характеристики H. pylori-ассоциированного гастрита, включая выраженность явлений атрофии, кишечной метаплазии в различных отделах желудка. Патоморфологическая оценка гастрита клинически релевантна, поскольку различные фенотипы H. pylori-ассоциированного гастрита детерминируют различный риск развития гастродуоденальных осложнений. Выраженность и распространенность атрофического гастрита и кишечной метаплазии служат предиктором риска развития рака желудка [10, 17]. Новые системы стадирования атрофии и кишечной метаплазии в различных отделах желудка, такие как OLGA (Operative Link for Gastritis Assessment) и OLGIM (Operative Link for Gastric Intestinal Metaplasia Assessment), позволяют более подробно проанализировать индивидуальный риск развития рака желудка [18, 19].
Утверждение 5. Эрозии СОЖ должны описываться отдельно от гастрита, т.к. естественное течение и клинические проявления эрозивных повреждений слизистой оболочки зависят от этиологических факторов и требуют дальнейшего уточнения (класс рекомендаций: сильный; уровень доказательности: низкий).
Эрозии СОЖ могут быть ассоциированы с инфекцией H. pylori, однако чаще эти дефекты индуцированы приемом нестероидных противовоспалительных средств (НПВС) [20, 21].
В этой когорте пациентов при наличии множественных эрозий существенно возрастает риск развития язвенного дефекта и ассоциированных осложнений [22].
В связи с этим эрозии СОЖ должны рассматриваться не в рамках гастрита, а выделяться отдельно (в клиническом диагнозе), что требует разработки классификации этих поражений с учетом этиологических факторов и их клинического течения.
Утверждение 6. H. pylori-ассоциированный гастрит должен рассматриваться как отдельное инфекционное заболевание, даже если пациент не предъявляет жалоб, и вне зависимости от наличия язвенной болезни или рака желудка (класс рекомендаций: сильный; уровень доказательности: высокий).
Инфекция H. pylori – наиболее распространенная бактериальная инфекция человека, приводящая к развитию хронического активного гастрита различной тяжести у всех инфицированных лиц [23]. На фоне гастрита повышается риск развития других H. pylori-ассоциированных заболеваний, включая язвенную болезнь и злокачественные поражения желудка. Вариабельность паттерна развития H. pylori-ассоциированного заболевания на фоне хронического гастрита обусловлена различными вирулентными и патогенными свойствами бактериального штамма, генетическими особенностями макроорганизма и средовыми факторами [2]. В целом для H. pylori-позитивных пациентов риск развития ЯБ в течение жизни составляет 10–20%, рака желудка – 1–2%, а MALT-лимфомы желудка – 0,1% [2, 24, 25]. Эрадикация инфекции H. pylori приводит к регрессу воспалительного процесса в СОЖ, заживлению эрозивно-язвенных повреждений и уменьшению и/или полному нивелированию диспепсических симптомов [2, 4]. Помимо этого ЭТ может способствовать профилактике развития других патологий, ассоциированных с инфекцией, включая язвенную болезнь и рак желудка. Поскольку хронический поверхностный гастрит, ассоциированный с инфекцией H. pylori, может прогрессировать в более тяжелые формы гастрита, включая атрофический (с или без кишечной метаплазии), увеличивающий риск рака желудка, ЭТ должна включаться в алгоритмы ведения этой группы пациентов в качестве способа канцеропревенции [10, 15, 17].
 Утверждение 7. H. pylori-ассоциированный гастрит является причиной явлений диспепсии у ряда пациентов (класс рекомендаций: сильный; уровень доказательности: высокий).
Утверждение 7. H. pylori-ассоциированный гастрит является причиной явлений диспепсии у ряда пациентов (класс рекомендаций: сильный; уровень доказательности: высокий).
Многочисленные наблюдения подтверждают гипотезу о том, что инфекция H. pylori может индуцировать симптомы диспепсии у ряда пациентов [26, 27]. Во-первых, острый гастрит, ассоциированный с H. рylori, может быть сам по себе ассоциирован с диспепсическими проявлениями [7, 8]. Хотя у пациентов с хроническим гастритом в большинстве случаев симптомы не наблюдаются [4, 28]. Во-вторых, в большинстве эпидемиологических исследований была показана ассоциация между инфицированностью H. pylori и наличием необследованной диспепсии в популяции [27, 29]. Однако наиболее явным доказательным базисом роли инфекции H. pylori в генезе явлений диспепсии у ряда пациентов остаются данные клинических исследований, демонстрирующих небольшой, но статистически значимый положительный эффект в купировании симптоматики после эрадикации микроорганизма с показателем NNT (number needed to treat), равным 14 и 8 [30, 31]. Как правило, после ЭТ нивелирование симптоматики занимает по меньшей мере 6 месяцев, что, по-видимому, определено временем, необходимым для регресса воспалительных изменений в СОЖ [32–34]. Тем не менее на сегодняшний день нет критериев, позволяющих предсказывать, будут ли купированы диспепсические симптомы у конкретного пациента после поведенной ЭТ.
Утверждение 8А. У H. pylori-инфицированных пациентов с явлениями диспепсии симптомы обусловлены персистированием инфекции в случае, если ЭТ привела к длительному купированию имевшейся симптоматики (класс рекомендаций: сильный; уровень доказательности: высокий).
Утверждение 8В. H. pylori-ассоциированная диспепсия является отдельной нозологической единицей (класс рекомендаций: сильный, уровень доказательности: умеренный).
Согласно Римским критериям III пересмотра (2006), под термином «функциональная диспепсия» (ФД) понимают наличие одного и более симптомов у пациента – боль или жжение в эпигастрии, чувство переполнения в эпигастрии или раннее насыщение (персистирующих не менее 6 месяцев) в отсутствие данных об органической патологии, способной объяснить эти симптомы [35]. Эксперты Римского консенсуса отметили, что часть пациентов с гастритом, ассоциированным с H. pylori, могут рассматриваться в рамках органической диспепсии в том случае, если ЭТ приводит к регрессу жалоб. Пациенты с H. pylori-ассоциированным гастритом, у которых симптоматика продолжает персистировать, несмотря на проведенную успешную ЭТ, должны быть отнесены к группе пациентов с ФД. С учетом вышесказанного стабильный регресс симптоматики после ЭТ позволяет рассматривать инфекцию H. pylori как органическую причину развития симптомов диспепсии и позволяет выделять H. pylori-ассоциированную диспепсию как отдельную нозологическую единицу (рис. 1).
Утверждение 9. Эрадикация H. pylori должна рассматриваться как терапия первой линии у пациентов с H. pylori-ассоциированной формой диспепсии (класс рекомендаций: сильный; уровень доказательности: высокий).
Исходя из утверждения 8, существует целая когорта пациентов с H. pylori-ассоциированной диспепсией, для которой инфекция H. pylori является каузативным фактором клинических симптомов. Проведение ЭТ таким пациентам должно приводить к купированию явлений диспепсии (не моментальному). На сегодняшний день это единственная тактика лечения, при которой данные пациенты могут быть полностью «излечены» после успешной эрадикации, что позволяет ее определять как терапию первой линии.
Утверждение 10. С целью купирования диспепсических симптомов ЭТ более эффективна, нежели плацебо для пациентов с H. pylori-ассоциированной формой диспепсии, и является предпочтительным вариантом лечения (класс рекомендаций: сильный; уровень доказательности: высокий).
Изучение эффективности ЭТ для H. pylori-инфицированных пациентов с ФД продемонстрировало уменьшение диспепсических жалоб со стороны ряда пациентов [32–34]. При этом на сегодняшний день лишь ограниченное число исследований было посвящено сравнению эффективности ЭТ и других медикаментозных подходов, применявшихся для лечения явлений диспепсии, таких как ИПП или прокинетики для этой когорты пациентов [34, 36]. Таким образом, даже несмотря на то что, как правило, после ЭТ регресс симптоматики занимает по меньшей мере 6 месяцев, данная терапия должна рассматриваться как предпочтительный метод лечения.
Утверждение 11. Пациенты, у которых сохраняются диспепсические симптомы после успешной ЭТ, должны рассматриваться как пациенты с ФД (класс рекомендаций: слабый; уровень доказательности: умеренный).
Исходя из утверждения 8, а также положений Римского консенсуса III пересмотра, H. pylori-инфицированные пациенты с явлениями диспепсии, однако без макроскопических изменений слизистой оболочки (при проведении эндоскопического исследования), у которых отмечен регресс симптоматики после ЭТ, представлены лицами с H. pylori-ассоциированной диспепсией [35]. Напротив, если в случае успешной ЭТ не происходит уменьшения симптоматики, это позволяет сделать вывод, согласно которому H. pylori-ассоциированный гастрит не служит причиной симптомов для этих пациентов. Соответственно, этих лиц можно отнести к пациентам, страдающим ФД.
Утверждение 12. Атрофия СОЖ и кишечная метаплазия могут быть идентифицированы с помощью современных методов эндоскопического обследования после соответствующей подготовки персонала (класс рекомендаций: сильный; уровень доказательности: высокий).
Конвенционные методы эндоскопии не являются адекватным инструментом для идентификации атрофии и кишечной метаплазии и требуют обязательного проведения биопсии для детальной оценки гистоморфологических изменений СОЖ по Сиднейской системе [16, 37]. Тем не менее современные эндоскопические методики (узкоспектральная эндоскопия – NBI – narrow band imaging, эндоскопия высокого разрешения, хромоэндоскопия, лазерная конфокальная эндомикроскопия) являются точными и воспроизводимыми методами для диагностики предраковых изменений СОЖ в руках обученного персонала [38, 39].
Утверждение 13. Точная гистологическая оценка гастрита требует взятия биоптатов слизистой оболочки как из тела, так из антрального отдела желудка (класс рекомендаций: сильный; уровень доказательности: высокий).
Детальная гистологическая оценка гистоморфологических изменений СОЖ требует проведения биопсии как из участка антрального отдела, так и из тела желудка [40]. Данная тактика позволяет более точно оценивать риск развития рака желудка [10, 17]. Сиднейская система рекомендует взятие биоптатов из 5 участков: большая и малая кривизна антрального отдела, угол, а также тело желудка по большой и малой кривизне (рис. 2) [16, 37].
Утверждение 14А. Риск рака желудка коррелирует с выраженностью и распространенностью атрофического гастрита (класс рекомендаций: сильный; уровень доказательности: высокий).
Утверждение 14В. Системы гистологического стадирования OLGA и OLGIM позволяют стратифицировать риск рака желудка (класс рекомендаций: сильный; уровень доказательности: низкий).
Рак желудка развивается в рамках многоэтапного пути канцерогенеза, известного как каскад P. Correa [41]. Эта модель предполагает, что существует временнáя последовательность предраковых изменений, которые в конечном счете приводят к развитию рака желудка. В подгруппе пациентов, инфицированных Н. pylori, воспалительный процесс в СОЖ приводит к развитию атрофического гастрита (потеря железистой ткани) с последующим прогрессированием в кишечную метаплазию, дисплазию, ранний рак желудка и впоследствии – в распространенный. Согласно многочисленным исследованиям, формирование атрофического гастрита, кишечной метаплазии и дисплазии значительно увеличивает риск развития рака желудка. Так, в популяционном исследовании в Нидерландах, включившем около 98 тыс. пациентов с предраковыми изменениями СОЖ, было показано, что риск развития рака желудка возрастает на 2–3% в течение 10 лет [42]. К максимальному риску относятся пациенты с дисплазией. Патоморфологический анализ биоптатов СОЖ является высокоинформативным методом для стратификации риска рака желудка. В качестве основных методов гистологической оценки могут использоваться системы OLGA и OLGIM [18, 43, 44]. Пациенты с III и IV стадиями процесса, по данным этих стратификационных систем, имеют высокий риск развития рака желудка [45, 46].
Утверждение 15. Серологические тесты (пепсиноген-I, пепсиноген-II и антитела к H. pylori) имеют значение для индивидуальной оценки риска рака желудка (класс рекомендаций: сильный; уровень доказательности: высокий).
Серологические методы диагностики инфекции H. pylori и желудочной атрофии используются в клинической практике более 25 лет. К этим методикам относятся иммуноферментный анализ для диагностики инфекции H. pylori, а также сывороточные пепсиногены (I и II типа) и гастрин для диагностики атрофических изменений слизистой оболочки желудка и явлений гипоацидности [47]. Уровень пепсиногена-I ≤70 нг/л и соотношение пепсиноген-I/пепсиноген-II ≤3,0 являются негативными прогностическими факторами [48]. Для лиц с нормальным уровнем пепсиногенов вне зависимости от инфицирования H. pylori ежегодная частота прогрессирования в рак желудка очень низкая. Напротив, данный показатель намного выше у пациентов с нарушенным уровнем сывороточных пепсиногенов и достигает 3,5–6,0 случаев на 1000 лиц в год [49].
Утверждение 16. Целесообразно скрининговое обследование на H. pylori в молодых возрастных группах до развития атрофического гастрита и кишечной метаплазии с учетом локальных эпидемиологических данных (класс рекомендаций: сильный; уровень доказательности: умеренный).
ЭТ снижает риск развития рака желудка, однако этот эффект, как правило, достигается лишь пациентами, у которых отсутствовали явления атрофии и метаплазии [50–52]. Лиц с этими предраковыми состояниями ЭТ приводит к регрессу воспалительных изменений СОЖ, однако может не остановить дальнейшего прогрессирования в рак желудка [53]. Исходя из этого, целесообразно проводить скрининговые мероприятия для пациентов младших и средних возрастных групп до формирования у них явлений атрофии и кишечной метаплазии. В основу такой тактики должны ложиться локальные эпидемиологические данные о распространенности предраковых изменений желудка в конкретных возрастных группах [54].
Утверждение 17. H. pylori-инфицированные лица должны быть подвергнуты ЭТ в отсутствие противопоказаний к ее проведению и других причин (класс рекомендаций: сильный; уровень доказательности: высокий).
Потенциальные преимущества от ЭТ для каждого индивидуума включают остановку прогрессирующего повреждения СОЖ, профилактику и лечение H. pylori-ассоциированной язвенной болезни, снижение риска гастроинтенстинальных осложнений, связанных с терапией НПВС, снижение риска развития рака желудка [3, 55, 56]. Преимущества ЭТ для популяции в целом представлены снижением числа инфицированных лиц, способных передавать инфекцию, и снижением затрат здравоохранения, связанных с диагностикой и лечением H. pylori-ассоциированных заболеваний и их осложнений [3]. Таким образом, H. pylori-инфицированные лица должны получать курс ЭТ, за исключением пациентов, для которых эрадикация микроорганизма на текущий момент не является приоритетной задачей (лица с конкурирующими коморбидными состояниями), а также в случае если локальная политика здравоохранения не рассматривает ЭТ в качестве необходимого инструмента для реализации на всей популяции инфицированных лиц.
Утверждение 18. Прогностический эффект ЭТ в рамках канцеропревенции максимален до развития атрофических процессов в СОЖ (класс рекомендаций: сильный; уровень доказательности: высокий).
Максимальный канцеропревентивный эффект ЭТ проявляется в том случае, если она была успешно проведена до развития хронического атрофического гастрита и других предраковых состояний желудка [50–52]. Частота рака желудка возрастает с возрастом, как и частота развития хронического атрофического гастрита. Как только процесс атрофии принимает выраженный и распространенный характер, дальнейший риск развития рака желудка возрастает экспоненциально [3]. Согласно современным данным, ЭТ останавливает прогрессирующее повреждение СОЖ и снижает или полностью элиминирует молекулярные механизмы, задействованные в H. pylori-ассоциированном канцерогенезе. Известно, что хроническое воспаление, сопровождающее инфекцию H. pylori, ассоциировано с генерацией активных форм кислорода, способных разрушать структуру ДНК. Бактерия H. pylori может индуцировать гиперметилирование ДНК, в частности островков CpG, что приводит к инактивации генов-онкосупрессоров (TP53, CDH1) и активации онкогенов [57]. Помимо этого H. pylori может приводить к двухцепочечным разрывам ДНК и изменять экспрессию микро-РНК, увеличивая генетическую нестабильность [57, 58]. Таким образом, целесообразно проведение скрининговых мероприятий и при необходимости – назначение ЭТ с целью канцеропревенции до развития хронического атрофического гастрита.
Утверждение 19. Выбор протокола эрадикации инфекции H. pylori должен основываться на локальных данных по эффективности конкретных схем ЭТ с учетом антибиотикорезистентности и уровня потребления конкретных антибиотиков в рассматриваемой популяции. Оптимален подбор схемы ЭТ на основании индивидуальной чувствительности штамма (класс рекомендаций: сильный; уровень доказательности: высокий).
Эффективность ЭТ зависит от уровня распространенности антибиотикорезистентности штамма в популяции и от индивидуальных генетических особенностей пациента, связанных с метаболизмом препаратов (полиморфизмы генов CYP2C19, MDR1) [2, 3, 59, 60]. Распространенность антибиотикорезистентности H. pylori к основным препаратам, используемых в схемах ЭТ, широко варьируется в мире и ассоциирована с уровнем потребления конкретных антибиотиков в регионе [2, 61, 62]. В зависимости от конкретного региона только схемы ЭТ, которые позволяют добиваться эффективности ≥90%, должны использоваться в качестве эмпирической терапии [63, 64].
Утверждение 20. Эрадикация H. pylori снижает риск развития рака желудка. Степень снижения риска зависит от наличия, тяжести и распространенности атрофических процессов к моменту назначения эрадикации (класс рекомендаций: сильный; уровень доказательности: высокий).
Инфекция H. pylori остается ведущей причиной развития рака желудка [1, 2, 58, 65]. Успешная эрадикация H. pylori нивелирует основной каузативный фактор рака желудка и тем самым снижает частоту этой неоплазии в популяции. Эффективность эрадикации H. pylori в рамках превенции рака желудка зависит от выраженности и распространенности атрофических изменений слизистой оболочки на момент назначения ЭТ и варьируется от полного нивелирования риска для пациентов с неатрофическим гастритом до стабилизации или уменьшения риска для пациентов с уже сформировавшимися атрофическими изменениями [51, 52]. Индивидуальный риск развития рака желудка может быть детерминирован с использованием валидизированных стратификационных систем патоморфологической оценки биоптатов – OLGA и OLGIM [44–46].
Утверждение 21. Необходим контроль эффективности применяемой схемы ЭТ, приоритет должен отдаваться неинвазивным тестам (класс рекомендаций: сильный; уровень доказательности: высокий).
С учетом того что частота неудачи при применении ЭТ достаточно высока, в каждом индивидуальном случае необходим контроль успешности эрадикации [2, 5, 59]. С этой целью приоритет должен отдаваться неинвазивным тестам, таким как уреазный дыхательный тест или иммуноферментный анализ кала на антиген H. pylori [5]. Для пациентов, которым требуется динамическое эндоскопическое наблюдение (например, после эндоскопического удаления аденомы желудка), контроль эффективности ЭТ может проводиться путем гистологической оценки биоптата.
Утверждение 22. Эрадикация H. pylori не может полностью элиминировать риск развития рака желудка. Пациенты с выраженными и распространенными явлениями атрофии СОЖ остаются в группе риска. Для этой когорты пациентов целесообразно длительное динамическое наблюдение с регулярной эндоскопической и гистологической оценкой (класс рекомендаций: сильный; уровень доказательности: высокий).
Длительное динамическое наблюдение, включающее эндоскопическое обследование, должно базироваться на оценке риска развития рака желудка после эрадикации H. pylori [52, 66]. Риск рака желудка коррелирует с выраженностью и распространенностью явлений атрофии слизистой оболочки, ввиду чего индивидуальная стратификация риска должна основываться на валидизированных гистологических системах, таких как OLGA и OLGIM [44, 46]. Пациентам, у которых инфекция H. pylori была диагностирована неинвазивным путем (уреазный дыхательный тест или иммуноферментный анализ кала), может потребоваться дополнительная гистологическая оценка биоптата. К этим пациентам относятся лица старших возрастных групп, у которых возрастает вероятность атрофических изменений СОЖ, а также пациенты с отягощенным анамнезом по язвенной болезни желудка и лица, у которых уровень пепсиногена-I ≤70 нг/л и соотношение пепсиноген-I/пепсиноген-II ≤3,0. Перечисленные выше пациенты относятся к группе высокого риска развития рака желудка и требуют длительного наблюдения, а также регулярных эндоскопических обследований [1, 2, 48, 67, 68].
Заключение
В целом Киотский консенсус сыграл важную роль в современном понимании проблемы воспалительной патологии гастродуоденальной зоны и определении путей ее разрешения. Преимущественно утверждения консенсуса затрагивали вопросы классификации, диагностики и лечения H. pylori-ассоциированного гастрита. Что касается дуоденита, то, к сожалению, в материалах консенсуса все ограничилось предложениями по новой классификации данной патологии, органически связанной с гастритом, в т.ч. ассоциированным с H. pylori. Вместе с тем это немаловажная тема. Достаточно вспомнить, что именно H. pylori на фоне избыточного закисления в ДПК (пептического дуоденита) и последующей желудочной метаплазии, заселяя участки последней, является причиной двенадцатиперстной локализации язвы. ДПК, подобно желудку, подвержена различным хроническим воспалительным состояниям. Корреляция результатов клинических, эндоскопических и гистологических исследований дуоденальных биоптатов полезна не только для диагностики воспалительных заболеваний ДПК пептической природы, но и для распознавания других воспалительно-дистрофических процессов, поражающих ДПК. Это в первую очередь такие заболевания, как болезнь Крона, целиакия, а также некоторые инфекции, инвазии и пр. Сегодня понятие дуоденита, введенное почти 200 лет назад и описанное G.E. Кonjetzny (1925, 1930), Р.А. Лурия (1929), а в последние годы М.Р. Коноревым и соавт. (2003), И.В. Маевым, А.А. Самсоновым (2005), стало приобретать новое значение, и новая классификация, приведенная Киотским консенсусом, – первый шаг к углубленным исследованиям этой патологии.



