Бронхиальная астма (БА) – одно из самых частых респираторных заболеваний, которым в мире страдают около 360 млн людей. Она существенно снижает качество жизни пациентов, имеет высокую стоимость лечения, ежегодно становясь причиной смерти 400 тыс. больных в мире [1]. Ведение пациентов с БА регламентируется глобальной инициативой по БА (GINA – Global Initiative for Asthma) и Национальными российскими клиническими рекомендациями [2, 3].
В связи с появлением новых знаний об особенностях развития и течения БА в последнее время появляются новые группы препаратов, пересматриваются устоявшиеся схемы ведения пациентов, разрабатываются критерии оценки объема и режима необходимой терапии. В настоящей статье обсуждается терапия БА стабильного течения и перспективы ее развития.
Тяжесть и контроль БА
Выбор лечения в настоящее время определяется степенью тяжести БА, достижением ее контроля и фенотипом заболевания.
Тяжесть астмы ранее определялась на основании выраженности клинической картины и показателей функции легких до начала терапии. Как недостаток этого определения – оно не учитывало особенностей течения заболевания у пациентов, получавших лечение.
В настоящее время в международных и национальных рекомендациях тяжесть течения БА оценивается с учетом объема проводимой терапии, необходимого для достижения контроля (табл. 1).
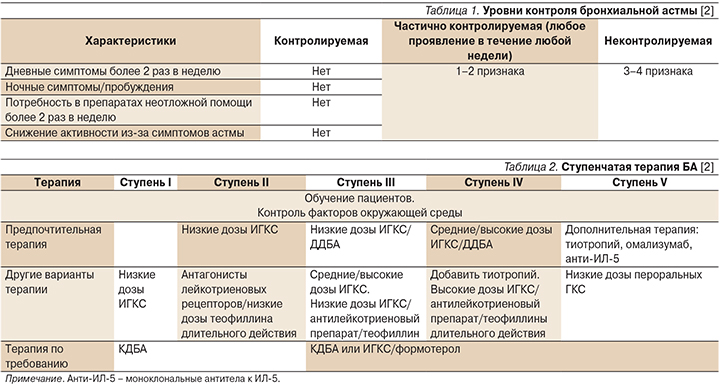
Сегодня выделяют три степени тяжести течения БА у больных, получающих лечение [2].
- Легкая астма: контроль достигается при использовании низких доз ингаляционных глюкокортикостероидов (ИГКС), антилейкотриеновых препаратов или β2-адреномиметиков короткого действия (КДБА).
- Астма средней тяжести: достижение контроля возможно при использовании низких доз ИГКС и β2-адреномиметиков длительного действия (ДДБА).
- Тяжелая астма для лечения требует 4–5 ступеней GINA (высокие дозы ИГКС совместно с ДДБА или антилейкотриеновыми препаратами/теофиллином) в предыдущий год или применения системных ГКС≥50% времени предыдущего года для достижения и сохранения контроля или которая остается неконтролируемой, несмотря на эту терапию [4].
Основные цели ведения пациентов с БА – это достижение и поддержание хорошего контроля симптомов болезни в течение длительного времени, профилактика обострений, улучшение функционального состояния легких.
Оценка контроля осуществляется путем оценки двух составляющих – контроля симптомов и определения риска будущих обострений, который зависит от многих факторов, в т.ч. дисциплины пациента, правильной техники приема ингаляционных препаратов, сопутствующих заболеваний, степени тяжести бронхиальной обструкции.
Показано, что достижение контроля возможно при адекватной терапии большинства пациентов. Для оценки контроля астмы в реальной клинической практике рекомендуется использовать специальные вопросники: АСТ (Asthma Control Test) и ACQ-5 (Asthma Control Questionnaire), позволяющих быстро и точно оценивать состояние больных врачами первичного звена и специалистами.
К факторам риска обострений или плохого контроля относятся высокая потребность в использовании бронхолитиков короткого действия, неправильное или недостаточное использование ИГКС, низкие показатели функции легких (объем форсированного выдоха за 1-ю секунду – ОФВ1<60%), высокая степень бронхиальной гиперреактивности, значимые психологические и социально-экономические проблемы, воздействие поллютантов и этиологически значимых аллергенов, курение, серьезные сопутствующие заболевания, эозинофилия крови и/или мокроты, высокий уровень оксида азота в выдыхаемом воздухе, беременность, интенсивная терапия по поводу обострения астмы в анамнезе, одно и более тяжелых обострений астмы за последние 12 месяцев [2].
Хорошо известно, что БА является гетерогенным заболеванием. Выделение особых групп пациентов по демографическим, клиническим, патофизиологическим принципам лежит в основе концепции фенотипов. В нашей стране это нашло отражение в классификациях БА, предложенных А.Д. Адо, П.К. Булатовым и Г.Б. Федосеевым [5].
В международных согласительных документах предложено выделять следующие фенотипы БА [2]:
- Аллергическая.
- Неаллергическая.
- Поздняя.
- С фиксированной бронхиальной обструкцией.
- С ожирением.
В настоящее время фенотипирование пациентов приобретает большое значение при назначении биологической терапии при тяжелой БА.
Ведение больных БА
Программа лечения пациентов включает установление партнерских отношений между больным и врачом, обучение, выявление и устранение факторов риска развития обострений, оценка и достижение контроля БА, лечение обострений, терапию особых случаев астмы (беременность, аспириновая астма и др.) и сопутствующих заболеваний.
Обучение служит важнейшим условием для установления партнерских отношений между врачом и пациентом, повышающим их приверженность лечению.
Устранение факторов риска развития обострений (аллергенов, инфекции, лекарственных препаратов, поллютантов и др.) и лечение сопутствующих болезней (аллергический ринит, полипом носа, сердечно-сосудистые заболевания, гастроэзофагеальный рефлюкс и др.) позволяют добиваться контроля течения болезни и сокращать потребность в лекарственных препаратах. Перечень мер элиминационной терапии подробно изложен в международных и национальных руководствах [2, 3].
Фармакотерапия
Лекарственные препараты в большинстве случаев позволяют контролировать течение БА. Основным принципом лечения служит ступенчатый подход с увеличением объема терапии в отсутствие контроля и/или при наличии факторов риска обострений. Снижение доз лекарственных препаратов предусмотрено при достижении и сохранении контроля и отсутствии факторов риска. Каждая ступень включает основные и альтернативные варианты лечения [2].
Ступенчатая терапия БА приведена в табл. 2.
При контролируемой БА больному рекомендуется использовать минимально необходимый уровень лечения. При частично контролируемой и неконтролируемой БА назначается более высокая ступень лечения.
Фармакотерапия легкой БА
Под легкой БА понимают течение заболевания, при котором для достижения контроля терапии не требуется вообще либо достаточно минимальных доз контролирующих препаратов (низкие дозы ИГКС или антилейкотриеновые препараты) [2]. Кроме того, в соответствии с рекомендациями Российского респираторного обществ к этой группе можно отнести пациентов, ранее не получавших лечения, которым врач предполагает начать его с терапии, соответствующей I–II ступеням [6].
Первая ступень терапии предусматривает возможность использования КДБА «по требованию». Увеличение потребности в КДБА, особенно их ежедневное использование, указывает на утрату контроля БА и необходимость пересмотра терапии.
Если у пациента чаще 2 раз в месяц возникает необходимость в использовании препаратов скорой помощи, ему показаны противовоспалительные средства. Важно, что у больных легкой БА уровень воспаления не всегда коррелирует с выраженностью симптомов. При легком течении могут развиваться тяжелые обострения и даже наступать летальный исход [6].
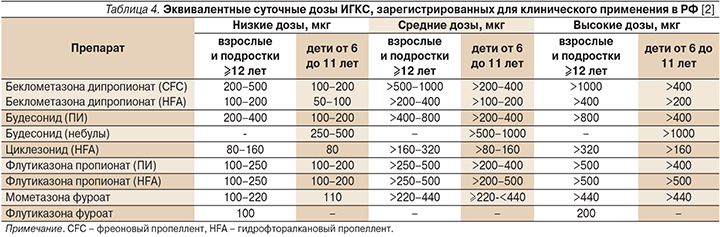
К наиболее эффективным противовоспалительным препаратам для лечения персистирующей БА любой степени тяжести, в т.ч. легкой, относятся ИГКС. В настоящее время в России используются беклометазона дипропионат (БДП), будесонид (БУД), флутиказона пропионат (ФП), флутиказона фуроат (ФФ), мометазона фуроат (МФ), циклесонид (ЦИК) (табл. 3).
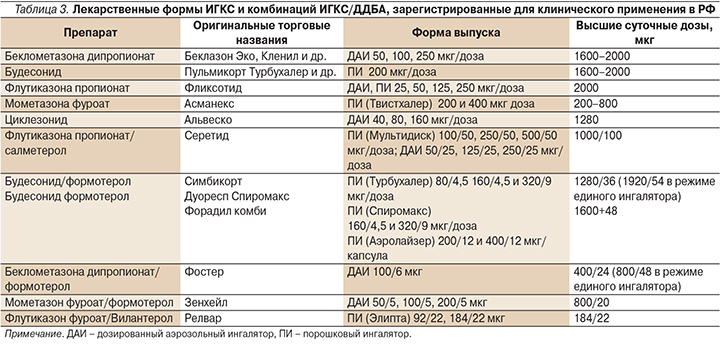
Эквивалентные дозы ИГКС для терапии БА различной тяжести течения приведены в табл. 4.
ИГКС уменьшают выраженность клинических симптомов заболевания (частоту приступов удушья, потребность в β2-агонистах короткого действия и др.), повышают качество жизни больных, улучшают бронхиальную проходимость и снижают гиперреактивность бронхов к аллергенам и неспецифическим раздражителям (физической нагрузке, холодному воздуху и др.), предупреждают развитие малообратимых изменений дыхательных путей (ремоделирование), уменьшают частоту обострений астмы и госпитализаций пациентов, уменьшают летальность от БА.
Известно, что эффективность лечения ИГКС тем выше, чем раньше они применяются. Большая часть терапевтических эффектов этих препаратов развивается при их использовании в низких и средних дозах.
Основные причины, вызывающие отказ пациентов от приема ИГКС, – это их побочные эффекты [7], отсутствие у препаратов этого класса очевидного для больных эффекта в первые дни терапии, тревога пациентов за свое здоровье в связи с приемом «гормональных препаратов». Среди наиболее часто встречающихся местных побочных эффектов – ротоглоточный кандидоз (реже – кандидоз пищевода), дисфония (осиплость голоса), ирритация верхних дыхательных путей (кашель и бронхоспазм). В связи с этим примерно трети больных легкой астмой настроены на прием препаратов «по потребности» только при появлении симптомов [8].
К мерам профилактики возможных побочных эффектов относятся использование минимально необходимой дозы ИГКС и минимально возможной кратности приема, правильная техника ингаляции, полоскание рта после ингаляции, назначение витамина D3 и кальция, нормализация физической активности, отказ от вредных привычек.
Низкая приверженность терапии ИГКС является одной из самых серьезных проблем в лечении БА. Ее возможным решением служит назначение комбинации ИГКС с бронхолитиком быстрого действия в режиме «по требованию», что позволяет повышать дисциплину пациентов, гибко варьировать дозу ИГКС в зависимости от выраженности симптомов в конкретный момент и уменьшать частоту обострений БА.
Возможность интермиттирующего приема ИГКС при легкой БА явилась предметом нескольких исследований. В одном из них было впервые показано, что применение комбинации БДП/сальбутамол в режиме «по требованию» не менее эффективно, чем регулярный прием ИГКС [9].
В настоящее время закончены два масштабных исследования по применению фиксированной комбинации будесонид/формотерол в режиме «по требованию» при легкой БА (SYGMA 1 и 2-SYmbicort Given as need in Mild Asthma), в которых принимали участие и российские центры [10, 11]. В исследование SYGMA-1 больные были разделены на три группы. Первая получала плацебо дважды в сутки и КДБА (тербуталин) «по потребности», вторая – плацебо дважды в сутки и будесонид/формотерол (БУД/ФОРМ) «по потребности», третья – БУД дважды в сутки и тербуталин “по потребности”. Терапия проводилась в течение 52 недель.
Результаты показали, что по достижении контроля БА и снижении обострений прием комбинация БУД/ФОРМ «по потребности» был эффективнее, чем ситуационный прием тербуталина, и не отличался от постоянного приема БУД по влиянию на число обострений. Показано, что кумулятивная доза БУД при использовании терапии БУД/ФОРМ «по требованию» была на 83% ниже, чем при постоянном приеме препарата.
В исследование SYGMA-2, аналогичное по критериям включения и продолжительности, пациенты были рандомизированы в одну из двух групп: прием плацебо дважды в сутки и БУД/ФОРМ «по требованию», прием БУД дважды в сутки и тербуталина «по требованию». Результаты подтвердили, что использование комбинации БУД/ФОРМ «по потребности» не менее эффективно, чем регулярный прием БУД, предупреждает обострения БА [8].
Интермиттирующий прием БУД/ФОРМ кроме влияния на течение заболевания уменьшает риск побочных эффектов ИГКС и снижает стоимость лечения. Несомненно, что фиксированная комбинация БУД/ФОРМ «по требованию» в ближайшие годы будет зарегистрирована для клинического применения и найдет свое место при подборе индивидуальной терапии больных легкой астмой.
Другими возможностями терапии легкой БА является использование антилейкотриеновых препаратов в тех случаях, когда аллергия играет ведущую роль в этиологии БА и при этом имеются другие проявления респираторной аллергии (например, риноконъюнктивит) [12].
Из антилейкотриеновых препаратов в нашей стране взрослыми и детьми в настоящее время используются два блокатора рецептора цистенил-лейкотриенов: монтелукаст (Сингуляр) и зафирлукаст (Аколат). Эти препараты обладают слабым и вариабельным бронхорасширяющим эффектом, уменьшают выраженность симптомов и частоту обострений астмы, уменьшают бронхиальную гиперреактивность и хроническое воспаление дыхательных путей. Блокаторы цистенил-лейкотриенов применяются для базисной терапии БА, но их противовоспалительный эффект выражен слабее, чем у ИГКС. Препараты выпускаются в форме для перорального приема, что способствует большей приверженности лечению пациентов, которые в силу разных причин не желают или не могут применять ингаляционную терапию.
Антилейкотриеновые препараты обладают хорошей переносимостью. Они применяются при лечении аспириновой астмы, БА физического усилия и аллергического ринита [2, 12].
Кромоны (кромогликат натрия и недокромил натрия) стабилизируют мембраны тучных клеток и тем самым подавляют выделение медиаторов в раннюю и позднюю фазы аллергических реакций. По силе противовоспалительного эффекта эти препараты значительно уступают ИГКС, в связи с чем они не вошли в перечень препаратов, рекомендуемых для ступенчатой терапии БА [2].
Фармакотерапии БА средней тяжести течения
Астма средней степени тяжести предусматривает достижение контроля при применении III ступени терапии. Предпочтительные варианты лечения – это постоянный прием комбинации низких доз ИГКС/ДДБА (см. табл. 3) или использование низких доз ИГКС/формотерол для поддерживающего лечения и «по требованию» для купирования симптомов БА (терапия единым ингалятором). Эффективность режима единого ингалятора доказана в многочисленных клинических исследованиях и наблюдениях в реальной клинической практике. Такой режим дозирования позволяет предупреждать тяжелые обострения БА, уменьшать частоту госпитализаций пациентов и улучшать контроль астмы при использовании более низких доз ИГКС.
К другим вариантам лечения на III ступени относится применение средних или высоких доз ИГКС, менее эффективное, чем добавление к терапии ДДБА, использование низких доз ИГКС/антилейкотриеновых препаратов/теофиллина с использованием «по требованию» КДБА.
Фармакотерапия тяжелой астмы
Для пациентов с тяжелой БА кроме высоких доз комбинированных препаратов ИГКС/ДДБА существует дополнительная терапия, к которой относят тиотропия бромид, биологические препараты и системные ГКС.
Тиотропия бромид (ТБ) в системе доставки Респимат (Спирива Респимат) может быть назначен пациентам с тяжелой БА и неконтролируемыми симптомами на фоне приема ИГКС или ИГКС/ДДБА; при сохраняющихся частых или тяжелых обострениях астмы; больным, имеющим фиксированную бронхиальную обструкцию (т.е. отношение ОФВ1/ФЖЕЛ – форсированная жизненная емкость легких <0,7 после пробы с бронхолитиком), сопутствующую хроническую обструктивную болезнь легких (ХОБЛ), при наличии ограничений по применению ДДБА. Дополнительными показаниями к назначению ТБ могут служить курение, преобладание ночных симптомов БА и положительный бронходилатационный тест с КДБА у пациентов с неконтролируемой БА [13].
Биологическая терапия с помощью моноклональных антител, направленных против основных цитокинов, участвующих в формировании БА, является новым направлением в лечении астмы и требует тщательного отбора пациентов на основании клинических и биологических маркеров. Строгий отбор необходим, с одной стороны, для получения оптимального эффекта терапии, с другой – с целью избежать неоправданных затрат, поскольку использование биологических препаратов считается дорогостоящим лечением.
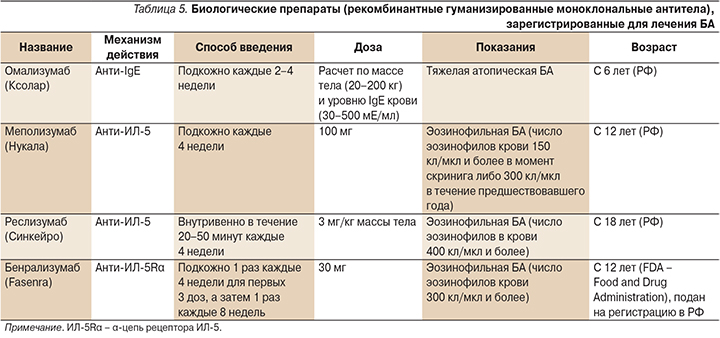
Препараты гуманизированных моноклональных антител к иммуноглобулину Е (IgE) (омализумаб), к интерлейкину-5 – ИЛ-5 (меполизумаб, реслизумаб) и рецепторам ИЛ-5 (бенрализумаб), преимущественно направленные на контроль эозинофильного воспаления в дыхательных путях больных тяжелой БА (T-2 эндотип заболевания), зарегистрированы для лечения тяжелой астмы и внесены в ступенчатую терапию [2].
Препараты моноклональных антител для лечения тяжелой эозинофильной астмы (табл. 5) снижают частоту обострений, улучшают контроль заболевания и качество жизни пациентов, повышают показатели функции легких, а также снижают потребность больных гормонозависимой БА в системных ГКС [14–16]. В последнее время предложены алгоритмы дифференцированного назначения анти-IgE и анти-ИЛ-5 [17, 18].
В настоящее время в процессе регистрации и клинических исследований находятся другие биологические молекулы: антагонисты ИЛ-4/13 (Dupilumab – полностью человеческое антитело к α-цепи рецептора ИЛ-4 ), антагонисты тимического стромального лимфопоэтина (анти-TSLP), ИЛ-33 и др. [19–21]. В качестве дополнительных показаний к назначению анти-IgE, анти-И-5 и анти-ИЛ-4/13 рассматриваются назальный полипоз, атопический дерматит (Dupilumab) и гиперозинофильный синдром (Меполизумаб). Продолжаются исследования «малых молекул», направленных на основные медиаторы воспаления и предназначенных для ингаляционного введения при БА.
В тяжелых случаях болезни показано использование системных глюкокортикоидов (СГКС). Пероральное и парентеральное применение СГКС показано пациентам с тяжелыми обострениями астмы (ургентная ситуация) и при наличии тяжелых персистирующих или часто рецидивирующих симптомов, несмотря на терапию высокими дозами ИГКС. Используется минимальная доза препаратов, позволяющая достигать контроля астмы.
В связи с наличием ИГКС и внедрением в клиническую практику принципиально новой биологической терапии БА длительное назначение CГКС в настоящее время применяется достаточно редко.
В качестве других методов лечения тяжелой БА, в т.ч. неэозинофильного (не-Т2) ее фенотипа, относится длительное применение азитромицина с учетом его противовоспалительной и иммуномодулирующей активности [22], но пока данный подход не рекомендуется для рутинной клинической практики.
Для тяжелой резистентной БА предложена бронхиальная термопластика, механизм действия которой основан на снижении массы гладких мышц дыхательных путей путем нагревания бронхиальной ткани до 65°С с помощью радиочастотного катетера, вводимого через бронхоскоп. При ее использовании у пациентов уменьшалась частота обострений БА и улучшалось качество жизни, при этом контроль заболевания существенно не изменялся [23]. В России этот метод лечения пока не применяется.
Под нашим наблюдением в 2016–2017 гг. находились 606 амбулаторных пациентов с БА (172 – с легкой астмой, 273 – со средней степенью тяжести и 161 – с тяжелой) в возрасте от 18 до 89 лет, направленных на консультацию врачами-терапевтами. По разным причинам ранее не получали ИГКС 70% больных легкой, 31% – со средней тяжестью и 12% больных с тяжелой БА. Терапия I ступени была назначена 7% пациентов, II – 12%, III– 50%, IV – 22% и V ступени – 9% (из них 29 больных использовали СГКС, 3 – лечение анти-IgE и анти-ИЛ-5). При тяжелом течении болезни исходно контроль не был достигнут (средний балл ACQ-5 – Asthma Control Questionnaire ≥1,5) 80% больных на IV и 78% – на V ступенях терапии. Через год регулярного лечения доля пациентов с неконтролируемой БА на IV ступени составила 51% (p<0,01), на V – 60%, в т.ч. части пациентов удалось снизить дозу, 4 больным – полностью отменить СГКС. Полученные нами данные подтверждают, что ведение пациентов с БА в реальной практике часто не соответствует национальным и международным рекомендациям. Контроль БА при использовании современных лекарственных препаратов может быть достигнут значительной частью пациентов с тяжелым течением заболевания.
Аллерген-специфическая иммунотерапия (АСИТ)
АСИТ заключается в повторных введениях больным атопической БА лечебных аллергенов (аллерговакцин) с целью снижения чувствительности пациентов к их воздействию. Классический способ иммунотерапии представляет собой подкожные инъекции стандартизованных водно-солевых растворов аллергенов (клещевых, пыльцевых, грибковых, эпидермальных аллергенов и аллергенов яда насекомых) в постепенно возрастающих концентрациях по специальным схемам и далее – поддерживающее лечение в течение 3–5 лет. В последние годы в России начала активно использоваться сублингвальная АСИТ. Показано, что она улучшает контроль, снижает потребность больных в ИГКС и частоту обострений астмы [24, 25].
Метод имеет ряд ограничений. АСИТ противопоказана при обострениях астмы, отсутствии контроля и при тяжелом ее течении (ОФВ1<70% на фоне адекватной терапии), при множественной сенсибилизации (более 3 аллергенов), при наличии ряда тяжелых фоновых заболеваний, низкой дисциплине больных. Таким образом, АСИТ показана определенной части взрослых и детей с атопической астмой легкой и средней тяжести течения.
Заключение
Результаты выполненных исследований свидетельствуют о том, что современная терапия позволяет достигать контроля течения БА у значительной части больных. Большое значение имеет осведомленность врачей и пациентов о существующих подходах к лечению этого заболевания. Внедрение в клиническую практику международных и национальных рекомендаций позволит улучшить качество оказания медицинской помощи пациентам и снизить вероятность развития неблагоприятных исходов при этом заболевании. Ближайшее совершенствование терапии предусматривает использование комбинации ИГКС/формотерол «по требованию» при легкой БА и биологических препаратов при тяжелом течении болезни.



