Генерики: законодательные и экономические аспекты
Мировая история законодательства в сфере лекарственных средств (ЛС) включает следующие важнейшие события. 1906 г. – Закон о пищевых продуктах и лекарствах, регулирует обращение пищевых продуктов и лекарств. 1938 г. – Закон о пищевых продуктах, лекарствах и косметике, устанавливающий стандарты безопасности. 1962 г. – FDA США модифицировало стандарты Kefauver–Harris профилактической безопасности и эффективности ЛС.
С 1980 г. наблюдалось резкое увеличение клинического использования непатентованных лекарств, но систематической оценки их терапевтической эффективности по сравнению с новаторскими препаратами еще не проводилось [1, 2]. 24.09.1984 Конгрессом США был принят Закон о конкуренции цен на лекарства и восстановлении срока действия патента, неофициально известный как Закон Hatch–Waxman, поощряющий производство генериковых лекарств фармацевтической промышленностью, в котором было предложено утверждение копий всех основных лекарств, появившихся на рынке после 1962 г.
В итоге в США была создана современная система государственного регулирования ЛС [3]. В частности, была упрощенная заявка на новое лекарство (ANDA), которую фармацевтические компании должны подавать в регулирующие органы для получения разрешения на продажу генерика. Процесс ANDA не требовал, чтобы производитель проводил повторные испытания генериков на животных, что часто отнимает много времени, поскольку их фирменные версии уже были проверены и одобрены на предмет безопасности и эффективности. Заявки на генерики формулировались по мере истечения срока действия патентных и других исключительных прав производителя оригинального препарата (ОП) [4]. После принятия Закона Hatch–Waxman количество рецептов на генерики в Соединенных Штатах стало быстро расти [5]. Производители непатентованных лекарств не должны были тратить дополнительные деньги на разработку молекулы, доклинические и клинические испытания. Генерики стали доступными по более низкой цене, они дали возможность населению экономить в расходах на ЛС. В 2002 г. FDA заявило, что американцы сэкономили 56,7 млрд долл. и могут сэкономить дополнительно 1,32 млрд в год с помощью непатентованных лекарств [6].
Как правило, генерики на 30–80% дешевле, чем ОП. Часто возникает вопрос: сравнимо ли качество и эффективность генериков с оригинальными брендами? Сторонники генериков утверждают, что они также эффективны, как брендированные генерики (изготовленные по патентному и лицензионному соглашению) или ОП [7]. Скептики, напротив, утверждают, что использование непатентованных лекарств может приводить к пролонгации заболевания или даже к терапевтической неудаче, поскольку биодоступность генерика может не соответствовать таковой ОП [8]. Следовательно, важнейшими факторами, влияющими на качество непатентованных лекарств, являются чистота, эффективность, стабильность и скорость высвобождения, которые должны контролироваться в рамках соответствующих параметров для обеспечения желаемого качества ЛС.
Несмотря на их важность в отношении сокращения бюджетных расходов на здравоохранение, поощрения конкуренции и занятости в области фармацевтики, непатентованные ЛС остаются предметом острых дискуссий, что обусловлено ускоренным процессом одобрения их использования человеком (с которым некоторые не согласны), а также спорадическими сообщениями о побочных эффектах и смертях, связанных с их применением [9–11]. Однако следует помнить, что принуждение производителей непатентованных лекарств пройти тот же путь, необходимый для выведения на рынок новаторских лекарств, подразумевает перерасход средств, приблизительно оцениваемый в 150–800 млн долл. на каждый препарат, что противоречит их основной задаче: регулировать и снижать цены на лекарства [12] .
Был предложен простой и недорогой процесс для утверждения генериковых версий ОП, не требующих сравнительных доклинических или клинических исследований их безопасности и/или эффективности, т.к. генерики должны демонстрировать результаты, аналогичные полученным с ОП [13]. Терапевтическая эквивалентность генериков предполагается после подтверждения их фармацевтической эквивалентности и биоэквивалентности по отношению к ОП [14–16]. Кроме того, только основной фармацевтический ингредиент считается ответственным за фармацевтическую эквивалентность без особого внимания к связующим веществам, разбавителям, эксципиентам (наполнителям), примесям, присутствующим во всех составах, которые могут широко варьироваться между генериками и ОП, влияющими на их безопасность и эффективность [17–19], Следует отметить, что иногда органы регулирования ЛС отказываются от требования биоэквивалентности для фармацевтически эквивалентных внутривенных растворов, поскольку их биодоступность считается «самоочевидной» [20].
Перспектива получения того же лекарства с меньшими затратами заманчива для всех, кто платит за лекарства, – как для пациента, так и для страховщика. Экономия для страховщиков и частных лиц огромна: цены могут упасть на 90% и более практически «за одну ночь». В 2012 г. два «блокбастера», Плавикс и Сероквель, утратили патентную защиту, и только по этим двум препаратам для здравоохранения было сэкономлено 10 млрд долл. Ожидается, что «патентный конец» сократит объем продаж запатентованных лекарств в мире в течение следующих 5 лет на 255 млрд долл. Если вы принимаете лекарство, отпускаемое по рецепту, но еще не принимаете генерик, возможно, это произойдет в будущем.
Сегодня основные участники лечебного процесса – врачи и их пациенты – очень неоднозначно высказывают свое отношение к генериковым ЛС, особенно непатентованным (небрендированным), произведенным без дорогостоящего патентного соглашения с производителем ОП. Мы знаем, что в генериковых ЛС могут использоваться разные химические версии ОП, например другая соль или иные вспомогательные вещества для стабилизации препарата [21]. Каждое из этих изменений может приводить к различиям в абсорбционных свойствах или даже к неблагоприятным реакциям. Однако эти возможные проблемы остаются невыясненными, поскольку непатентованные ЛС не проходят строгих клинических испытаний, как это происходит с ОП.
Фирменные, или брендированные, генерики являются вариантом воспроизведенных ЛС. Фирменный генерик – это биоэквивалентный препарат, продаваемый под торговой маркой другой компании. Компания – производитель такого генерика подает заявку на новое лекарство и продает его под собственным наименованием, а не под международным непатентованным названием (МНН). Он идентичен брендовому продукту по внешнему виду (форма, цвет, маркировка) и неактивным ингредиентам. Эти лекарства называются «псевдогенериковыми», или «ультрагенериковыми» [22].
Спрос на непатентованные лекарства растет во всем мире, и фармацевтические компании осознают этот огромный потенциал. Всегда нужны эффективные и недорогие лекарства, что и определяет рост фармацевтического рынка. Рост мирового рынка непатентованных лекарств прогнозируется на уровне 8,7% в год. Это означает, что с 2016 по 2021 г. их мировой рынок увеличится с 352 до 533 млрд долл. [23].
Расследование Katherine Eban
Индия является крупнейшим поставщиком генериковых ЛС в мире. В частности, индийская фармацевтическая отрасль обеспечивает более 50% мирового спроса на различные вакцины и 25% всех лекарств в Великобритании. В настоящее время более 80% антиретровирусных препаратов, используемых во всем мире для борьбы со СПИДом (синдром приобретенного иммунодефицита), поставляются индийскими фармацевтическими фирмами [24].
В стране имеется масса квалифицированных ученых и инженеров, способных вывести отрасль на еще более высокий уровень.
В июне 2019 г. американская журналистка Katherine Eban выпустила книгу-расследование под названием «Bottle of Lies» («Бутылка лжи») [25] с подзаголовком «Горькая сторона фармацевтической истории Индии». В ходе расследования Eban получила 20 тыс. внутренних документов FDA, которые «показали, что у следователей FDA (Food and Drug Administration – Управление по санитарному надзору за качеством пищевых продуктов и медикаментов в США) есть серьезные сомнения в качестве лекарств, производимых на зарубежных заводах», пишет она. Журналистка упоминает о нескольких врачах из клиники Кливленда, которые поднимали проблему качества генериков. Многие пациенты с трансплантацией сердца перенесли отторжение органа после перехода на генериковый такролимус. Автор приводит в качестве примера врача-кардиолога, который не смог стабилизировать состояние пациентов на определенных генериках. Он фактически идентифицировал лекарства, которые являлись особенно проблематичными. FDA провело расследование, и эти лекарства были отозваны с рынка. Из-за отрицательных результатов проверок, полученных на заводах с 2014 по середину 2015 г., FDA запустило пилотную контролирующую программу в Индии. Было решено, что все проверки будут осуществляться без предварительного уведомления. Уже первые результаты проверок оказались ошеломляющими. На заводах работали группы по подготовке к инспекциям FDA. Они изменяли данные, фальсифицировали документы, даже придумывали несуществующие стандартные операционные процедуры. Документы подвергались различным воздействиям, чтобы выглядели старыми. Инспекторы FDA выяснили, что по одному препарату были полностью сфабрикованы испытания, чтобы доказать, что он был стерильным. Не было никаких тестов, а лаборатория, якобы проводившая их, ничего не проверяла, но все отчетные данные были безупречными. В своей книге Katherine Eban документирует два тревожных аспекта индийской фармацевтической промышленности, кажется, заложенных в самой ее структуре: философия «jugaad» – термин, переводимый с хинди как «творческая импровизация», с помощью которой цели достигаются любыми средствами, включая «гибкие правила», и т.н. многоуровневое качество изготовления, при котором лекарства производятся только на уровнях качества, необходимых для прохождения проверок в тех или иных странах, в которые лекарства экспортируются. Иными словами, качество лекарств варьируется в зависимости от требований потребителя. Автор описывает ситуации, когда «забракованные» входящей проверкой FDA препараты переупаковываются и отправляются в страны, где нет жесткого контроля, например к югу от пустыни Сахара. Katherine Eban раскрывает широко распространенный обман, связанный с производством генериков, создающий ужасные риски для здоровья во всем мире. Используя эксклюзивные отчеты разоблачителей, инспекторов и регулирующих органов наряду с тысячами страниц конфиденциальных внутренних документов FDA, К. Eban раскрывает природу индустрии, в которой широко распространено мошенничество, где компании фальсифицируют данные, а руководители обходят практически все принципы безопасного производства, чтобы минимизировать затраты и максимизировать прибыль. При этом пациенты невольно употребляют фальсифицированные лекарства с непредсказуемыми и даже опасными для жизни эффектами. Книга Katherine Eban произвела фурор в мировой фармацевтической и медицинской среде. Сегодня она обсуждается и цитируется на тысячах сайтах. Конечно, нельзя экстраполировать данные расследований автора на все генериковые препараты, которые выпускаются в мире. Запрет на эти ЛС оставит без лечения миллиарды людей.
Российские генерики
Неоднозначны также многочисленные публикации по уровню качества отечественных генериков – от огульного очернения всех этих препаратов до утверждений, что «все препараты под одним МНН абсолютно одинаковы». В России сегодня зарегистрировано рекордное количество лекарственных препаратов, которые дублируют друг друга под разными названиями. Как найти ту «золотую середину» в этом сонме ЛС, из которых пациент выбирает препарат для своего лечения? Врач назначает препарат по МНН, в аптеке же первостольник предлагает на выбор пациенту большой список аналогов, из которого несведущий больной, часто преклонного возраста, должен угадать, что ему лучше всего окажет помощь да еще и по приемлемой цене.
В идеале генерик должен доказать все виды эквивалентности с оригинальным препаратом – фармацевтическую, фармакокинетическую (биоэквивалентность) и терапевтическую. ЛС считаются фармацевтическим эквивалентом, если они не отличаются по составу активных ингредиентов, имеют одинаковые лекарственную форму и способ введения [26]. Качество генериков в значительной степени определяется качеством активной субстанции, а также зависит от вспомогательных веществ (наполнителей), т.к. они могут оказывать влияние на биодоступность, приводить к развитию токсических и аллергических реакций. Качество активных субстанций может быть невысоким вследствие изменения методов синтеза или очистки, что приводит к появлению в препарате токсичных примесей и продуктов деградации. Требования к наполнителям должны быть столь же жесткими, как и к активной субстанции. Более того, качество ЛС может зависеть и от упаковочных материалов, непосредственно контактирующих с ними. Требования, предъявляемые к упаковочным материалам, зависят даже от климатических условий. Оценка биоэквивалентности служит основным видом медико-биологического контроля воспроизведенных (генериковых) ЛС, не отличающихся лекарственной формой и содержанием действующих веществ от соответствующих ОП [26]. Основной критерий взаимозаменяемости ЛС – терапевтическая эквивалентность.
Генерик, произведенный в России, в ходе исследований оценивается ровно по тем же критериям, что и при регистрации в Евросоюзе. Причем российские правила регистрации, по словам участников рынка, в некоторых случаях даже более строгие, чем, например, американские. В России создана система Фармаконадзора, подразумевающая информирование Росздравнадзора о любых нежелательных побочных реакциях, которые могут быть связаны с применением того или иного препарата. Информацию должен в первую очередь предоставлять врач. Узнав от пациента о негативных явлениях, врач обязан заполнить определенную форму. Этого может потребовать и пациент или самостоятельно заполнить и направить извещение в службу надзора. На основе поступающих сообщений Росздравнадзор делает выводы о необходимости проверки ЛС.
К сожалению, не всегда врачи используют этот способ оценки лекарственного средства. Зачастую у нас врач боится подавать жалобу в Росздравнадзор, потому что любой такой рапорт влечет за собой проверку самого врача: а вдруг это именно он как-то не так выписал рецепт? Существуют и другие «подводные камни».
Как мы уже отмечали выше, многие отечественные генерики имеют достаточный уровень качества и вполне могут эффективно заменять ОП. Мы подробно исследовали два отечественных препарата Калмирекс (толперизон) и Фламадекс (декскетопрофен) на предмет фармацевтической эквивалентности.
Исследование биоэквивалентности Калмирекса и Фламадекса
Толперизон – миорелаксант центрального действия, Н-холинолитик. Уменьшает мышечный тонус и применяется для симптоматического лечения мышечных спазмов и других заболеваний, сопровождающихся повышением тонуса либо дистонией. В ЦНИЛ Кемеровского государственного медицинского университета были проведены исследования на фармацевтическую эквивалентность генерика Калмирекс с ОП двумя методами.
Были проанализированы инфракрасные спектры (ИКС) генерика Калмирекс и ОП (рис. 1). Структурный анализ по ИКС сводится к отысканию характеристических полос поглощения и их отнесению к соответствующим структурным элементам. Отнесение проводится с учетом численных значений частот максимумов поглощения, контура (формы) и интенсивности полос.
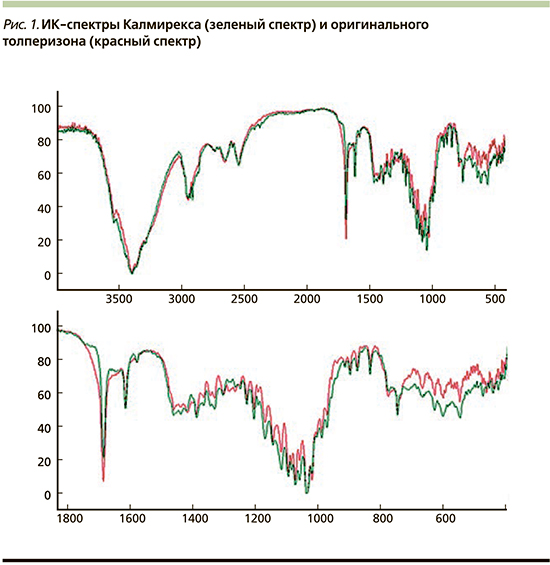
Исследованные нами образцы имели идентичные ИКС. Валентные колебания связи С-Н метильной группы ароматического фрагмента прослеживались как полосы поглощения 2946, 2918, 2901 см-1. Полосы слабой интенсивности 2933 и 2853 см-1 соответствовали антисимметричным и симметричным валентным колебаниям метиленовой группы. Внутримолекулярная водородная связь смещала полосу поглощения в сторону низких частот, а именно 1677 см-1, соответствующую валентным колебаниям С=О в молекуле толперизона. Полоса средней интенсивности 1360 см-1 соответствовала деформационным колебаниям метильного фрагмента (алифатической его части). В свою очередь полоса 1310 см-1, по нашему мнению, соответствовала С-N. Полосы плоскостных колебаний связей С-Н ароматического фрагмента прослеживались в области 1300–1000 см-1. Валентные колебания С-С колец молекулы толперизона: 1607, 1454 см-1 с наличием «крыла» 1467 см-1. Полосы 778 и 749 см-1 соответствовали плоскостным деформационным колебаниям С-Н пиперидинового фрагмента. Исходя из вышеизложенного, рассматриваемые образцы препаратов толперизона обладают специфическим набором полос поглощения в ИК-области спектра. Сопоставимое сходство спектров, полученных в идентичных условиях, составляет не менее 96%.
Высокоэффективная жидкостная хроматография (ВЭЖХ), называемая также жидкостной хроматографией высокого давления, – наиболее перспективный аналитический вариант классической колоночной хроматографии в современном приборном исполнении. Метод ВЭЖХ широко применяется для целей количественного химического анализа в экологических, санитарно-гигиенических и ветеринарных исследованиях, при контроле качества и сертификации пищевой и сельскохозяйственной продукции, в медицине, фармацевтике, нефтехимии, криминалистике и пр.
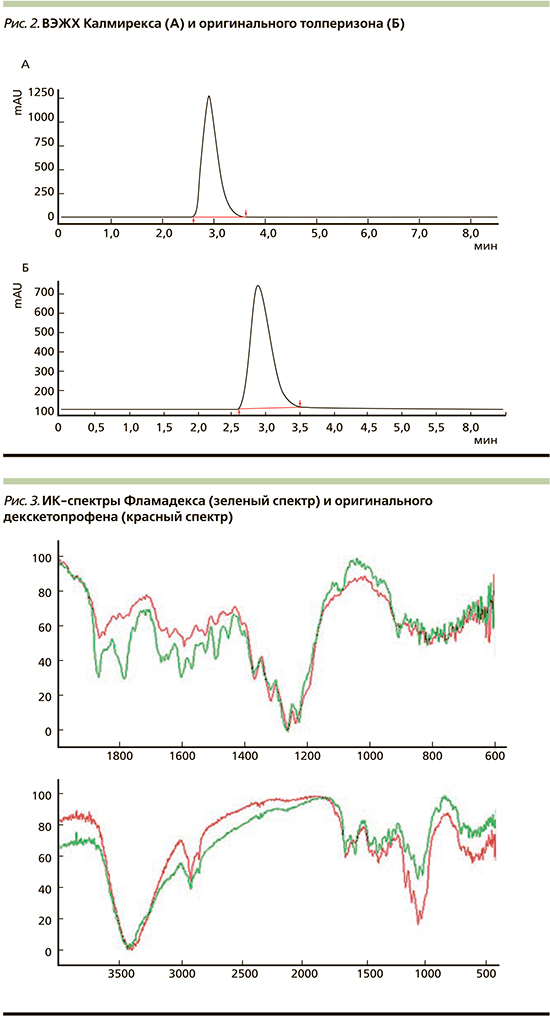
С целью более точного и глубокого анализа на фармацевтическую эквивалентность мы применили метод ВЭЖХ для изучения описываемых препаратов – генерика и оригинального толперизона. Хроматографический анализ проведен на хроматографе Shimadzu LC-20 Prominence с диодно-матричным детектором Shimadzu SPD20MA, на колонке с октодецилсиликагелем (колонка Gemini 5 мкм С18, 110 А, 250×4,6 мм); предколонка Security Guard Gartridge (C18) Phenomenex (США). Скорость потока 1,0 мл/мин, объем инжекции – 20 мкл. Температура колонки – 4000 С.
Препараты характеризовались сопоставимыми по времени удерживания действующего вещества с отличием р≥0,05. Элюция основного действующего вещества в препарате Калмирекс составила 2,911 минуты. В оригинальном толперизоне элюция основного действующего вещества составила 2,912 минуты. Таким образом, по данным ВЭЖХ, качественные и количественные параметры исследуемых препаратов обладают схожими сопоставимыми характеристиками (рис. 2).
Второй препарат Фламадекс – генерик декскетопрофена. Мы сравнили ИКС Фламадекса и оригинального декскетопрофена (рис. 3). Образцы обладали характеристическими полосами поглощения. Так, полоса 1652 см-1 соответствовала валентным колебаниям С=О, сопряженным с арильными фрагментами. Полоса средней интенсивности 1573 см-1, характерная для Фламадекса, обусловлена антисимметричными валентными колебаниями связей в карбосилат-анионе. Симметричные валентные колебания той же группы обнаружились у оригинального декскетопрофена при 1384 см-1,
для Фламадекса – при 1392 см-1. Данное смещение, по нашему мнению, обусловлено специфическим влиянием вспомогательных компонентов. Валентные и деформационные колебания С-С(=О)-С соответствовали широкой полосе около 1283 см-1. Таким образом, общая структура ИКС, частоты полос обладает общими аналогиям для обоих образцов. Сопоставимость спектров составила более 90%.
Для более точного и глубокого анализа на фармацевтическую эквивалентность мы также для изучения описываемых препаратов применили метод ВЭЖХ (рис. 4).

В 2015 г. проведено открытое сравнительное многоцентровое рандомизированное исследование эффективности и безопасности препаратов Калмирекс®, раствор для внутривенного и внутримышечного введения (ЗАО ФармФирма Сотекс, Россия), и оригинального препарата толперизон+лидокаин, раствор для внутривенного и внутримышечного введения (ОАО Гедеон Рихтер, Венгрия), при лечении пациентов с миофасциальным болевым синдромом средней и тяжелой степеней выраженности, включая мышечный спазм при дорсопатиях. В исследовании участвовали клинические центры Барнаула, Кемерова, Новосибирска, Северска и Томска. Протокол исследования TLP-2013-03-35. Оценка эффективности проведена для первичных и вторичных переменных. У 100% пациентов, принимавших исследуемый препарат, терапия признана эффективной по главной переменной, в отношении пациентов, принимавших препарат сравнения, эффективность составила 96,67%. В ходе оценки безопасности проведено сравнение результатов лабораторных исследований (общего анализа крови, биохимического анализа крови и общего анализа мочи) на 1-й и 22-й дни. Также проводилась оценка жизненно важных показателей. Изменения их средних значений были схожими в обеих группах. Полученные в ходе исследования данные свидетельствовали о том, что исследуемый препарат и препарат сравнения одинаково хорошо переносились [27].
В 2013–2014 гг. проведено открытое сравнительное рандомизированное исследование в параллельных группах эффективности и безопасности препарата Фламадекс®, раствор для внутривенного и внутримышечного введения (ЗАО «ФармФирма «Сотекс», Россия), по сравнению с оригинальным декскетопрофеном, раствор для внутривенного и внутримышечного введения (А. Менарини Мэнюфекчеринг Лоджистикс энд Сервисиз С.р.Л., Италия) у пациентов после перенесенной аппендэктомии. Протокол исследования – KI/1112-1. По его результатам сделан вывод об одинаковой эффективности, о сходном профиле безопасности и переносимости препарата Фламадекс® (раствор для внутривенного и внутримышечного введения) по сравнению с оригинальным декскетопрофеном (раствор для внутривенного и внутримышечного введения) при терапии послеоперационного болевого синдрома у пациентов, которым проводилось хирургическое вмешательство по поводу острого неосложненного аппендицита (традиционная аппендэктомия) [27].
Таким образом, мы изучили фармацевтическую эквивалентность препаратов Калмирекс® и Фламадекс® с оригинальными аналогами, которая по ИКС составила более 98%, по ВЭЖХ – до 100% сходства. В сравнительных исследованиях по терапевтической эквивалентности эти препараты также продемонстрировали одинаковую эффективность, безопасность и переносимость с оригинальными брендами.
Заключение
В заключение хотелось бы подчеркнуть, что, хотя ОП, несомненно, надежнее, роскоши лечиться только ими не может себе позволить ни одна страна в мире. Генерики – не благо и не зло. Это необходимое звено фармацевтического рынка. И двигатель прогресса – серьезный стимул для солидных инвестиций в разработку новых ЛС. Не будь генериков, компании, которые производят оригинальные, хорошо зарекомендовавшие себя на рынке препараты, давно бы успокоились и ничего нового не создавали. Копия – не всегда плохо. Главное – чтобы она была качественной.



