Патогенез истмико-цервикальной недостаточности (ИЦН) окончательно не изучен [1], разнороден [2]; не исключена ее идиопатическая форма [3]. В зарубежных руководствах к факторам риска ИЦН в первую очередь отнесены привычная потеря беременности во II триместре [3, 4], перенесенный в анамнезе преждевременный разрыв плодных оболочек в сроке беременности менее 27 недель [4] или 32 недель [3, 5], длина шейки матки (ШМ) до 27 недель беременности менее 25 мм, травма ШМ, врожденные аномалии матки или аномалии развития соединительной ткани (например, синдром Элерса–Данлоса) [1–5], перенесенное внутриутробно воздействие диэтилстильбэстрола [1, 3, 4]. В России факторы риска ИЦН четко разграничены на 7 групп (функциональные, анатомические, особенности настоящей беременности, генетические и врожденные, экстрагенитальные, особенности акушерско-гинекологического анамнеза, инфекционно-воспалительные и дисбиотические состояния), первостепенным из которых признана гиперандрогения (ГА) как яичникового (синдром поликистозных яичников), так и надпочечникового (адреногенитальный синдромом) генеза [2]. В отечественной балльной шкале оценки ИЦН [6] ГА во время беременности, наравне с данными трансвагинальной эхографии (расположение ШМ и предлежащей части плода, длина ШМ и раскрытие внутреннего зева) и анамнеза (сведения о перенесенном ранее позднем самопроизвольном выкидыше/ИЦН), оценивается как ее самостоятельный признак (2 балла), а сумма баллов 5–6 и более уже требует коррекции ИЦН.
ГА – это патологическое состояние, обусловленное избыточной продукцией андрогенов яичниками и/или надпочечниками или повышением локальной тканевой чувствительности к циркулирующим андрогенам, распространенность которого среди женщин составляет от 10 до 20% [7]. Синдром ГА заслуживает пристального внимания не только эндокринологов, но и акушеров-гинекологов, репродуктологов [8]. Сведения об эпидемиологии ГА у женщин с ИЦН, способах и эффективности ее коррекции отсутствуют в широком доступе. Значительно чаще отражается роль андрогенов в развитии кардиоваскулярных заболеваний и бесплодия [9], особенностях течения беременности и родоразрешения [10], метаболизме матери, функции плаценты и росте плода [11], сосудистых и плацентарных изменениях, значимых в патогенезе преэклампсии [12], гипертензии и дисбактериозе кишечника [13], репродуктивных потерях [14, 15]. ГА в целом общепризнана фактором риска репродуктивных потерь [7, 8, 16], но дискуссионные вопросы сохраняются. Наиболее часто выявляемой причиной ГА считается синдром поликистозных яичников (СПЯ), который наравне с ожирением, сахарным диабетом, кардиоваскулярными расстройствами, депрессией/тревожными расстройствами и др. прогнозируем по нарушению фертильности [17, 18, 19]. Однако в отечественных рекомендациях «Синдром поликистозных яичников» (2022) [20] отмечено, что СПЯ действительно характеризуется 3–4-кратным повышением риска осложнений беременности (гестационного сахарного диабета, артериальной гипертензии, преэклампсии), особенно при «классическом» фенотипе СПЯ [21]. Тем не менее увеличение частоты выкидышей при естественном зачатии у женщин с СПЯ отрицается независимо от наличия ожирения, а частота невынашивания после индукции овуляции сопоставима с таковой при других формах бесплодия [20]. Неоднозначность репродуктивных рисков при СПЯ обусловлена наличием его четырех фенотипов, предложенных ранее Национальными институтами здоровья и учитываемых по сей день в «Международных рекомендациях по диагностике и лечению синдрома поликистозных яичников, основанных на доказательной медицине» [22]. Фенотипирование СПЯ основано на комбинации трех диагностических Роттердамских критериев – избытке андрогенов (И) + овуляторной дисфункции (О) + морфологии поликистозных яичников (М). Избыток андрогенов подразумевают три из четырех фенотипов СПЯ: фенотип А = И + О + М; фенотип B = И + О; фенотип С = И + М; фенотип D = О + М. Недостаточная изученность роли ГА в развитии ИЦН определила выполнение настоящего исследования.
Цель настоящего исследования: оценить сопряженность ИЦН с ГА.
Материалы и методы
Выполнено проспективное когортное контролируемое исследование в период 2014–2019 гг. Клиническая база: родильный дом № 1, филиал ГКБ №67 им. Л.А. Ворохобова (Москва). На этапе планирования исследования размер выборки обоснован при помощи формулы:
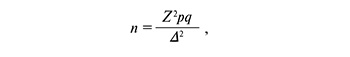
где: n – объем выборки; Z – коэффициент, соответствующий доверительному уровню; p – доля респондентов с наличием исследуемого признака; q=1-p – доля респондентов, у которых исследуемый признак отсутствует; ∆ – предельная ошибка выборки.
Включение женщин в исследование выполнялось по принципу случайной выборки с использованием программы случайных чисел.
Включены 98 женщин с одноплодной беременностью: 63 – с ИЦН (основная группа), 35 – без ИЦН (группа контроля).
Изучаемые исходы. Конечный результат исследования – оценка сопряженности ИЦН с ГА.
Критерии оценки исхода. Критерии ИЦН соответствовали отечественным руководствам [2, 23]. Методом высокоэффективной жидкостной хроматографии оценивали ГА по стероидному профилю и количественному определению стероидов мочи (мкМоль/24 ч): андростерона, этиохоланолона, дегидроэпиандростерона, 11-кетоандростерона, 11-кетоэтиохоланолона, 11β-гидроксиандростерона, 11β-гидроксиэтиохоланолона, сумму 17-кетостероидов, дискриминанту ван де Калсейде, прегнандиола, алло-прегнандиола, прегнанолона, дельта-5-прегнандиола, прегнантриола, 16-альфа-гидрокси-этиохоланолона, 16-альфа-гидрокси- андростерона.
Потенциальные вмешивающиеся факторы. К потенциально вмешивающимся факторам относили особенности менструального, гинекологического, репродуктивного анамнеза, общеклинические факторы (возраст, весовые характеристики женщины), особенности течения беременности.
Временем проспективного отслеживания изучаемого исхода рассматривали интервал от наступления беременности до диагностики ИЦН (экспозиция ГА) и до родоразрешения (исход).
Статистический анализ
Статистическую обработку и анализ данных выполняли с применением программ Microsoft Excel 2007, Statistica (версия 12.0; StatSoft; TIBCO Software). Описание количественных данных, имеющих нормальное распределение, выполняли с использованием среднего арифметического (М) и стандартного отклонения (SD). Качественные показатели представляли в абсолютных (n) и в относительных (%) величинах.
Значимость различий (p) оценивали при наличии нормальности распределения признаков и однородности дисперсий по t-критерию Стьюдента. При интерпретации результатов статистического анализа за критическую принимали величину уровня значимости (р) менее 0,05. Значимость различий исходов вследствие изучаемого фактора оценивали по критерию хи-квадрат (χ2), при численности участников исследования менее 10 – χ2 с поправкой Йейтса. Тесноту связи изучаемого исхода и фактора воздействия оценивали при помощи отношения шансов (ОШ) с 95% доверительным интервалом (95% ДИ).
Результаты
Стероидный профиль мочи соответствовал ГА у 50,79% (n=32) женщин с ИЦН и у 22,86% (n=8) женщин группы контроля, что продемонстрировало сопряженность ИЦН с ГА (ОШ=3,48; 95% ДИ 1,37–8,84).
Анализ анамнестических сведений представил предикторы ИЦН у женщин с ГА. Менструальный анамнез показал отличия, характерные для ИЦН, ГА, их сочетания (табл. 1).
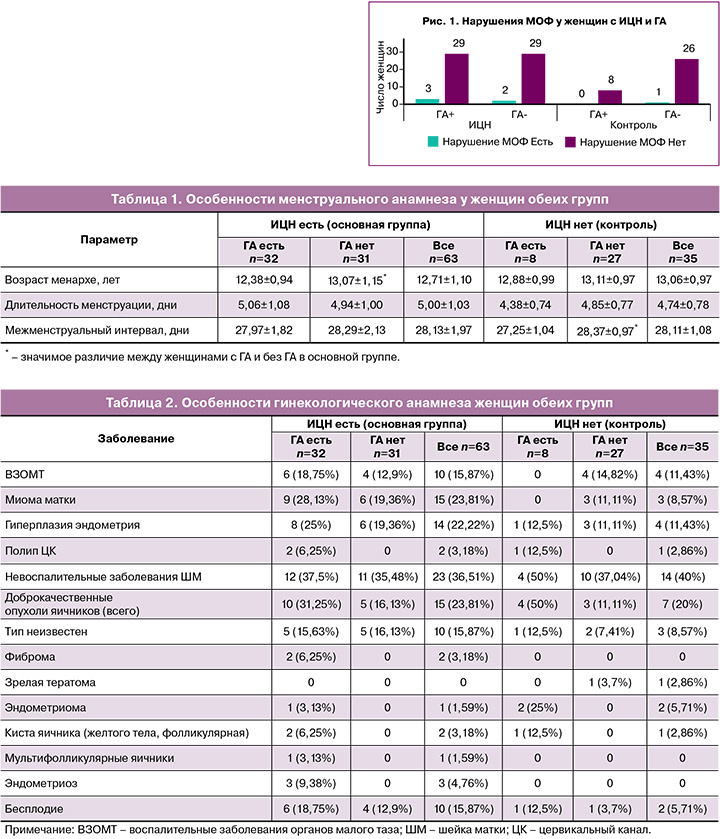
Женщин с ГА при наличии ИЦН отличал более ранний возраст менархе (12,38±0,94 и 13,07±1,15 года, р=0,01); в группе контроля – более короткий межменструальный интервал (27,25±1,04 и 28,37±0,97 дня, р=0,01). Полученные сведения не укладываются в общепринятые представления о роли ГА в более позднем менархе и особенностях менструальной функции. Нарушения менструальной и овуляторной функций (МОФ) выявлены у крайне незначительного числа женщин, сопоставимого во всех группах (рис. 1).
Представляли интерес особенности гинекологического анамнеза в перспективе прогнозирования ИЦН и ГА (табл. 2).
Женщин с ИЦН от группы контроля отличала статистически не значимая, но более высокая частота миомы матки (23,81 и 8,57%; χ2=3,48; р=0,06), гиперплазии эндометрия (22,22 и 11,43%; χ2=1,1; р=0,29), бесплодия (15,87 и 5,71%; χ2=1,32; р=0,25), эндометриоза (4,76 и 0%; χ2=0,49; р=0,49). ГА у женщин с ИЦН сопровождалась доброкачественными пролиферативными заболеваниями органов женской репродуктивной системы, перенесенными в анамнезе у 100% (n=32) с более высокой частотой в сравнении с отсутствием ГА (χ2=16,06; р<0,001).
Только у женщин с ГА (у 8 из 40; χ2=10,1; р<0,002), независимо от наличия или отсутствия ИЦН, в анамнезе были доброкачественные опухоли яичников, известные своей гормональной активностью или гормональной зависимостью. Сведения о мультифолликулярных яичниках имелись только у женщин с ИЦН и ГА, но их частота оказалась крайне низкой (3,13%). Бесплодие чаще диагностировано у женщин основной группы в сравнении с контролем (15,87 и 5,71%; χ2=1,32; р=0,25). Сопряженность бесплодия с ГА не установлена, хотя у женщин с ИЦН его частота при ГА была выше, чем при отсутствии ГА (18,75 и 12,9%; χ2=0,084; р=0,77).
Репродуктивный анамнез у женщин с ИЦН был также отягощен (табл. 3).
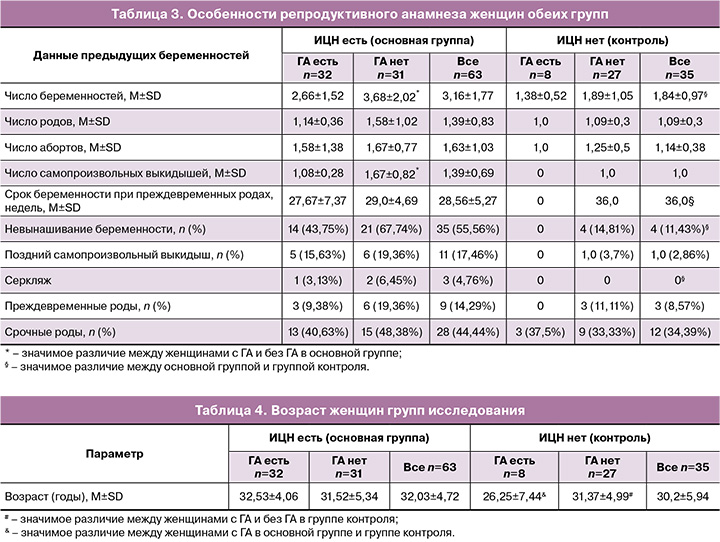
ИЦН была ассоциирована с большим числом беременностей (3,16±1,77 и 1,84±0,97; р=0,00008), более ранним сроком перенесенных преждевременных родов (28,56±5,27 и 36,0; р=0,04), частотой невынашивания (55,56 и 11,43%; χ2=18,99; р<0,001), необходимостью применения серкляжа (4,76 и 0%, χ2=0,49; р=0,49). Не установлена доминирующая роль ГА в нарушении репродуктивной функции. У женщин группы контроля при наличии ГА в анамнезе отсутствовало невынашивание беременности (самопроизвольные выкидыши, преждевременные роды), не использовался ранее серкляж. У женщин с ИЦН при наличии ГА в сравнении с ее отсутствием в анамнезе отмечено значимо меньшее число беременностей (2,66±1,52 и 3,68±2,02; р=0,03) и самопроизвольных выкидышей (1,08±0,28 и 1,67±0,82; р=0,02).
Настоящая беременность наступила спонтанно в естественном менструальном цикле у всех женщин группы контроля и у 88,89% у женщин с ИЦН. Женщин с ИЦН от группы контроля отличало применение вспомогательных репродуктивных технологий (ВРТ) (11,11 и 0%; χ2 =2,68; р=0,1). Частота применения ВРТ у пациенток с ГА была выше, чем при ее отсутствии (15,63 и 6,45%; χ2=0,57; р=0,45). В протоколах ЭКО отсутствовали сведения о генезе бесплодия (ановуляторном, в частности), поэтому не представлялось возможным выявить сопряженность ВРТ с прегестационной ГА, ИЦН.
Средний возраст женщин исследуемой когорты составил 31,38±5,23 года. Женщины с ИЦН были старше, чем в группе контроля, но статистически незначимо (р=0,1) (табл. 4).
Возраст явился важным дифференцирующим критерием женщин с ГА основной и контрольной групп: при ИЦН установлен значимо более старший возраст (32,53±4,06 и 26,25±7,44 года; р=0,002). При сравнении возраста женщин с ГА и без нее значимые межгрупповые различия установлены для женщин группы контроля, но не основной группы. В группе контроля возраст женщин с ГА был значительно ниже, чем у женщин без ГА (26,25±7,44 и 31,37±4,99 года; р=0,03).
Оценка прегестационного веса в когорте показала широкий диапазон значений индекса массы тела (ИМТ) (от 16,44 до 39,9 кг/м2), составляющий в среднем 23,23±3,89 кг/м2. Значимых различий ИМТ у женщин с ИЦН и группы контроля, наличием или отсутствием ГА не установлено (табл. 5).
Несмотря на межгрупповую сопоставимость ИМТ, соответствующий норме вес выявлен у значительно меньшего числа женщин с ИЦН в сравнении с группой контроля (55,56 и 80%; χ2=4,84; р=0,03) (табл. 5). Установлена сопряженность ИЦН с прегестационными весовыми характеристиками, выходящими за пределы нормы (ниже или выше ее) (44,44 и 20%; ОШ=3,2; 95% ДИ 1,22–8,41). Основной вклад в данную связь с ИЦН вносил вес выше нормы (избыточный вес, ожирение I и II степени) (34,92 и 11,43%; χ2=5,22; р=0,02; ОШ=4,16; 95% ДИ 1,32–13,31), но не его дефицит (9,23 и 8,57%; χ2=0,04; р=0,84; ОШ=1,12; 95% ДИ 0,26–4,8).
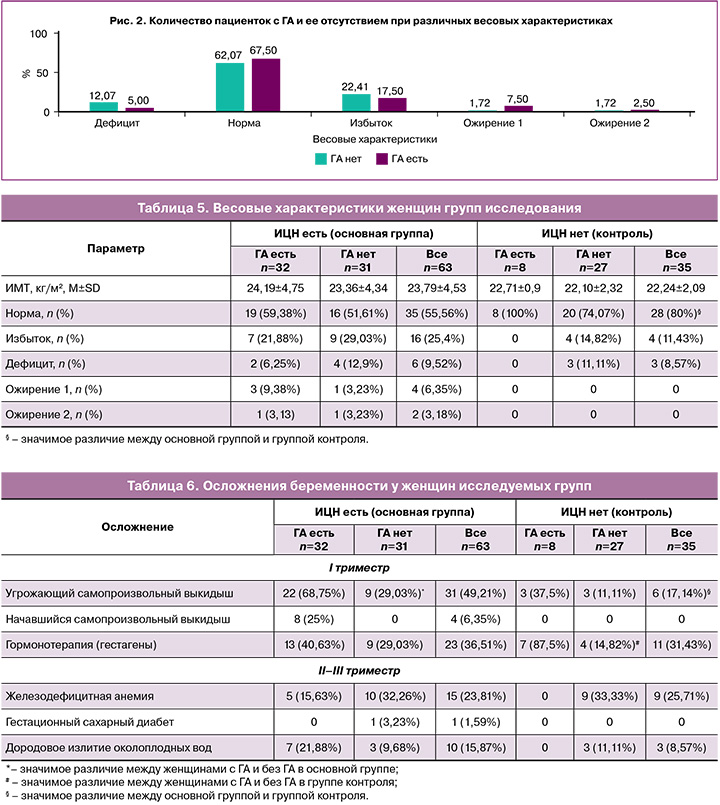
У женщин всей исследуемой когорты (независимо от наличия или отсутствия ИЦН) весовые характеристики (дефицит, норма, избыток, ожирение) не явились значимым дифференцирующим критерием ГА или ее отсутствия (χ2=1,74; p=0,78) (рис. 2).
Беременность у женщин обеих групп протекала с осложнениями, но их особенности и частота значительно отличались (табл. 6).
I триместр беременности осложнился угрожающим самопроизвольным выкидышем в обеих группах с сопоставимой частотой, но превышающей в группе ИЦН (49,21 и 17,14%; χ2=8,53; р=0,004; ОШ=4,68; 95% ДИ 1,71–12,83). Частота угрожающего самопроизвольного выкидыша была выше у женщин с ГА, чем без ГА, статистически значимо при ИЦН (68,75 и 29,03%; χ2=8,41; р=0,004; ОШ=5,38; 95% ДИ 1,83–15,79), в группе контроля – нет (37,5 и 11,11%; χ2=1,45; р=0,23). Начавшийся самопроизвольный выкидыш осложнил беременность только 6,35% женщин с ИЦН и только при наличии ГА (χ2=6,77; р=0,01).
При наличии ГА количество женщин, получающих прогестерон в преконцепционном периоде/I триместре беременности, при ИЦН было значительно меньше, чем в группе контроля (40,63 и 87,5%; р=0,049). Для женщин с ГА установлена сопряженность отсутствия прогестеронотерапии в преконцепционном периоде/I триместре беременности с ИЦН (ОШ=10,23; 95% ДИ 1,12–93,35).
Анализ осложнений II триместра беременности у женщин с ГА не выявил ожидаемого увеличения частоты железодефицитной анемии и гестационного сахарного диабета.
Дородовое излитие околоплодных вод осложнило беременность как в основной, так и в контрольной группе (15,87 и 8,57%; χ2=0,51; р=0,48). Наибольшая частота дородового излития околоплодных вод наблюдалась у женщин основной группы с ГА, но она была сопоставима с таковой у женщин без ГА (21,88 и 9,68%; χ2=0,96; р=0,33).
Ультразвуковая цервикометрия показала, что длина ШМ у женщин основной группы не достигала 20 мм (рис. 3): у женщин с ГА варьировала от 2 мм до 12 мм, при отсутствии ГА – от 5 мм до 15 мм, в среднем у женщин с ГА была значимо меньше (7,84±2,58 и 10,97±2,25 мм; р=0,000004).
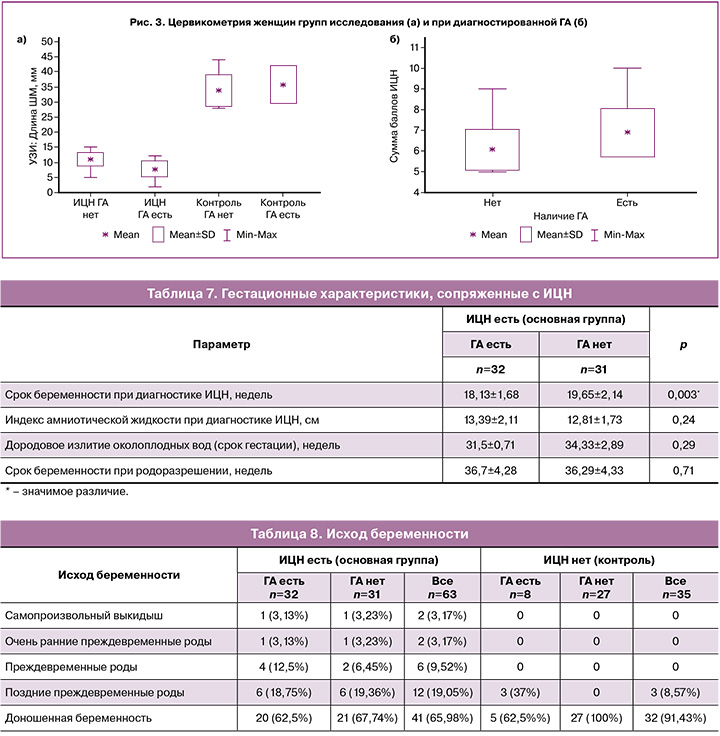
У всех женщин основной группы имелись показания для наложения швов, однако при ГА общая сумма баллов оценки ИЦН была значимо больше, чем при ее отсутствии (6,88±1,16 и 6,07±0,99 мм; р=0,004).
Установлена тенденция к разнонаправленной корреляционной связи между ультразвуковой длиной ШМ и ИМТ: при ГА – положительная (r=0,27; p=0,13), при отсутствии ГА – отрицательная (r=-0,06; p=0,76) (рис. 4).
Асимптомность не позволила точно определить гестационный срок начала формирования ИЦН. ГА отличалась значительно более ранним сроком беременности при диагностике ИЦН в сравнении с отсутствием ГА (18,13±1,68 и 19,65±2,14 недели; р=0,003) (табл. 7).
При анализе срока исхода беременности (табл. 8) выявлено, что самопроизвольный выкидыш произошел у женщин с ГА (n=1) и без ГА (n=1) соответственно в 21 и 20 недель беременности.
Срок родоразрешения у женщин основной группы был сопоставим при наличии ГА и ее отсутствии (36,7±4,27 и 36,29±4,33 недели; р=0,71), демонстрируя эффективность серкляжа (рис. 5).
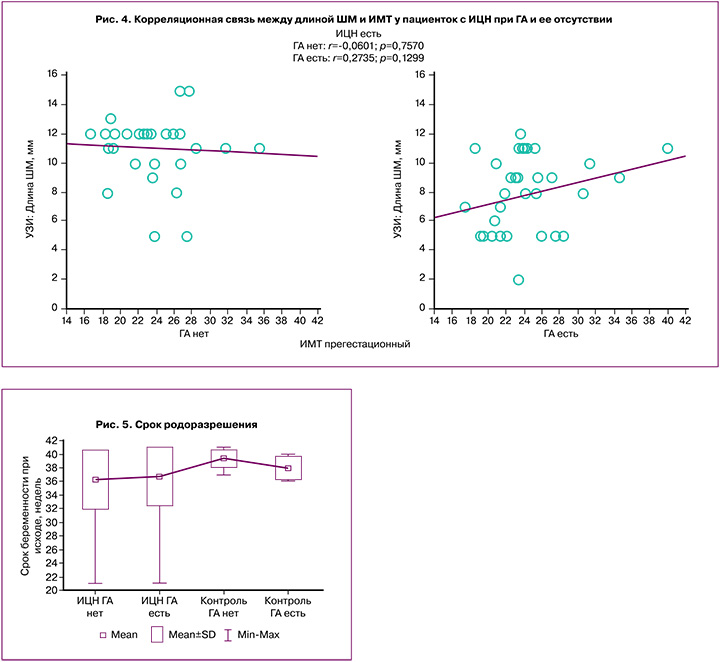
Демонстрацией сопряженных с ГА рисков невынашивания беременности явились поздние преждевременные роды у 37% женщин с ГА в группе контроля; поэтому средний срок родоразрешения оказался значимо ниже, чем при ее отсутствии (38,0±1,69 и 39,41±1,22 недели; р=0,01).
Обсуждение
Различный генез обусловленных ГА внегестационных и гестационных нарушений в организме женщины отражают исследования всего мира [8, 16, 24–36]. Основными причинами избытка андрогенов являются СПЯ, врожденная гиперплазия надпочечников, опухоли надпочечников и расовые особенности. Дополнительными гестационными причинами ГА являются лютеома и тека-лютеиновые кисты яичников, дефицит плацентарной ароматазы и плодовая врожденная гиперплазия надпочечников [16]. Полученные нами данные подтверждают сложность диагностики ГА вне и во время беременности и понимания ее патогенеза. Отсутствие у абсолютного числа женщин исследуемой когорты с ГА сведений об уровне гормонов крови и протоколов ультразвукового исследования эндокринных желез до беременности, спонтанное зачатие у 87,5%, отсутствие ожирения у 67,5% и наличие дефицита веса у 5%, нормальной МОФ у 92,5% затрудняют дифференциальную диагностику ГА, предполагают гестационный ее дебют.
Патогенез невынашивания беременности обуславливает известная роль ГА в ремоделировании ШМ при СПЯ, особенно в сочетании с инсулинорезистентностью [15], преждевременных родах [10, 29]. Данных, подтверждающих и обосновывающих роль ГА в генезе ИЦН, крайне мало, и они акцентированы либо только на СПЯ [37], либо на ожирении [38, 19]. Канадским обществом акушеров-гинекологов в клиническом протоколе «Цервикальная недостаточность и цервикальный серкляж № 373» (2019) СПЯ рассматривается как самостоятельный фактор риска, особенно у южноазиатских или чернокожих женщин [3]. Также подчеркивается, что 85% сухого веса ШМ представлено коллагеном и что у женщин с ИЦН в анамнезе концентрация гидроксипролина в ШМ значительно ниже, чем у женщин без ИЦН. Несмотря на отсутствие знаний о причинах данного различия, оно рассматривается как ключевой фактор механизма ИЦН. Согласно полученным данным, выявленная при беременности ГА повышает вероятность ИЦН более чем в 3 раза (ОШ=3,48, 95% ДИ 1,37–8,84). Учитывая асимптомность ИЦН, профилактика невынашивания беременности требует своевременной диагностики ГА до беременности или в ранние сроки.
Отдельного внимания в оценке рисков ИЦН заслуживает ожирение, роль которого неоднозначна. Имеются сведения о положительной корреляции между уровнем цервико-вагинальных цитокинов (фактора некроза опухолей-α и интерлейкинов-6 и -10) и ИМТ женщины (соответственно r=0,303, p=0,005; r=0,285, p=0,008; r=0,247, p=0,023), особенно при наличии преждевременных родов в анамнезе [39, 40]. Другие исследователи [41] показали, что увеличению ИМТ на 1,0 кг/м2 соответствует увеличение длины ШМ на 0,25 мм, т.е. для ожирения характерна большая длина ШМ. Аналогичных исследований по оценке длины ШМ, рисков развития ИЦН при ожирении, связанном с ГА, нами не найдено. Описываемая связь между ожирением и рисками перенашивания беременности [42–45] вносит разногласие в оценку эффективности хирургической коррекции ИЦН. Согласно обсервационному когортному исследованию Kandeel M.S. et al. (2014) [38], для преждевременных родов (у первобеременных, одним плодом) характерен дефицит веса женщин, а для перенашивания беременности – избыток веса или ожирение. Согласно систематическому обзору Prodromidou A., Frountzas M. (2016) [39], не установлено связи между ожирением и сроком беременности при родоразрешении, значимого влияния на эффективность цервикального серкляжа. Полученные результаты оказались созвучны исследованиям Venkatesh K.K. et al. (2017) [41]: для ГА характерен тренд положительной корреляции между ультразвуковой длиной ШМ и ИМТ, а для отсутствия ГА – отрицательной.
Изучение триггерных механизмов ИЦН, ко-факторов, определяющих эффективность ее терапии, составляет платформу современных исследований [37, 40, 46]. Влияние ГА на женское здоровье и репродуктивную функцию весомо [47, 48]; ее сочетанное с иными факторами (возрастом, весовыми характеристиками, наследственностью, приобретенными заболеваниями и нарушениями и т.д.) влияние на риски ИЦН остается предметом востребованного изучения. Основополагающими этапами предотвращения преждевременных родов являются прогнозирование и своевременная диагностика ИЦН, которая крайне затруднительна, учитывая ее бессимптомное течение, заложенное в ее дефиницию.
Заключение
Консолидируя полученные результаты, следует констатировать, что ИЦН, ассоциированную с ГА, крайне сложно прогнозировать в прегравидарном периоде и на ранних сроках беременности. Бессимптомное начало ИЦН не позволяет реализовать современные возможности ее профилактики, ограничивает возможность консервативного ведения.
ГА является известным фактором риска различных гестационных осложнений, но отсутствие единого фенотипа ГА объясняет ее гиподиагностику. ИЦН сопряжена с ГА. ГА, независимо от наличия или отсутствия ИЦН, взаимосвязана с весовыми характеристиками женщин, перенесенными ранее доброкачественными опухолями яичников, известными своим потенциалом гормональной активности и/или зависимости.
Предиктором ассоциированной с ГА ИЦН показаны более ранний возраст менархе (12,38±0,94 года) и более старший возраст беременной (32,53±4,06 года). Гестационными факторами развития ИЦН в сочетании с ГА являются: отсутствие прогестеронотерапии в преконцепционном периоде/I триместре беременности. Назначение женщинам с ГА препаратов прогестерона в преконцепционном периоде/I триместре беременности следует рассматривать мерой профилактики ИЦН.
Полученные данные представляются важными для формирования практических рекомендаций по профилактике, диагностике и своевременному лечению ИЦН у женщин с ГА.



