Рак эндометрия (РЭ) – наиболее распространенная локализация гинекологического рака и занимает 3–4-е места среди всех злокачественных новообразований у женщин в экономически развитых странах, в т.ч. и в России [1]. При этом РЭ является наиболее благоприятной локализацией гинекологического рака по уровню показателя 5-летней наблюдаемой выживаемости. Так, по данным популяционного ракового регистра Санкт-Петербурга и Национального ракового института США, общая 5-летняя выживаемость больных РЭ при I стадии в первом десятилетии нашего века превышает 90% [2, 3]. Такие показатели при I стадии РЭ достигаются при использовании радикального хирургического лечения. Тем не менее общая наблюдаемая и относительная 5-летняя выживаемость независимо от стадии сохраняется на уровне 70% [2, 3]. Таким образом, не менее 30% больных РЭ умирают в течение 5-летнего периода наблюдения от рецидивов и метастазов, что определяет актуальность комплексного подхода к лечению заболевания. По данным FIGO (International Federation of Gynecology and Obstetrics), более 60% больных раком тела матки (РТМ) подвергаются различным видам адъювантного лечения даже при ранних стадиях заболевания [4, 5].
Согласно данным проспективных рандомизированных исследований, адъювантное лечение показано больным РТМ с неблагоприятными факторами прогноза, у которых повышен риск развития рецидива заболевания [6, 7]. Пациентки, относящиеся к группе риска развития рецидива заболевания, определяются на основе клинико-морфологических прогностических факторов [8]. К доказанным клинико-морфологическим факторам прогноза относятся возраст, стадия заболевания, глубина инвазии в миометрий, дифференцировка и гистологический тип опухоли. Раньше к низкому риску относили случаи только высокодифференцированной эндометриоидной аденокарциномы стадии I и поверхностной инвазии или умереннодифференцированные без инвазии, а к высокому риску при стадии I – низкодифференцированные с глубокой инвазией. Позже проспективные исследования, посвященные роли лучевой терапии при РТМ (PORTEC-1, GOG99, ASTEC/EN5), модифицировали эту классификацию и определили следующие группы риска для назначения адъювантной лучевой терапии, а именно группу низкого, промежуточного, высокого промежуточного и высокого рисков [9–11]. Помимо этого показано, что некоторые молекулярные факторы (р53, L1CAM, MMR-D) также имеют прогностическое значение, но окончательно их роль не определена и в настоящее время они не применяются в клинической практике [12–14].
На основании трех проспективных рандомизированных исследований (ASTEC/EN5, PORTEC-1, GOG99) и мета-анализа Kong показано, что применение адъювантной терапии при низком риске РЭ (I стадия, G1-2, глубина инвазии <50% толщины миометрия, отсутствие лимфоваскулярной инвазии) не дает никаких преимуществ по сравнению только с хирургическим лечением [7, 9–11]. Что касается пациенток с промежуточным риском (стадия I, эндометриоидные гистологические типы, G 1–2, глубина инвазии в миометрий ≥50%, лимфоваскулярная инвазия отсутствует), то консенсус ESMO (European Society for Medical Oncology), ESGO (European Society of Gynaecological Oncology), ESTRO (European SocieTy for Radiotherapy & Oncology) рекомендуют с целью уменьшения риска вагинального рецидива заболевания проведение брахитерапии [15].
Если лучевая терапия позволяет контролировать развитие местного рецидива, применение химиотерапии потенциально должно приводить к уничтожению микрометастазов и таким образом способствовать снижению риска отдаленных рецидивов заболевания и увеличению продолжительности жизни больных после хирургического лечения. Эти рассуждения привели к исследованиям по оценке влияния применения адъювантной химиотерапии больных РЭ.

РЭ является относительно химиочувствительным заболеванием, наиболее чувствительным к антрациклинам – препаратам на основе платины и таксанам. В двух проспективных клинических исследованиях было показано, что сочетание цисплатина и доксорубицина более активно, чем один доксорубицин, с точки зрения частоты ответа (43–41% по сравнению с 17–25%), но без какого-либо преимущества с точки зрения относительной выживаемости [16, 17]. При этом комбинация препаратов привела к более высокому уровню токсичности (3–4-й степеням миелотоксичности и тошноты/рвоты).
Исследование роли адъювантной химиотерапии проведено группой GOG24 применительно к пациенткам с высоким промежуточным и высоким рисками рецидива РЭ [18]. Пациентки были рандомизированы в две группы: группу, получавшую адъювантную дистанционную лучевую терапию на малый таз, и группу пациенток с адъювантной брахи- и последующей химиотерапией. В качестве химиотерапии было проведено три цикла карбоплатина с паклитакселом. Полученные результаты не показали преимуществ адъювантной химиотерапии по сравнению со стандартной дистанционной лучевой терапией пациенток с высоким промежуточным и высоким рисками рецидива РЭ [18].
Группой (GOG34) было опубликовано одно из первых рандомизированных исследований, посвященных влиянию адъювантной химиотерапии на выживаемость больных РЭ, проведенной после операции, и адъювантной лучевой терапии. В исследование были включены пациентки с клиническими стадиями I или II, у которых после патоморфологического исследования операционного материала был один или более факторов риска рецидива: более 50% инвазии миометрия, метастазы в тазовые или аортальные узлы, вовлечение шейки матки или метастазы в яичники. После завершения лучевой терапии пациентки были рандомизированы для приема болюсной терапии доксорубицином (начальная доза – 60 мг/м2) до максимальной кумулятивной дозы 500 мг/м2. Авторы не обнаружили статистически значимого преимущества адъювантной химиотерапии препаратом доксорубицин после операции и послеоперационной дистанционной лучевой терапии на малый таз [19].
В 2006 г. R. Maggi и соавт. [20] опубликовали результаты своих исследований, в которых 345 пациенток с эндометриальной карциномой высокого риска (стадии Ic G3, II G3 с инвазиометрией миометрия >50% и стадия III) после операции были рандомизированы в зависимости от вида адъювантной терапии: химиотерапия по схеме CAP (цисплатин 50 мг/м2, доксорубицин 45 мг/м2, циклофосфамид 600 мг/м2) каждые 28 дней в течение пяти циклов или дистанционная лучевая терапия на малый таз (суммарная общая доза 45–50 Гр). Не обнаружено статистически значимых различий в 3-, 5- и 7-летней общей выживаемости (рис. 1). Аналогичное исследование с аналогичными результатами было проведено в 2008 г. японской группой JGOG (Japan Gynecologic Oncology Group) [21].
В 2004 г. американская группа Radiation Therapy Oncology Group 9905 представила первые обнадеживающие результаты применения комбинированной адъювантной терапии: дистанционная лучевая терапия на малый таз и два цикла цисплатина (50 мг/м2 в дни 1 и 28), за которым следовали 4 дополнительных курса с 28-дневными интервалами цисплатина (50 мг/м2) и паклитаксела (175 мг/м2) в виде 24-часового вливания [22]. Исследование было проведено с участием 46 больных эндометриальной карциномой I–III стадий, G 2, 3, с инвазией миометрия >50%. В результате 4-летняя общая выживаемость составила 85% для всей группы и 77% – для пациенток с III стадией, а безрецидивная выживаемость составила 77 и 72% соответственно. У пациенток со стадиями IC, IIA или IIB рецидивов не наблюдалось [23].
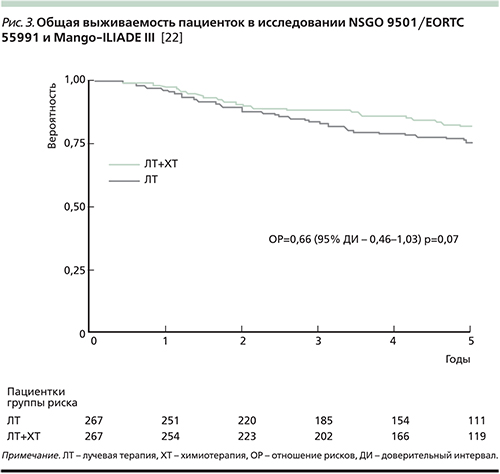
В 2010 г. были опубликованы результаты комбинированного анализа двух рандомизированных исследований (NSGO 9501/EORTC 55991 и Mango-ILIADE III) [24]. Как показал анализ, добавление адъювантной химиотерапии (4 цикла химиотерапии на основе платины либо до, либо после адъювантной дистанционной лучевой терапии) привело к значительному повышению 5-летней беспрогрессивной выживаемости (78 против 69%; р=0,009, рис. 2), а также обнаружена тенденция к повышению общей выживаемости (82 против 75%; р=0,07, рис. 3).
Анализ подгрупп по гистологическим типам рака эндометрия показал, что преимущество адъювантной химиотерапии было ограничено в отношении пациенток с эндометриоидными опухолями, тогда как при серозных и светлоклеточных опухолях выживаемость не превысила 36% [24].
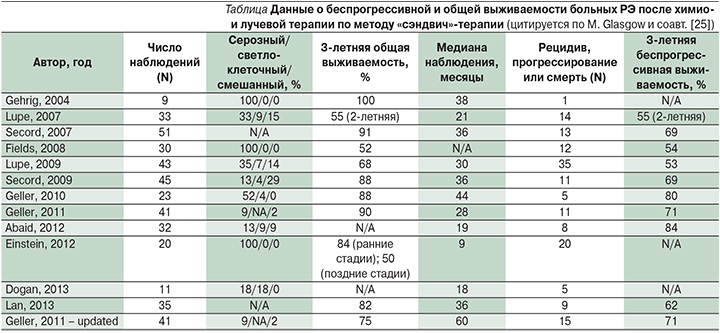
Повышение эффективности лечения распространенного и рецидивного РЭ было достигнуто применением т.н. метода «сэндвич»-терапии, который заключался в том, что пациенты получали внутривенно доцетаксел (75 мг/м2) и карбоплатин (AUC=6) каждые 3 недели в течение трех циклов до и после лучевой терапии. Анализ опубликованных результатов исследования данной методики различными авторами показал, что метод «сэндвич»-терапии для лечения РЭ поздних стадий эффективен и хорошо переносится (см. таблицу).
В 2011 г. были представлены результаты второй фазы исследования эффективности лечения распространенного и рецидивного РЭ по методу «сэндвич»-терапии [25]. В исследование были включены 42 пациентки с распространенным или рецидивирующим РЭ с медианой наблюдения 28 месяцев. Общая 1-летняя выживаемость, рассчитанная по методу Каплана–Мейера, составила 95%, 3-летняя – 90%, 5-летняя – 71%. Беспрогрессивная выживаемость составила 87%, 71 и 64% соответственно [25].
Анализ отдаленных результатов лечения с применением «сэндвич»-методики сочетания химио- и лучевой терапии больных распространенным или рецидивным РЭ был опубликован в 2016 г. M. Glasgow и соавт. [26], которые показали, что метод «сэндвич» остается эффективным. В 2016 г. опубликованы первые данные открытого многоцентрового проспективного рандомизированного исследования PORTEC-3 [27]. В этом исследовании больные РЭ с высоким уровнем риска были рандомизированы в две группы: группа с только лучевой адъювантной терапией (СОД=48 Гр) и группа с химиолучевой терапией (два цикла одновременно цисплатин 50 мг/м2 и 4 адъювантных цикла карбоплатина AUC 5 и паклитаксела 175 мг/м2).
Стратификация пациенток проведена по лимфаденэктомии, стадии заболевания и гистологическому типу опухоли. Основными конечными точками исследования PORTEC-3 были общая и беспрогрессивная выживаемость. Анализировалось также качество жизни по основному вопроснику 30 (EORTC QLQ-C30). Побочные эффекты были классифицированы с учетом общих критериев терминологии для неблагоприятных событий версии 3.0. Результаты исследований показали, что общая и беспрогрессивная выживаемость пациенток с высоким риском и распространенными стадиями РТМ оказались выше в группе пациенток, получавших сочетанную химиолучевую терапию. Отмечены значительно более частые гематологические и неврологические токсические явления в группе больных, получавших сочетанную химиолучевую терапию. При этом наблюдалось «быстрое восстановление после лечения, но с сохранением сенсорных неврологических симптомов у 25% пациенток» [27].
Согласно консенсусу ESMO, ESGO, ESTRO (2016) [15] и рекомендациям NCCN (National Comprehensive Cancer Network, 2017) [28], больным РТМ IVA–IVB-стадий на первом этапе предлагается хирургическое стадирование и циторедуктивная операция, после которых проводится системная химиотерапия. Выбор между гормональной и химиотерапией зависит от нескольких факторов, в т.ч. гистологических и клинических параметров, от индивидуальных особенностей пациентки. При местных вагинальных рецидивах или рецидивах в тазовых лимфатических узлах рекомендуется применение химиотерапии с лучевой терапией [15]. При большем распространении опухоли рекомендовано применение системной химиотерапии перед лучевой терапией [15].
Схемы химиотерапии, применяемые при системном лечении распространенного РЭ, приведены в рекомендациях NCCN (2017) [28] и RUSSCO (Российское общество клинической онкологии) [29]. Для монотерапии РТМ применяют следующие препараты: цисплатин, карбоплатин, доксорубицин, липосомальный доксорубицин, паклитаксел, топотекан. Для полихимиотерапии рекомендованы следующие схемы: цисплатин/паклитаксел, цисплатин/доксорубицин, цисплатин/доксорубицин/паклитаксел, карбоплатин/доцетаксел.
Согласно консенсусу ESMO, ESGO, ESTRO (2016) [15], стандартом паллиативной терапии РТМ является 6 циклов карбоплатина с паклитакселом с 3-недельным интервалом, что основано на рандомизированном исследовании, показавшем одинаковую эффективность со схемой цисплатин/доксорубицин/паклитаксел при меньшей токсичности.
Что касается химиотерапии второй линии при прогрессировании РЭ после химиотерапии первой линии, то она значительно ограничена в большинстве случаев в связи с развитием резистентности опухоли к химиотерапевтическим препаратам. В проводившихся нерандомизированных исследованиях не получено доказательств, подтверждающих эффективность использования химиотерапии второй линии после того, как платиносодержащая терапия пациенток с РТМ перестала быть эффективной [30, 31].
Приведенные данные свидетельствуют о том, что химиотерапия в сочетании с лучевой терапией является эффективным методом адъювантного лечения РЭ при высоком риске рецидива заболевания, поздних стадиях РЭ и при рецидивах заболевания.



