Обоснование
Согласно современным взглядам, миокардит представляет собой не одно заболевание, а группу самостоятельных нозологических единиц или определяется как проявление других заболеваний.
В основе миокардита лежат воспалительные изменения, вызванные различными этиологическими факторами, среди которых выделяют инфекционный, токсический (в т.ч. лекарственный), аллергический или аутоиммунный. Но все же наиболее частой причиной развития миокардита считается вирусная инфекция (по данным крупнейшего анализа биопсийного материала) [1].
В патогенезе развития вирусного миокардита условно выделяют три фазы. После проникновения вируса в кардиомиоцит происходит его репликация и как следствие – развитие миоцитолиза и активизация синтеза микро-РНК, что в свою очередь приводит к апоптозу и некрозу. При адекватной иммунной реакции первая фаза заболевания может завершиться вирусной элиминацией. В противном же случае запускается выработка аутореактивных антител (к мембранам кардиомиоцитов) посредством активации лимфоцитов, синтеза иммуноглобулинов и компонентов комплемента с включением феномена антигенной мимикрии, что в итоге приводит к аутоиммунному повреждению кардиомиоцитов. Формирование ремоделирования миокарда ассоциируется с третьей фазой патогенеза. Особенностью вирусного миокардита является то, что поражение миокарда как может быть основным заболеванием, так и служить осложнением [1, 2].
Трудности диагностического поиска при миокардите обусловлены тем, что клинические проявления очень вариабельны: от бессимптомного, легкой одышки и неинтенсивных болей в грудной клетке, купирующихся самостоятельно, до инфаркто-подобного болевого синдрома, тяжелых проявлений сердечной недостаточности, кардиогенного шока, жизнеугрожающих нарушений ритма и внезапной сердечной смерти.
Имеются данные, согласно которым развитие болевого синдрома за грудиной (зачастую инфаркто-подобного) при миокардите ассоциировано с инфицированием парвовирусом В19. Это связывают с тем, что этот вирус тропен к клеткам эндотелия коронарных артерий (КА), приводя их к спазму и как следствие – к ишемии миокарда. При этом отсутствует какая-либо корреляция между выраженностью болевого синдрома и последующими проявлениями СН [1–3].
В тех же клинических случаях, когда присутствуют все критерии ИМ (клинические, лабораторные, электрокардиографические), но значимые атеросклеротические изменения не выявлены и нет данных о других заболеваниях, которые могли бы проявляться подобной клинической картиной, такой вариант ИМ определяют как ИМ без обструктивного поражения КА (ИМБОКА). Но это «рабочий» диагноз, требующий проведения уточняющих исследований [4–6].
В случае, если выявленные изменения являются следствием установленных кардиальных или внекардиальных причин (например, таких как вазоспазм, тромбоэмболия или спонтанная диссекция КА), ИМБОКА должен быть определен как ИМ 2-го типа [7, 8]. Но согласно выводам, указанным в 4-м универсальном определении ИМ, миокардит и синдром такоцубо были исключенные из этого понятия [8].
Клинический случай
Пациент С. 33 лет при амбулаторном обращении в консультативно-диагностический центр СЗГМУ им. И.И. Мечникова предъявлял жалобы на эпизодическое ощущение дискомфорта за грудиной, возникающее преимущественно в вечернее время (в горизонтальном положении) длительностью до 30 минут. При активном расспросе других жалоб не высказывал. Нагрузку переносит хорошо (подъем на 4–5-й этаж, умеренные занятия в спортивном зале), повышения артериального давления (АД) не регистрировалось. Причиной обращения было определение тактики ведения по поводу перенесенного несколько месяцев назад ИМ.
Анамнез жизни: сопутствующие хронические заболевания, травмы, оперативные вмешательства отрицал. При контроле значения АД регистрировались на уровне 110–120/70 мм рт.ст. Не курит, редкое употребление слабоалкогольных напитков, физически активен. Наследственность по сердечно-сосудистым заболеваниям не отягощена. Эпидемиологический анамнез: год назад перенес инфекцию Covid-19, за месяц до развития ИМ была проведена плановая вакцинация от Covid-19, после которой стал отмечать ощущение дискомфорта в левой половине грудной клетке, возникающего при интенсивной физической нагрузке. Это послужило поводом для выполнения электрокардиографии (ЭКГ), но, со слов пациента, изменения не были зарегистрированы.
Объективные данные на момент осмотра на амбулаторном приеме без особенностей. Масса тела – 84 кг, рост – 176 см. Состояние удовлетворительное. Кожные покровы и видимые слизистые оболочки обычной окраски и влажности. Периферических отеков нет. АД, правая и левая рука: 120/80 мм рт.ст. Пульс – 68 ударов в минуту, ритмичный, симметричный, удовлетворительных свойств, SpО2=98%. Частота сердечных сокращений (ЧСС) – 70 в минуту. Тоны сердца нормальной звучности, шумы не выслушивались.
Из анамнеза известно, что 3,5 месяца назад имело место повышение температуры тела до 39,5ºС, которая снижалась до 37,8ºС на фоне приема нестероидных противовоспалительных средств. Тогда же была диарея (до 3 раз в сутки), тошнота. Рвоты, катаральных проявлений не отмечено. На следующий день на фоне сохраняющейся лихорадки ощутил появление легкого жжения, давления за грудиной продолжительностью около 2 часов (дважды: утром и вечером), а также отметил появление сердцебиения. После приема парацетамола болевой синдром был купирован, отмечено снижение температуры тела при сохранении ощущения сердцебиения. Пациент самостоятельно обратился в медицинский центр с целью выполнения анализов крови.
В клиническом анализе крови отклонений от референсных значений не было выявлено: лейкоциты – 5,7×109/л, эритроциты – 5,8×1012/л, гемоглобин – 162 г/л, тромбоциты – 206×109/л, СОЭ – 14 мм/ч (по Вестергрену). В биохимическом анализе обращало на себя внимание повышение уровня аспартатаминотрансферазы (АСТ) – 116,3 ЕД/л и С-реактивного белка (СРБ-hs) – до 13,98 (0–1,0) мг/л, остальные определенные показатели без патологических отклонений: общий холестерин (3,8 ммоль/л) и его фракции, аланинаминотрансфераза (АЛТ), общий билирубин и его фракции, γ-глютамилтранспептидаза. Утром третьего дня проснулся от возобновления ощущения жжения в верхней трети грудины, которое сохранялось на протяжении около 3 часов. После купирования самостоятельно обратился в ближайший к дому медицинский центр для выполнения ЭКГ, где зарегистрированы (рис. 1) синусовая тахикардия – ЧСС 101 в минуту, элевация ST в I, II, AVL, V3–V6 до 2 мм. С учетом клинических проявлений и ЭКГ изменений пациент экстренно госпитализирован в стационар с диагнозом «острый коронарный синдром» (ОКС) с подъемом сегмента ST. На догоспитальном этапе проведена терапия (перорально): клопидогрел 300 мг, ацетилсалициловая кислота 250 мг, гепарин 5000 ЕД, метопролол 25 мг.
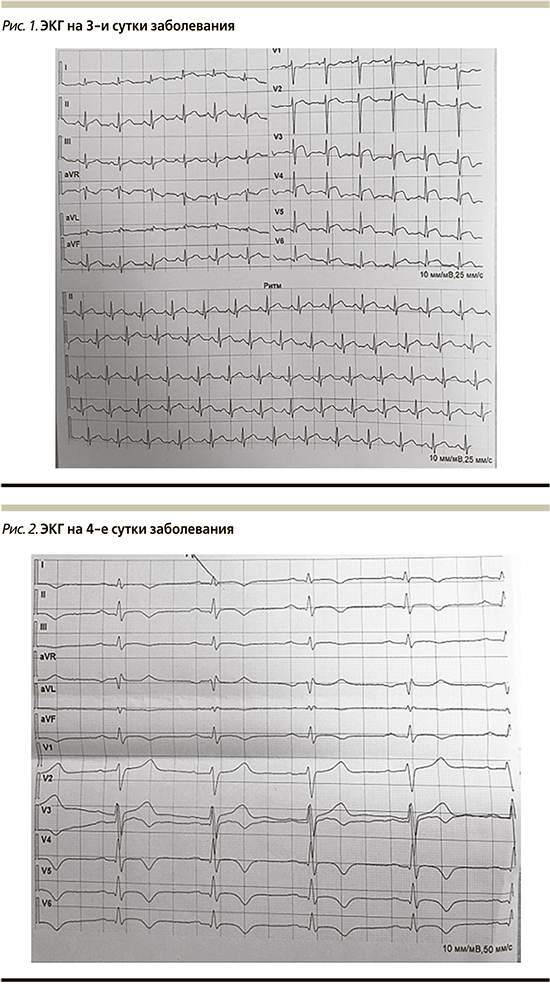
При поступлении в стационар по данным лабораторно инструментальных исследований зарегистрировно:
- клинический анализ крови: повышение СОЭ до 34 мм/ч, в остальном без патологических изменений (лейкоциты – 5,2×109/л);
- маркеры повреждения миокарда: тропонин-I – 23,7 (норма до 0,4 нг/мл), креатинфосфокиназа-МВ (КФК-МВ) – 110 (норма до 4,3) нг/мл, миоглобин 66,6 (норма до 107) нг/мл;
- биохимический анализ крови: АЛТ – 45,3 ЕД/л, АСТ – 197 ЕД/л, общий билирубин – 9,2 мкмоль/л, щелочная фосфатаза – 82,7 ЕД/л, γ-глютамилтранспептидаза – 23,9 ЕД/л, калий – 3,67 ммоль/л, натрий – 142 ммоль/л, кальций – 1,21 ммоль/л, креатинин – 101,6 мкмоль/л (скорость клубочковой фильтрации по формуле CKD-EPI – 83 мл/мин/1,73 м2), мочевина – 4,4 ммоль/л, глюкоза – 5,5 ммоль/л, альбумин – 44,8 г/л, общий холестерин – 4,28 ммоль/л, липопротеиды высокой плотности – 1,22 ммоль/л, липопротеиды низкой плотности – 2,49 ммоль/л, триглицериды – 1,13 ммоль/л, СРБ – 11 мг/л, Д-димер – 0,68 нг/мл;
- мазок на Covid-19 методом полимеразной цепной реакции: отрицательный.
По экстренным показаниям с целью определения дальнейшей тактики ведения выполнена коронароангиография (КАГ), по результатам которой выявлены тип кровообращения правый, левая КА без гемодинамически значимых стенозов, в среднем сегменте передне-межжелудочковой артерии «миокардиальный мостик», стенозирующий артерию в систолу до 50%, диагональная, огибающая ветви, ветвь тупого края, а также правая КА и ее ветви без гемодинамически значимых стенозов.
При дальнейшем динамическом наблюдении и обследовании в стационаре:
- клинический анализ крови: нормализация СОЭ – 11 мм/ч, но был зарегистрирован лейкоцитоз до 12,6×109/л, без изменений в лейкоформуле;
- маркеры повреждения миокарда в динамике: тропонин I – 20,4→5,7→0,1 нг/мл, КФК-МВ – 64,7→5,4→1,7, миоглобин – 84,9→19,8→19,2 нг/мл;
- биохимический анализ крови: АЛТ – 78,1 ЕД/л, АСТ – 29,5 ЕД/л, калий – 4,0 ммоль/л, креатинин – 105→102,7 мкмоль/л, глюкоза – 5,3–4,9 ммоль/л, СРБ – 15,99→0,58 мг/л, Д-димер – 0,7→0,34 нг/мл;
- гормоны щитовидной железы: тиреотропный гормон – 2,67 мкМЕ/мл, тироксинобщ – 160,16 нмоль/л.
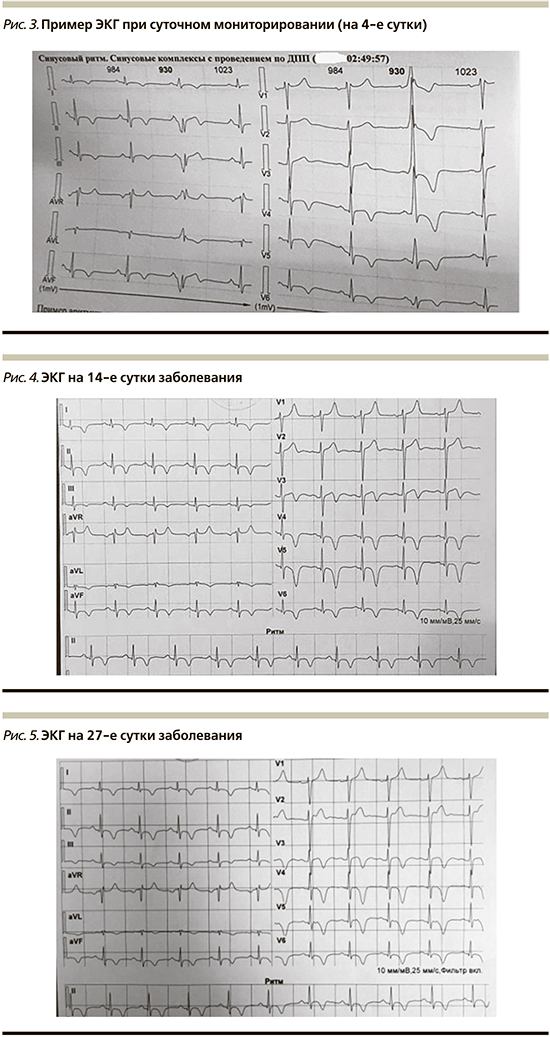
ЭКГ в динамике (рис. 2): ритм синусовый. Подострая стадия инфаркта миокарда переднебоковых и верхушечных отделов.
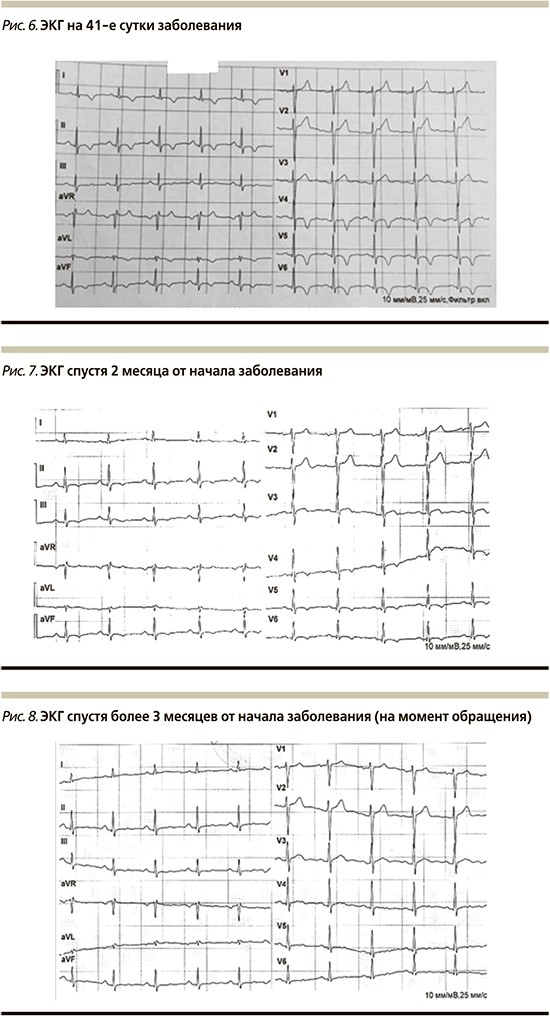
По результатам суточного мониторирования ЭКГ: ЧСС день/ночь: мин 78/56, ср. 56/57, макс. 105/90 в минуту. Наджелудочковая и желудочковая эктопическая активность, ишемические изменения не зарегистрированы. Зарегистрирован транзиторный феномен WPW-1 (рис. 3).
Результаты эхокардиографии (Эхо-КГ) без особенностей (7-е сутки): стенки аорты не изменены, аорта не расширена. Размеры полостей в пределах нормы, миокард не утолщен, характер движения межжелудочковой перегородки обычный, отчетливых зон фиброза и гипокинезии миокарда левого желудочка (ЛЖ) не выявлено. Жидкость между листками перикарда отсутствует. Сократительная способность миокарда ЛЖ удовлетворительная, Фракция выброса (ФВ) – 52%. Целостность перегородок сохранена, клапанные структуры сердца без особенностей. Легочная гипертензия не выявлена.
Также выполняли ультразвуковое исследование органов брюшной полости и рентгенографии органов грудной клетке, где патологических изменений не было выявлено. От проведения фиброгастродуоденоскопии пациент отказался.
За время госпитализации болевой синдром в грудной клетке не рецидивировал, но сохранялся субфебрилитет (≈37,4–37,1ºС), который определялся в последующем на протяжении месяца, пациент также отмечал общее недомогание (слабость, быструю утомляемость), которые к моменту обращения полностью нивелировались.
Пациент выписан в удовлетворительном состоянии на 10-е сутки с диагнозом «ишемическая болезнь сердца (ИБС), острый ИМ с элевацией ST передне-перегородочной и верхушечно-боковой стенки ЛЖ (2-й тип). Мышечный мостик передней межжелудочковой ветви». Сопутствующий – «транзиторный WPW-синдром».
В выписном эпикризе даны рекомендации по приему лекарственных препаратов (ацетилсалициловая кислота 100 мг, метопролол 50 мг, лизиноприл 1,25 мг в сутки) и динамическому наблюдению (выполнение контроля липидограммы, ЭКГ, Эхо-КГ, при возобновлении ангинозных болей рекомендовано проведение стресс Эхо-КГ). Через неделю после выписки в клиническом и биохимическом анализах крови наблюдалась нормализация показателей. Данные ЭКГ в динамике представлены на рис. 4–8. По результатам Эхо-КГ отмечен прирост ФВ до 64,8%, в остальном без отрицательной динамики. Но пациента очень тревожила мысль о имеющемся «мышечном мостике» как факторе, приведшем к развитию ИМ (такие объяснения пациент получил от лечащего врача), что и послужило поводом для дополнительной консультации кардиолога.
После анализа клинических проявлений (болевого синдрома в грудной клетке, лихорадки, сердцебиения, диареи), данных анамнеза (отсутствие факторов риска ИБС) и представленных лабораторно-инструментальных исследований (умеренное повышение уровней тропонина и КФК-МВ фракции в остром периоде, динамика ЭКГ, результатов КАГ, отсутствие локальных нарушений сократимости по данным Эхо-КГ и прирост ФВ во времени) предположено, что зарегистрированное повреждение миокарда, вероятнее всего, обусловлено перенесенной вирусной (неуточненной, кишечной?; соvid не подтвержден) инфекцией, которое протекало под маской ИМ.
Также в центре эндоваскулярной хирургии СЗГМУ им. И.И. Мечникова пересмотрены результаты КАГ, выполненные в остром периоде заболевания, где убедительных данных за «миокардиальный мостик суживающего просвет КА на 50% в систолу» и других стенозирующих изменений КА установлено не было. С целью дообследования рекомендовано выполнение магнитно-резонансной томографии (МРТ) сердца с контрастированием, по результатам которого получены следующие данные: правые камеры не изменены, участков локального нарушения сократимости правого желудочка не выявлено, полость ЛЖ не расширена, стенки ЛЖ не утолщены, глобальная сократительная способность ЛЖ сохранена, нарушений локальной сократимости не выявлено, признаков отека миокарда ЛЖ не визуализировано. После внутривенного контрастирования в отсроченную фазу отмечались слабоинтенсивные тонкие протяженные интрамуральные участки накопления контрастного препарата в переднебоковых, заднебоковых и передне- и нижнеперегородочных сегментах средних и базальных отделов (6-й, 8, 9, 11, 12-й сегменты) ЛЖ, небольшая интрамурально-субэпикардиальная зона умеренного накопления контраста в нижнем и заднебоковом сегментах базального отдела ЛЖ (4-й, 5-й сегменты).
Заключение: МР-картина участков интрамуральных и субэпикардиальных фиброзных изменений ЛЖ неишемического характера с учетом анамнеза, вероятно, постмиокардитический кардиосклероз.
Обсуждение
Миокардит может быть установлен в случае, если у пациента наблюдается ≥1 клинического проявления и ≥1 диагностического критерия, при условии отсутствия атеросклеротической бляшки, суживающей просвет КА на ≥50% и/или уже имеющихся сердечно-сосудистых заболеваний или внесердечных причин, которые могли бы объяснить этот синдром. У бессимптомных пациентов необходимо наличие ≥2 инструментальных критериев из разных категорий [1, 3, 5]. У нашего пациента в остром периоде имело место несколько клинических проявлений, таких как ангинозный характер болевого синдрома, диарея, лихорадка и сердцебиение, при обследовании регистрировалась инфарктоподобная ЭКГ, а на отсроченных постконтрастных изображениях при МРТ определялось характерное интрамуральное и субэпикардиальное накопление контрастного препарата (следует напомнить, что МРТ сердца выполнялось спустя более 3 месяцев после острого периода, поэтому по данным МРТ не были выявлены признаки воспалительного отека). При постановке диагноза также были учтены такие данные, как отсутствие факторов риска ИБС: мужской пол и молодой возраст (связывают с особенностями выраженности иммунного ответа у молодых мужчин за счет воздействия половых гормонов) [1–3]. Выполнение эндомиокардиальной биопсии миокарда в данном случае было нецелесообразным ввиду благоприятного клинического течения.
При наличии выраженного болевого синдрома в грудной клетке, различной степени повышения уровня кардиоспецифичных маркеров и инфаркто-подобных изменений на ЭКГ или Эхо-КГ ведение такого пациента полностью правомочно по протоколу ОКС с проведением КАГ [6, 8–10]. Но при получении дополнительных данных (в отсутствие стенотического/окклюзирующего поражения КА) диагностический поиск следует продолжить. Мышечный мостик (по данным КАГ встречаются в 5–12% и чаще всего затрагивают переднюю межжелудочковую артерию) как причина ИМБОКА достаточно редка и, как правило, реализуется на фоне тяжелой тахикардии (за счет значимого укорочения диастолы). Объяснение тому лежит в том, что мышечный мостик, являясь тканью миокарда, сдавливает КА во время систолы, а в диастолу артерия расправляется, не нарушая коронарный кровоток [4–6].
При исключении ИМ 2-го типа и при наличии дополнительных признаков респираторной или кишечной инфекции диагноз миокардита должен рассматриваться как наиболее вероятный.
Таким образом, ретроспективный анализ клинической картины и данных исследований позволяют говорить, что пациент перенес острый миокардит, вероятнее всего, вирусного генеза (неуточненный), протекавший под маской ИМБОКА. В связи с изменившимся диагнозом пациенту был отменен прием ацетилсалициловой кислоты и рекомендовано диспансерное наблюдение.
Выполнение эндомиокардиальной биопсии, которая длительное время служила основой подтверждения и классификации миокардитов, сопряжено с определенными трудностями и не всегда выполнимо (отказ пациента, инвазивное вмешательство с возможным развитием осложнений, отсутствие инструментария/высококвалифицированных специалистов для проведения биопсии, квалифицированных патологоанатомов для оценки гистологического материала, лабораторного оснащения для проведения иммуногистохимического/молекулярно-биологического исследования), поэтому в каждом конкретном случае ее проведение служит предметом обсуждения. И в настоящее время этот метод диагностики уступает место МРТ миокарда с парамагнитным контрастом, точность которого позволяет дифференцировать тканевой состав миокарда на уровне, близком к гистологическому. Характерный феномен отсроченного контрастирования обусловлен тем, что накопление гадолиния происходит во внеклеточных пространствах на участках некротизированного и отечного миокарда с нарушением его элиминации из зон фиброза, а также сочетанием этих факторов. Поэтому максимально раннее проведение МРТ для выявления воспалительных изменений в миокарде (с использованием критериев Lake Louise) позволяет разрешать этот сложный вопрос дифференциальной диагностики. Исход острого миокардита во многом определяется этиологией заболевания, скоростью прогрессиования симптомов и выраженностью сердечной недостаточности. Для оценки прогноза и выбора тактики лечения при миокардите в 2016 г. предложена классификация клиники Мэйо [1].
Заключение
Следует помнить, что ИМБОКА – «рабочий» диагноз, при котором требуется продолжить диагностический поиск [4–6]. Тщательный анализ клинико-инструментальных данных, дополнительное проведение МРТ сердца с контрастированием у данного пациента позволили ретроспективно пересмотреть диагноз с исключением ИМ и подтверждением миокардита. Поэтому от правильности интерпретации жалоб и трактовки симптомов, осведомленности причин ИМБОКА зависит своевременное начало лечения и определение объема необходимой специализированной помощи.
Согласие пациента. Информи-рованное добровольное согласие пациента отсутствует.



