Хронический риносинусит (ХР) является одним из наиболее распространенных и дискутабельных заболеваний в практике оториноларинголога, многие аспекты патогенеза которого, а следовательно, и адекватное лечение находятся на стадии изучения [1, 2]. В настоящее время созданы масштабные согласительные документы – EPOS-2005, -2007 и -2012, в которых проанализирован весь мировой опыт диагностики и лечения этого состояния [3, 4]. В результате проведенного анализа эксперты предлагают простую схему классифицикации ХР: ХР с полипозом и ХР без полипоза.
В России чаще употребляется термин «полипозный риносинусит», что также отражает вовлечение в патологический процесс не только околоносовых пазух, но и полости носа. Это в свою очередь несколько затрудняет постановку диагноза по системе МКБ-10, поскольку врачу приходится делать выбор между диагнозом «полипозная дегенерация синуса» и «полипы полости носа». Неясность этиопатогенеза, а также терминологические парадоксы обусловливают на сегодняшний день отсутствие идеального метода лечения полипозного риносинусита с противорецидивной гарантией [4, 5].
Несмотря на бурное развитие эндоскопической техники и популяризацию функциональной эндоскопической синус-хирургии, уменьшения количества таких пациентов не отмечается. Радикальная операция на верхнечелюстных пазухах в сочетании с тотальной этмоидэктомией также не является залогом отсутствия рецидива, а значительная травматичность вмешательства обусловливает длительный период восстановления с развитием послеоперационной болезни пазух, потребностью в длительной антибактериальной терапии, частых визитах к оториноларингологу [4].
Многие авторы отмечают, что причины возникновения полипозного процесса в околоносовых пазухах различны. В связи с этим и тактика лечения полипозного синусита должна носить дифференцированный подход, поскольку имеется достаточное количество консервативных методов лечения таких больных, которые в ряде случаев позволяют эффективно бороться с этим заболеванием [5].
Основой медикаментозной терапии для длительного контроля воспалительного процесса в полости носа являются интраназальные глюкокортикостероиды (ИГКС) или топические ГКС для интраназального применения. Создание ГКС можно назвать одним из ключевых научных достижений середины прошлого столетия. Однако, поскольку первоначально существовали только системные препараты, их использование сопровождалось выраженными побочными эффектами от синдрома Иценко–Кушинга до системного остеопороза. С появлением спустя 30 лет топических форм эта проблема была решена, поскольку даже применение высоких доз этих препаратов не сопровождалось значимой системной абсорбцией [6].
Первым топическим ГКС стал беклометазона дипропионат, успешно зарекомендовавший себя на группе пациентов с аллергическим ринитом и позднее – бронхиальной астмой. В дальнейшем были созданы другие топические ГКС, молекулы которых характеризовались улучшенными фармакологическими свойствами, а также происходило накопление клинического опыта их применения [6].
Противовоспалительный эффект топических ГКС связан с ингибированием воспалительных медиаторов, включая продукцию цитокинов; вмешательством в метаболизм арахидоновой кислоты; приводя, таким образом, к стабилизации клеточных мембран, уменьшению проницаемости сосудов, улучшению функции клеточных рецепторов [6].
В настоящее время среди топических ГКС наиболее изученными и распространенными в ЛОР-практике являются беклометазона дипропионат, будесонид, флутиказона пропионат, флутиказона фуроат и мометазона фуроат.
Эффективность ИГКС при лечении больных полипозным риносинуситом регулярно анализируется в документах EPOS. К настоящему времени издана уже 3-я редакция этого документа – EPOS-2012, представляющая собой детальный анализ всех аспектов риносинусита в целом, выполненный группой экспертов с применением современных принципов доказательности данных [4]. В документе рассмотрен и ряд позиций в отношении ИГКС, которые часто вызывают наибольшую полемику у практических оториноларингологов, а именно:
- эффективность монотерапии ИГКС при полипозном риносинусите;
- эффективность схемы ИГКС+ хирургическое лечение;
- когда ИГКС более эффективны перед и/или после хирургического лечения;
- каков наиболее эффективный способ доставки ИГКС – капли или спрей;
- какова длительность назначения ИГКС?
К сожалению, не на все эти вопросы можно найти однозначную рекомендацию в данном документе, что связано с тем, что не все анализируемые исследования по своему качеству могли быть включены в мета-анализ, однако ряд проблемных вопросов в EPOS-2012 освещен достаточно подробно.
ИГКС и хирургическое лечение
В целом улучшение носового дыхания при использовании схемы хирургическое лечение+последующее применение ИГКС было эффективнее, чем в случае монотерапии ИГКС, однако статистическая достоверность результатов в целом не была достигнута.
Капли или спрей
Ряд имеющихся на российском фармацевтическом рынке ГКС для интраназального использования представлен в виде капель в нос. В связи с этим в EPOS-2012 подчеркнуто преимущество ИГКС в виде назальных аэрозолей (спреев), признанных более эффективными в уменьшении симптомов полипозного риносинусита, однако объективное уменьшение полипозной ткани при сравнении между двумя вариантами доставки ГКС (капли или спрей) не было статистически значимым, что эксперты связывают с недостаточным качеством имеющихся исследований для включения в мета-анализ.
«Старые» генерации ИГКС против «новых»
По данным мета-анализа имеющихся в литературе исследований эксперты установили, что существенная разница в эффективности «новых», или «современных», генераций ИГКС (мометазона фуроат, флутиказона дипропионат) по сравнению со «старыми» отсутствует, что, конечно же, интересно с точки зрения экономической составляющей – ведь не секрет, что препараты на основе «старых» генераций ГКС существенно дешевле «новых».
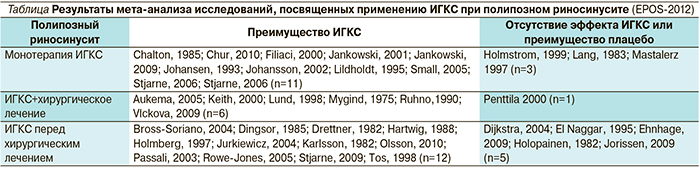
В целом по данным EPOS-2012 доля исследований, подтверждающих эффективность ИГКС при полипозном риносинусите, существенно больше, чем тех, в которых не подтверждена их эффективность или отмечено преимущество плацебо (см. таблицу) [4].
Если рассматривать проблему выбора ИГКС с фармакологической точки зрения, то их сравнение возможно по ряду параметров, одним из которых служит терапевтический индекс, представляющий собой отношение средней смертельной дозы к дозе, вызывающей терапевтический эффект у 50% экспериментальных животных. Данный показатель – наибольший у будесонида, что обусловлено высоким сродством препарата к глюкокортикоидным рецепторам и ускоренным метаболизмом после системной абсорбции [7, 8].
Помимо этого к важным характеристикам топических ГКС (отличающих их от системных) относятся липофильность и короткий период полувыведения из плазмы крови. Данные свойства также имеют определенные отличия в зависимости от препарата. Так, по сравнению с флутиказоном пропионатом/фуроатом и мометазона фуроатом будесонид отличается меньшей липофильностью, что позволяет ему быстрее и более эффективно проникать через слой слизи, покрывающей слизистую оболочку. Предположительно именно с этим свойством связана большая эффективность будесонида по сравнению с перечисленными ИГКС при применении в виде водных суспензий при аллергическом рините [9–11].
Попадая внутрь клетки, будесонид образует эфиры с длинноцепочечными жирными кислотами и задерживается в тканях на длительное время. Было установлено, что при попадании в верхние дыхательные пути эстерифицируется не менее 70% будесонида, при этом в плазме его эфиры не определяются [9–11].
Депонированный в тканях эстерифицированный будесонид при снижении концентрации его свободной формы в клетках при участии внутриклеточных липаз способен высвобождаться из эфиров и связываться с ГК-рецептором. Подобный механизм, не свойственный другим ГКС, способствует пролонгации противовоспалительного эффекта (до 24 часов) и, как полагает ряд авторов, является более важным, чем сродство к рецептору, свойством, однако и по последнему показателю будесонид превосходит ряд «старых» препаратов – беклометазона дипропионат, флунизолид триамцинолон, и сопоставим с активностью флутиказона пропионата/фуроата [12].
Одной из обсуждаемых в литературе тем и основной причиной беспокойств пациентов при назначении ИГКС являются опасения в связи с возможным системным действием этих препаратов. Если рассуждать на эту тему с позиций фармакологии, то для определения системной активности ИГКС необходимо проанализировать их системную биодоступность, липофильность, объем распределения, степень связывания с белками крови [13].
Общая системная биодоступность ИГКС определяется долей препарата, попавшей в системный кровоток с поверхности слизистой оболочки, и частью проглоченной доли, которая не была метаболизирована при первом прохождении через печень (оральная биодоступность). При этом будесонид является одним из ИГСК с наименьшей оральной биодоступностью [12, 14].
Следующими свойствами, определяющими безопасность будесонида, являются промежуточная липофильность, которая уже обсуждалась выше, и относительно небольшой объем распределения по сравнению с беклометазона дипропионатом и флутиказона пропионатом/фуроатом. Высокой липофильности соответствует больший объем распределения, лучшее проникновение в ткани и внутрь клеток и больший период полувыведения. В целом эти препараты будут клинически эффективнее, но при этом риск побочных эффектов системного характера возрастает [15].
Еще одним свойством, обеспечивающим будесониду низкую системную активность, – это степень связывания с белками плазмы крови, которая не отличается от показателя беклометазона дипропионата, флутиказона пропионата/фуроата и мометазона фуроата, но в сочетании с более коротким периодом полувыведения существенно снижает его потенциальную системную активность [12].
Официально будесонид для интраназального применения разрешен детям от 6 лет, хотя существуют отдельные исследования детей более раннего возраста. Так, в двойном слепом рандомизированном плацебо-контролируемом проспективном исследовании K.T. Kim (2004) с участием 78 детей 2–3 лет интраназальное применение будесонида на протяжении 6 недель не сопровождалось увеличением плазменного уровня кортизола [16].
Необходимо также отметить, что будесонид – единственный препарат среди топических ГКС, обладающий наилучшим рейтингом безопасности при беременности (В) по классификации FDA (Управление по контролю за качеством пищевых продуктов и лекарственных средств США) [17]. Эта позиция была основана на анализе 3 регистров Швеции с 1995 по 2001 г., в которых зафиксировано отсутствие повышения риска позднего токсикоза беременности, преждевременных родов, гипотрофии плода и врожденных пороков развития у 2000 новорожденных, матери которых применяли будесонид ингаляционно во время беременности [15, 16, 18, 19].
Таким образом, будесонид сочетает все необходимые свойства интраназального ГКС, обеспечивающие клиническую эффективность этого класса лекарственных средств: высокую кортикостероидную активность, длительное действие и низкую системную биодоступность.



