Коморбидность ишемической болезни сердца (ИБС) и хронической обструктивной болезни легких (ХОБЛ) на сегодняшний день остается одной из сложнейших проблем в практике терапевтов, кардиологов и пульмонологов.
Актуальность и практическая значимость коморбидности ХОБЛ и ИБС обусловлены следующими факторами:
- широкой распространенностью заболеваний, особенно в старшей возрастной группе и среди курящих пациентов;
- синдромом взаимного отягощения;
- сходными факторами риска;
- общими патогенетическими звеньями (гипоксия, оксидативный стресс, системное воспаление, эндотелиальная дисфункция, активация нейрогуморальных систем);
- сходством клинических проявлений и как следствие – сложностью трактовки отдельных клинических данных;
- трудностями в подборе терапии.
Одной из причин тяжелого течения ХОБЛ служит хроническая сердечная недостаточность (ХСН), а одной из причин тяжелого прогрессирующего течения ХСН – неконтролируемое, с частыми обострениями течение ХОБЛ.
В Российской Федерации распространенность ХСН I–IV функциональных классов (ФК) в популяции составила 7 % (7,9 млн). Клинически выраженная ХСН (II–IV ФК) имеет место среди 4,5 % (5,1 млн) населения. Распространенность терминальной ХСН (III–IV ФК) достигает 2,1 % (2,4 млн) [1]; в 59 % случаев развитие ХСН обусловлено ИБС [2]. ХОБЛ встречается у 20–30 % пациентов с застойной сердечной недостаточностью – СН [3]. В то же время более чем у 1/5 больных ХОБЛ имеется сопутствующая СН [4–6]. В старшей возрастной группе риск развития СН в 4,5 раза выше у пациентов с ХОБЛ, чем в контрольной группе [7].
Согласно данным популяционных исследований, у больных ХОБЛ риск сердечно-сосудистой смертности повышен в 2–3 раза и составляет приблизительно 50 % от общего числа смертельных случаев [8]. Лидирующей причиной смерти среди больных ХОБЛ остается дыхательная недостаточ-ность – ДН [9].
Дыхательная недостаточность – ведущий клинический синдром ХСН, ХОБЛ и их сочетания
Сложность трактовки клинических данных при коморбидности СН и ХОБЛ определяется множеством общих клинических синдромов, главным из которых является ДН. Клинически ДН при обоих заболеваниях весьма сходна, однако механизм ее развития различается. При СН дыхательная недостаточность носит вторичный характер, являясь следствием миокардиальной недостаточности. Миокардиальная недостаточность левого желудочка приводит к повышению давления в венах малого круга кровообращения – легочной венозной гипертензии, отеку легочной ткани – сначала итерстициальному, а далее – альвеолярному. Снижается эластичность и растяжимость легочной ткани, увеличивается толщина аэрогематического барьера. Все это закономерно приводит к нарушению газообменной функции легких: развивается гипоксемия, которая при стабильном состоянии пациента, как правило, бывает умеренной, а во время декомпенсации сердечной деятельности может принимать более тяжелое течение. Развитие гипоксемии в свою очередь приводит к нарушению окислительных процессов в тканях, что служит причиной накопления лактата, развития тканевого и системного метаболического ацидоза.
ДН является ведущим клиническим синдромом заболеваний легких. Одна из наиболее частых причин ДН – ХОБЛ.
ХОБЛ – заболевание, в основе которого лежит воспаление всех структур легочной ткани, индуцированное воздействием патогенных частиц или газов (поллютантов), приводящее к нарастающим, необратимым грубым морфологическим и функциональным изменениям в легких. Ведущим клиническим синдромом ХОБЛ считается нарастающая необратимая обструкция и прогрессирующая ДН. При ХОБЛ поражаются альвеолы с развитием грубых структурных нарушений: нарушение эластической стромы альвеол приводит к развитию эмфиземы. Генерализованное поражение бронхов всех калибров выражается в гибели реснитчатого эпителия, атрофии слизистой оболочки, развитии перибронхиального фиброза. Перибронхиальный фиброз и эмфизема – необратимые компоненты бронхообструкции. Важным этапом патогенеза ХОБЛ остается прогрессирующее поражение дыхательных мышц, проявляющееся в их утомлении, что еще больше нарушает биомеханику дыхания. В результате всех морфологических изменений нарушается функция легких, что влечет за собой нарушения газового состава крови: гипоксемия при ХОБЛ нередко сочетается с гиперкапнией, в период обострений нарушения газового состава крови еще больше усугубляются.
Из внимания специалистов часто упускается такое важное звено патогенеза легочной патологии, как поражение верхних дыхательных путей: носа, придаточных пазух, среднего уха, глотки. Верхние дыхательные пути являются первым барьером, обеспечивающим защиту органов дыхания. Богатая васкуляризация, реснитчатый аппарат, выделение слизи, богатой секреторными иммуноглобулинами, обеспечивают согревание, очищение и увлажнение вдыхаемого воздуха. Лимфоэпителиальное глоточное кольцо – важный компонент иммунной системы. При поражении верхних дыхательных путей утрачивается их защитная функция, а инфицированный патологический секрет, стекая по глотке, гортани и трахее, раздражает и инфицирует бронхи, вызывая в них воспаление.
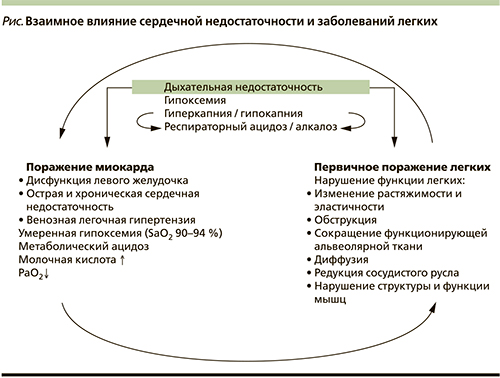
На рисунке показано, как миокардиальная недостаточность влияет на функцию легких, а первичные поражения легких влияют на сердечно-сосудистую систему. Нарушения газового состава крови присутствуют при обоих состояниях, вызывая нарушения кислотно-основного равновесия респираторного характера. В то же время нарушения доставки кислорода в ткани влекут за собой нарушение процессов окисления в клетках.
Развивается метаболический тканевой и системный ацидоз. В условиях измененного метаболизма нарушается работа всех органов и систем. Таким образом, вне зависимости от начального заболевания в конечном итоге в патологический процесс оказываются вовлеченными и дыхательная, и сердечно-сосудистая системы, что надо учитывать при разработке программ лечения. Медленно, но неотвратимо патогенетические механизмы ДН, связанные с поражением легких или сердца, тесно сплетаются и превращаются в единый механизм ДН. Для повышения эффективности лечения врачу необходимо уметь определить в этой тесной патогенетической связи долю каждого механизма, оценить вклад каждого состояния в ДН.
Диагностический алгоритм
Диагностика ДН и оценка ее патогенеза начинаются с анализа клинической картины и анамнеза. При сборе анамнеза следует выявлять факторы риска развития ИБС и ХОБЛ: курение и его стаж, интенсивность, воздействие поллютантов, наследственность, ранняя менопауза у женщин. Следует также выяснить, когда у больного стали появляться специфические признаки ХОБЛ (хронический кашель, одышка), а когда – признаки поражения сердца: загрудинные боли, сердцебиение, отеки нижних конечностей. Необходимо сопоставить сроки появления этих симптомов.
Ведущим симптомом ДН является диспноэ. Степень одышки варьируется в широких пределах: от ощущения дыхательного дискомфорта при физической нагрузке до ощущения тяжелого удушья при полном физическом покое, степень тяжести которого может быть выражена количественно в баллах (шкала Борга, MRС – Medical Research Council Dyspnea Scale). Начальным и очень важным этапом дифференциальной диагностики является анализ своеобразия и особенностей диспноэ: условия его возникновения, вариабельность и обратимость, сочетание с другими патологическими признаками: кашлем, отхождением мокроты, дистанционными и аускультативно выявляемыми сухими и влажными хрипами в легких; оценка влияния диспноэ на свободу речи, экскурсия грудной клетки [10].
Для объективной оценки ДН и степени ее тяжести широко используется метод пульсоксиметрии. Совершенно точно диагностировать этот синдром возможно при определении парциального давления кислорода (РаО2) и углекислоты (РаСО2) в артериальной крови.
Констатация факта обструкции дыхательных путей, ее лабильности и обратимости возможна при проведении исследования и мониторирования пиковой скорости выдоха (ПСВ), кривой «поток–объем» с проведением бронходилатационного теста в острой фармакологической пробе с β2-агонистом или в процессе лечения (длительное применение бронходилататоров или противоастматических профилактических лекарственных препаратов, глюкокортикостероидов – ГКС).
Для уточнения механизмов развития ДН во многих ситуациях необходимо проведение бронхоскопии, рентгеноморфологических методов обследования, использование методов, задача которых состоит в получении субстрата патологического процесса (мокрота, бронхиальные и лаважные смывы, частицы тканей) [10].
Для оценки структуры и функции сердца используются как клинические методы (перкуссия для определения границ сердца, аускультация для выявления шумов, ритма галопа), так и ряд инструментальных методик.
Электрокардиография (ЭКГ) остается важнейшим и наиболее доступным методом оценки электрофизиологических функций сердца. Нарушение электрофизиологической функции – важная составляющая дисфункции сердца. Сохранность электрофизиологических свойств сердца во многом определяет насосную функцию сердца. При различных нарушениях сердечного ритма и проводимости неизбежно нарушается сердечный выброс, снижаются минутный и ударный объемы. Для более точного выявления нарушений рекомендуется суточное мониторирование ЭКГ по Холтеру.
Для определения структуры сердца используется метод эхокардиографии (ЭхоКГ). Он позволяет оценить глобальные и локальные нарушения сократимости, размеры полостей и толщину стенок сердца, состояние клапанного аппарата. ЭхоКГ-исследование в допплеровском режиме позволяет оценивать кровоток в камерах сердца и магистральных сосудах.
Роль натрийуретических пептидов
Спорным вопросом остается роль натрийуретических пептидов в дифференциальной диагностике СН. Известно 4 типа натрийуретических пептидов: предсердный (atrial natriuretic peptide – ANP), мозговой (brain natriuretic peptide – ВNP), натрийуретический пептид типа С (С-type natriuretic peptide – CNP) и натрийуретический пептид типа D (dendroaspis natriuretic peptide – DNP), выделенный из яда змеи зеленая мамба [11–13].
Предсердный и мозговой натрийуретические пептиды вырабатываются миокардом предсердий и желудочков, соответственно в виде неактивных предшественников. Стимулом для их продукции служит повышение напряжения миокарда вследствие перегрузки объемом, а также гипоксия [14]. Натрийуретический пептид типа С синтезируется головным мозгом, эндотелием сосудов, эпителиальными клетками канальцев и собирательных трубочек почек, стимулом для его синтеза является эндотелин-1 [12, 15]. Натрийуретический пептид типа Д выделен из яда змеи зеленая мамба, его роль в человеческом организме изучена недостаточно, что ограничивает клиническое применение [16].
Натрийуретические пептиды
(НУП) – это физиологические антагонисты ренин-ангиотензин-альдостероновой системы (РААС) и одно из важных звеньев регуляции водно-электролитного баланса. Относительно НУП типа С имеется немало сведений о его связи с эндотелиальной дисфункцией и уровнем С-реактивного белка [17]. Важной для понимания механизма действия НУП является их связь со специфическими рецепторами. Существуют 3 типа рецепторов – трансмембранных белков, с которыми специфично связываются НУП: NPR-А, NPR-B и NPR-C.
Однако преимущественная аффинность рецепторов не вполне совпадает с типом пептидов. Предсердный НУП (ПНУП) и мозговой НУП связываются с рецепторами ПНУП (NPR-A) и снимают блокаду внутриклеточной гуанилатциклазы, в результате этого из гуанилаттрифосфата (ГТФ) и образуется циклический гуанозинмонофосфат (цГМФ), действия которого опосредуют натрийурез, вазодилатацию, подавление секреции ренина, антимитогенез – подавление роста мезангиальных клеток, сосудистых гладко-мышечных клеток, сердечных фибробластов и эндотелиальных клеток. НУП типа С, связываясь с рецепторами МНП (NPR-B), не вызывает заметных натрийуретического и диуретического эффектов, но через действие гуанилатциклазы и цГМФ оказывает вазодилатирующее действие и подавляет рост гладкомышечных клеток сосудов, модулируя их фенотип [15].
Долгое время НУП считались патогномоничным маркером СН. Действительно, концентрация НУП типа А и В (предсердный и мозговой) повышается при ИБС, особенно при застойной СН и инфаркте миокарда. Уровень НУП возрастает также и при легочной гипертензии – как первичной, так и вторичной – пропорционально степени гипертензии [18, 19]. Однако исследования ХОБЛ и ассоциированного с ней отечного синдрома показали, что даже в отсутствие легочной гипертензии уровень НУП у этих больных также повышен, т.к. имеет место выраженная активация РААС и гипоксия, но повышение уровня НУП у больных ХОБЛ менее выраженное, чем у больных застойной СН [20–24].
Таким образом, уровень НУП не может считаться универсальным, однозначным и надежным дифференциально-диагностическим критерием при сочетании СН и ХОБЛ, тем более что в литературе нет четкого количественного критерия, который позволил бы дифференцировать ХСН и ХОБЛ. Лишь в том случае, когда уровень мозгового НУП ниже 100 пг/мл, можно исключить СН как причину одышки у пациента, т.е. уровень НУП скорее является отражением ретенции натрия и воды в организме, активации симпатоадреналовой системы (САС) и РААС [24]. Тем не менее уровень НУП служит достаточно надежным прогностическим критерием – высокие уровни НУП коррелируют с худшим прогнозом и критерием оценки эффективности проводимой терапии [15, 25].
Дифференциальная диагностика отечного синдрома
Отечный синдром у пациентов с СН, ХОБЛ и пациентов с сочетанием ХОБЛ и ХСН заслуживает внимания, поскольку лечение таких больных зависит от его верной интерпретации.
Механизм формирования отеков при СН связан в первую очередь с падением сердечного выброса, постепенной утратой сердцем насосной функции. Снижение насосной функции приводит к развитию легочной венозной гипертензии, далее посредством рефлексов Китаева и Парина происходит депонирование крови в венозном отделе сердечно-сосудистой системы. Снижается перфузионное давление органов и тканей, развиваются тканевая гипоксия и тканевой метаболический ацидоз. В этих условиях раньше других нейрогуморальных систем активируется САС. Ее активация осуществляется через барорецепторы каротидного синуса и дуги аорты, немедленно реагируюющие на падение ударного объема сердца. С барорецепторов импульсы поступают в сосудодвигательный центр продолговатого мозга, который активирует симпатическую нервную систему и угнетает парасимпатическую. Активность САС определяется также эргорефлексом с мышечных метаболических рецепторов в тканях. Эти рецепторы активируются при накоплении в тканях лактата и других недоокисленных продуктов. Немаловажную роль имеют хеморецепторы каротидного синуса и дуги аорты, которые реагируют на снижение РаСО2 и рН в крови. Активация САС приводит к активации аргинин-вазопрессиновой системы и повышению выработки антидиуретического гормона.
Нарастающая гипоксия, тканевой метаболический ацидоз способствуют нарушению работы всех органов, в т.ч. почек, являющихся ключевым органом регуляции водно-электролитного баланса. В условиях гипоксии повышается выработка ренина юкстагломерулярным аппаратом, активируется РААС, одним из конечных эффектов которой является повышение уровня альдостерона, который в свою очередь отвечает за усиление реабсорбции натрия и воды.
Результатом действия нейрогуморальных систем является ретенция натрия и воды, патофизиологический смысл которой в поддержании перфузионного давления. Повышение объема циркулирующей крови и депонирование крови в венозном русле приводят к росту гидростатического давления в сосудах, постепенно плазма начинает перемещаться из циркуляторного русла в интерстиций, формируются отеки.
Несколько иной механизм отечного синдрома наблюдается при ХОБЛ. Говоря об отечном синдроме при ХОБЛ, необходимо сказать о фенотипе, при котором он чаще встречается. Еще в 1966 г. Burrows было выделено два ведущих фенотипа ХОБЛ: бронхитический и эмфизематозный [26]. Для эмфизематозного фенотипа характерны выраженные нарушения биомеханики дыхания, связанные с развитием эмфиземы, раннего экспираторного коллапса бронхиол. Отечный синдром для этого фенотипа нехарактерен. Для бронхитического фенотипа в большей степени характерно ремоделирование бронхов и связанные с ним нарушения вентиляции, у пациентов с бронхитическим фенотипом значительно чаще наблюдаются нарушения газового состава крови и отечный синдром.
Так с чем же связан отечный синдром у пациентов с ХОБЛ? Одной из причин является декомпенсация хронического легочного сердца. При длительном течении ХОБЛ нарушается структура легких, вследствие действия протеиназ разрушается эластическая строма легочной ткани, редуцируется сосудистое русло, развивается вторичная легочная гипертензия. В ответ миокард правых отделов сердца начинает гипертрофироваться, и эти изменения изначально носят адаптивный характер. Со временем адаптивный характер гипертрофии утрачивается, присоединяется дилатация правого желудочка и предсердия, что в конечном итоге приводит к развитию декомпенсированной правожелудочковой недостаточности и отечного синдрома.
Большое значение в патогенезе отеков у больных ХОБЛ имеют респираторный ацидоз и нарушения газового состава крови: гипоксемия и гиперкапния. Эти изменения ответственны за развитие отечного синдрома у больных с нормальным давлением в легочной артерии и сохранной структурой правых отделов сердца. Респираторный ацидоз приводит к усиленной реабсорбции бикарбоната в проксимальных почечных канальцах для поддержания рН крови. В этих условиях для поддержания электронейтральности плазмы усиливается реабсорбция натрия и калия, а для поддержания осмолярности – реабсорбция воды. С другой стороны, гипоксемия непосредственно воздействует на почки: вследствие гипоксии юкстагломерулярного аппарата активируется РААС, что также приводит к ретенции натрия и воды. Диоксид углерода является мощным вазодилататором, и даже нормальный сердечный выброс в условиях гиперкапнии становится неадекватно низким, циркуляторное русло «запустевает». На эти изменения немедленно реагируют барорецепторы каротидного синуса и дуги аорты, вызывая активацию САС, гипоксия юкстагломерулярного аппарата приводит к дополнительной активации РААС. Все это также приводит к усилению реабсорбции воды. В этом случае патофизиологический смысл происходящих изменений состоит в попытке организма «разбавить» высокую концентрацию двуокиси углерода тогда, когда легкие не способны вывести этот избыток.
Итак, патофизиологический смысл и механизмы отечного синдрома при ХОБЛ и СН различаются, но их сходными чертами является участие САС, аргинин-вазопрессиновой системы и РААС.
Лечение
Даже если врачу удалось провести дифференциальную диагностику ДН и отечного синдрома, выявить ведущую нозологию, то встает другой сложный вопрос: определение стратегии лечения больного с сочетанием СН и ХОБЛ.
Подход к лечению такого пациента должен быть строго индивидуальным, необходимо тщательно оценить возможные побочные эффекты каждого препарата и максимально использовать немедикаментозные методы во избежание полипрагмазии, которая неизбежно снижает приверженность пациента к лечению.
Немедикаментозное лечение и легочная реабилитация
Немедикаментозные методы лечения подразумевают прежде всего коррекцию образа жизни. Большое значение имеет обучение больного: следует объяснить сущность болезни, возможности профилактики обострений и лечения, необходимо добиваться максимальной приверженности лечению.
Отказ от курения абсолютно показан всем больным как с ХОБЛ, так и с кардиальной патологией, поскольку курение остается первой и одной из важнейших причин обоих заболеваний.
Больным с повышенной массой тела рекомендуется коррекция питания и расширение двигательной активности. Пациентам с пониженной массой тела, напротив, следует рекомендовать рацион с повышенной калорийностью и содержанием белка. Важным является сочетание сбалансированного рациона с физическими тренировками. Для больных, как и для здоровых людей, сохраняются следующие принципы тренировок: интенсивности (более высокие уровни интенсивности тренировок приводят к лучшим результатам), специфики (эффект проявляется только в тренированных группах мышц) и принцип обратимости (прекращение регулярных тренировок приводит к потере эффекта) [9]. Общая продолжительность физических тренировок зависит от целей индивидуальной программы реабилитации, но должна основываться на особенностях респираторной патологии, преобладающей у больного, состоянии сердечно-сосудистой системы, его физическом статусе и результатах предыдущих занятий. Рекомендуется по крайней мере, 8 недель физических тренировок в качестве составной части комплексной легочной реабилитации [9].
Обязательно мероприятие ежегодной вакцинопрофилактики гриппа и вакцинации поливалентной пневмококковой вакциной – эти меры позволяют снижать риск обострений ХОБЛ, связанных с респираторными инфекциями.

Оксигенотерапия – неотъемлемая часть немедикаментозного лечения ХОБЛ. Крупные исследования показали улучшение выживаемости больных, получавших кислород, по сравнению с больными, не получавшими его [27, 28]. Основным критерием начала кислородотерапии является РаО2 артериальной крови менее 55 мм рт. ст. (менее 60 мм рт. ст. при наличии сопутствующей патологии) при нахождении пациента в состоянии стабильной ХОБЛ три и более недель.
Роль неинвазивной вентиляции легких
Неинвазивная вентиляция (НВЛ) легких является эффективным методом коррекции вентиляционных расстройств и обладает рядом преимуществ:
- Отсутствие осложнений, связанных с интубацией: травмы гортани, трахеи; осиплости голоса и стридора вследствие экстубации и др.
- Уменьшение частоты нозокомиального инфицирования (вентилятор-ассоциированных пневмоний).
- Комфорт для пациента: возможность говорить, откашливаться, принимать пищу.
- Снижение необходимости седации.
- Простота применения и неинвазивность метода.
- Простота отлучения от НВЛ.
- Экономическая эффективность. Неинвазивная вентиляция в среднем в 4–5 раз дешевле, чем инвазивная вентиляция с интубацией [29].
НВЛ обеспечивает улучшение оксигенации путем вовлечения в процесс дыхания невентилируемых альвеол, таким образом уменьшаются вентиляционно-перфузионный дисбаланс и фракция шунта. Кроме того, НВЛ в режимах СРАР (continuous positive airway pressure) и ВiРАР (bi-level positive airway pressure) создает своеобразный воздушный буфер, препятствующий раннему экспираторному коллапсу дистальных бронхиол. Эти эффекты в свою очередь способствуют коррекции газового состава крови, кислотно-основных нарушений, разгрузке дыхательной мускулатуры. Все это позволяет с успехом применять НВЛ не только при бронхообструктивных заболеваниях, но и при кардиогенном отеке легких, пневмониях, муковисцидозе, нейромышечных заболеваниях, травмах грудной клетки.
Для НВЛ используются портативные и «реанимационные» респираторы, маски – носовые и лицевые, кроме того, ряд масок имеют порт для подключения кислорода. Маска должна быть комфортной для пациента и обеспечивать минимум утечек. Для проведения НВЛ пациент должен быть в сознании, активно сотрудничать с врачом и следовать его инструкциям. Предпочтительнее использовать НВЛ больным, требующим потенциально короткого периода респираторной поддержки. Во время проведения НВЛ необходимо тщательно мониторировать витальные функции пациента [30].
Показания к прекращению НВЛ и переводу на искусственную вентиляцию легких [30]:
- Неспособность больного переносить маску вследствие дискомфорта или боли.
- Неспособность масочной вентиляции улучшить газообмен или уменьшить диспноэ.
- Необходимость эндотрахеальной интубации для удаления секрета или защиты дыхательных путей.
- Нестабильность гемодинамики.
- ЭКГ-нестабильность с явлениями ишемии или клинически значимые желудочковые аритмии.
- Нарастание энцефалопатии у больного.
- Остановка дыхания.
- Нарушение сознания.
Побочные эффекты НВЛ: мацерация и повреждения кожи лица в месте контакта с маской, аэрофагия, утечки, конъюнктивиты, дискомфорт при дыхании, раздражение слизистой оболочки носа. Иногда устранить недостатки можно с помощью тщательного отбора пациентов и подбора масок.
Медикаментозное лечение пациентов с ХОБЛ и СН
Медикаментозное лечение пациентов с ХОБЛ и СН представляет серьезные сложности, даже несмотря на успехи современной фармакологии. Важными и спорными аспектами остаются влияние на β-адренорецепторы (блокада и стимуляция), использование ГКС, ингибиторов фосфодиэстеразы, диуретиков, ингибиторов ангиотензинпревращающего фермента (иАПФ).
Влияние на β-адренорецепторы
Лечение сосуществующих ХОБЛ и ИБС требует разнонаправленного влияния на β-адренорецепторы: стимуляции β2-адренорецепторов для лечения ХОБЛ и блокады β1-адренорецепторов для лечения ИБС. Как поступить клиницисту в этой ситуации? Во-первых, необходимо выделить первичную и ведущую патологию. Во-вторых, рассмотреть возможность замены на препарат другого класса, но с аналогичным клиническим эффектом. Так, в ряде случаев удается в качестве антиишемического препарата использовать блокаторы кальциевых каналов, а в качестве бронхолитиков – вместо β2-агонистов использовать антихолинергические препараты.
Эталонным классом препаратов для лечения ИБС являются β-адреноблокаторы, достоверно снижающие смертность и улучшающие прогноз не только для больных ИБС, но и для больных с сочетанием ХОБЛ и ИБС [31], поэтому часто их применение бывает жизненно необходимым. При необходимости назначения β-адреноблокаторов больным ХОБЛ следует отдавать предпочтение β-адреноблокаторам с высоким индексом кардиоселективности (см. таблицу).
Следует помнить, что кардиоселективность дозозависима и при увеличении дозы β-адреноблокатора снижается, поэтому при применении антиишемических препаратов данного класса необходимо тщательно контролировать бронхиальную проходимость.
С другой стороны, использование β2-агонистов с целью бронходилатации также имеет свои ограничения ввиду их способности вызывать тахикардию, гипокалиемию, удлинять интервал QT и увеличивать потребность миокарда в кислороде. В исследованиях показано увеличение риска смерти при приеме β2-агонистов пациентами с левожелудочковой недостаточностью [32, 33], увеличение риска аритмий [34]. По этой причине пациентам, страдающим ХОБЛ на фоне СН, следует избегать приема пероральных β-агонистов, отдавая предпочтение ингаляционному пути введения. Лучшей альтернативой являются лишенные побочных эффектов в отношении сердечно-сосудистой системы длительно действующие антихолинэргические препараты, такие как тиотропия бромид. Его эффективность и бóльшая безопасность по сравнению с салметеролом для пациентов с ХОБЛ и СН была продемонстрирована в исследовании POET-COPD [35].
Глюкокортикостероиды
ГКС, воздействуя на процессы транскрипции различных генов и взаимодействуя с рецепторами клеточных мембран, снижают синтез факторов воспаления и повышают синтез противовоспалительных медиаторов. Это позволяет широко использовать данный класс препаратов в лечении ХОБЛ. Однако системные ГКС обладают рядом побочных эффектов, крайне нежелательных для пациентов с СН: ретенция натрия и воды, увеличение транскрипции генов, кодирующих синтез β-адренорецепторов (увеличение количества β-адренорецепторов и повышение их аффинности к катехоламинам), гипергликемия. Эти эффекты ограничивают широкое применение системных ГКС, особенно пациентами с СН.
Доказанной эффективностью для лечения больных ХОБЛ обладают ингаляционные ГКС (ИГКС). Особенно удобны для пациентов комбинированные препараты, включающие ИГКС и длительно действующие бронхолитики. Ряд исследований, таких как TORCH (Towards a Revolution in COPD Health), INSPIRE (Investigating New Standards for Prophylaxis in Reducing Exacerbations), свидетельствует о способности препаратов этой группы снижать частоту обострений, замедлять падение объема форсированного выдоха за первую секунду (ОФВ1), улучшать качество жизни, снижать выраженность симптомов заболевания [36–42]. Кроме того, ингаляционный путь введения ГКС сопряжен с минимальным риском развития нежелательных системных эффектов, быстрым достижением терапевтической концентрации в бронхиальном дереве, более длительным сохранением препарата в ткани дыхательных путей [43]. Важным фактором, влияющим на эффективность препарата, являются его липофильность и размер ингалируемых частиц [44]. Разноречивые и единичные данные о появлении системных эффектов при применении ИГКС, скорее всего, являются следствием неправильного использования ингаляционного устройства и нарушения техники ингаляции, что приводит к оседанию большей части дозы в ротовой полости и заглатыванию. При применении ИГКС необходимо придерживаться следующих правил: назначение минимально эффективной дозы, контроль техники ингаляции и тщательный мониторинг (контроль пикфлоуметрии, ОФВ1, артериального давления, частоты сердечных сокращений).
Ингибиторы фосфодиэстеразы
Использование метилксантинов при ХОБЛ связано с их способностью расслаблять гладкую мускулатуру бронхов, оказывая выраженный бронхолитический эффект. Однако неселективные ингибиторы фосфодиэстеразы, к которым относятся препараты теофиллина, обладают рядом побочных эффектов, делающих невозможным их применение пациентами с ИБС и/или СН: тахикардия, наджелудочковые и желудочковые нарушения ритма, гипокалиемия; препараты противопоказаны при инфаркте миокарда, нестабильной стенокардии, гипертрофической кардиомиопатии.
Селективный ингибитор фосфодиэстеразы 4 типа (ФДЭ-4) – рофлумиласт одобрен Европейским медицинским агентством (EMEA) в 2010 г. и Управлением по контролю за продуктами и лекарствами (FDA) в 2011 г.
В Российской Федерации препарат зарегистрирован в 2011 г. для терапии тяжелой ХОБЛ с частыми обострениями заболевания в анамнезе (≥ 2 в год). Этот фенотип заболевания характеризуется высоким уровнем нейтрофильного воспаления в легких. Его активность связана с ингибированием ФДЭ-4, что приводит к повышению внутриклеточного уровня циклического аденозинмонофосфата и ослаблению связанной с ХОБЛ дисфункции лейкоцитов, клеток дыхательных путей и гладких мышц легочных сосудов, эндотелиальных и эпителиальных клеток дыхательных путей, а также фибробластов [45]. При регулярном применении рофлумиласта, благодаря противовоспалительному действию препарата, у больных ХОБЛ постепенно увеличивается показатель ОФВ1, достигая максимума через 2–4 недели лечения. Рофлумиласт практически лишен побочных эффектов в отношении сердечно-сосудистой системы, что вместе с его способностью снижать массу тела и благотворно влиять на углеводный обмен делает этот препарат привлекательным для лечения полиморбидных пациентов с сочетанием ИБС, ХОБЛ, артериальной гипертензии, ожирения и сахарного диабета [46].
Диуретики
Диуретики (петлевые, тиазидные, тиазидоподобные, антагонисты альдостерона) – один из важнейших классов препаратов в лечении пациентов с СН. Однако стоит с осторожностью относиться к применению диуретиков пациентами с бронхитическим фенотипом ХОБЛ. Как было сказано выше, патогенез отеков у пациентов с ХОБЛ не всегда связан с декомпенсацией хронического легочного сердца. Когда в основе отечного синдрома лежит ренальная дисфункция и у пациента присутствует хронический респираторный ацидоз (или смешанные нарушения кислотно-основного равновесия), диуретики могут спровоцировать развитие или усугубление метаболического алкалоза за счет развития гипонатриемии и гипохлоремии. Метаболический алкалоз в свою очередь усугубляет ДН и удлиняет продолжительность респираторной поддержки [47]. Кроме того, диуретики всех групп мобилизуют жидкость из сосудистого русла, а в условиях гиперкапнии, которая приводит к выраженной вазодилатации, использование диуретиков приведет к еще большему «запустеванию» сосудистого русла. Снижается перфузионное давление, усиливается гипоксия органов, в т.ч. почек, происходит дальнейшая активация нейрогуморальных систем, ответственных за ретенцию воды. Таким образом, диуретики для пациентов с бронхитическим фенотипом ХОБЛ не только не эффективны, но и усугубляют имеющиеся нарушения кислотно-основного и водно-электролитного баланса. При наличии доказанной СН назначать диуретики следует, однако желательно сочетать их с ацетазоламидом [48].
Ингибиторы ангиотензинпревращающего фермента
иАПФ – важнейший класс препаратов, используемых для лечения СН и артериальной гипертензии. Препараты этой группы обладают доказанной способностью улучшать прогноз больных с сердечно-сосудистой патологией: данные 32 рандомизированных исследований показывают, что применение иАПФ позволило снизить смертность в среднем на 23 % и уменьшить общее число случаев госпитализации в связи с декомпенсацией ХСН на 35 % [49, 50].
Многие специалисты избегают назначения иАПФ больным ХОБЛ, полагая, что эти препараты усугубляют бронхообструкцию, проявляющуюся кашлем. Однако эта тактика не обоснованна, т.к. кашель при приеме иАПФ связан с замедлением деградации брадикинина, а в развитии бронхообструкции при ХОБЛ участвуют другие медиаторы воспаления, такие как интерлейкин-8, фактор некроза опухоли-α, нейтрофильные протеазы, свободные радикалы. Кроме того, в легких существует мощная ферментативная система, направленная на усиление биодеградации всех кининов, в т.ч. брадикинина.
С другой стороны, на фоне приема иАПФ больными с сочетанием ХОБЛ и СН может наблюдаться улучшение функции внешнего дыхания, связанное с уменьшением венозного застоя в малом круге кровообращения в результате снижения пред- и постнагрузки [51]. Имеются данные, согласно которым иАПФ могут снижать гипоксическую вазоконстрикцию [52], поэтому препараты этого класса необходимо назначать больным с сочетанием ХОБЛ и СН. При развитии сухого кашля, не позволяющего продолжить терапию иАПФ, рекомендуется в качестве альтернативы рассмотреть применение антагонистов рецепторов ангиотензина II или прямых ингибиторов ренина.
Заключение
Коморбидность ХОБЛ и СН – частая и сложная клиническая ситуация. Работая с таким пациентом, клиницист должен проявить системный подход, чтобы на максимально ранних стадиях идентифицировать каждое состояние и оценить его вклад в общий патогенез болезни. Создать верную стратегию лечения помогает только точная, индивидуальная, всесторонняя оценка анамнеза и всех клинических данных, рациональный подход к выбору медикаментозной терапии и максимально возможное использование немедикаментозных способов лечения.



