Введение
Диспепсические жалобы – одна из наиболее распространенных жалоб среди пациентов с патологией гастродуоденальной зоны и особенно часто встречаются у больных функциональными заболеваниями желудочно-кишечного тракта – ЖКТ [1, 2]. В рутинной медицинской практике пациентов с диспепсическим синдромом ежедневно обследуют как гастроэнтерологи, так и специалисты других направлений медицины. Следует отметить, что причиной развития таких заболеваний далеко не всегда служит органическая патология [3–5].
Сам термин «диспепсия» (диспепсический синдром, от греч. «плохое пищеварение») определяется как комплекс симптомов дискомфорта, связанного с приемом пищи или опорожнением кишечника, свидетельствующий о нарушении пищеварительной функции желудка (желудочная диспепсия) или кишечника (кишечная диспепсия). К проявлениям желудочной диспепсии относят отрыжку, тяжесть в эпигастральной зоне, срыгивание, ощущение ускоренного наполнения, тошноту, рвоту, в то время как к проявлениям кишечной диспепсии – явления метеоризма, диарею, запор [2].
В настоящее время для квалификации первичных функциональных расстройств желудка введено понятие «функциональная диспепсия» (ФД), имеющее смысл нозологической единицы, заболевания ЖКТ функциональной природы, отраженное в Международной классификации болезней 10-го пересмотра шифрами К 30 – Диспепсия или К 31 – Функциональные расстройства желудка.
ФД объединяет целый симптомокомплекс, состоящий из болевых ощущений и жжения в подложечной области, ощущения переполнения в эпигастральной области после приема пищи, раннего насыщения, ощущения дискомфорта, наблюдавшегося у пациента в течение трех последних месяцев (общий интервал жалоб не менее 6 месяцев), исключая органическую патологию. Таким образом, все проявления ФД носят сугубо функциональный характер [6].
По данным ряда исследований, кислотный фактор является преобладающим по этиологической значимости развития клинических проявлений ФД, в т.ч. выраженного болевого синдрома, т.к. желудочная гиперсекреция является значимым патогенетическим фактором заболевания [3, 6, 7].
С другой стороны, имеются исследования, свидетельствующие о том, что у пациентов с ФД и здоровыми лицами различий в уровнях секреции желудком соляной кислоты не выявлено [8]. Причем даже у лиц с болевым (язвенно-подобным) вариантом часто не выявляется гиперпродукция соляной кислоты [8], но у части пациентов с указанным клиническим вариантом кислотообразование соответствует таковому при язвенной болезни двенадцатиперстной кишки. Вместе с тем нередко успех лечения пациентов с ФД достигается только после применения антисекреторных препаратов. Не исключено, что не сам уровень кислотной продукции решающий в появлении симптомов ФД, конкретно боли, а длительность контакта содержимого желудка и двенадцатиперстной кишки с низким рН со слизистой оболочкой гастродуоденальной зоны, при нарушении моторно-эвакуаторной функции желудка и двенадцатиперстной кишки, особенно в условиях их повышенной висцеральной чувствительности [7]. При этом сам кислотный фактор может обусловливать гиперсенситивность, снижая порог возбудимости рецепторного аппарата стенки желудка к естественным раздражителям, вызывая боль.
Достоверно известно, что кислотозависимые заболевания ЖКТ напрямую коррелируют с развитием воспалительно-деструктивных процессов в тканях пародонта [10–12]. В свою очередь воспалительно-деструктивное поражение пародонта может приводить к сенсибилизации всего организма и усугублению течения заболеваний нестоматологического профиля. В ряде случаев тяжесть заболеваний гастродуоденальной зоны непосредственно связана с выраженностью очагов поражения в ротовой полости и эффективностью проводимого лечения воспалительной патологии пародонта и слизистой оболочки полости рта [13, 14].
Ведущие мировые ученые расходятся во мнениях в попытке описать механизм развития воспалительных заболеваний пародонта. Одним из основных этиологических факторов возникновения хронического генерализованного пародонтита (ХГП) на сегодняшний день считается микробный, включающий более 2000 видов микроорганизмов, наиболее вирулентные из которых пародонтопатогены Aggregatibacter actinomycetemcomitans, Prevotella intermedia, Tannerella forsythia, Treponema denticola и Porphyromonas gingivalis. Санация заболеваний пародонта заключается в применении общих и местных антимикробных препаратов в комплексе с мероприятиями по нормализации гигиены ротовой полости (над- и поддесневых зубных отложений). При этом ни в одной из стран мира, включая Россию, в рутинной диагностике не используется анализ качественного и количественного состава микрофлоры над- и поддесневого налета ни методами классической микробиологии, ни с помощью полимеразной цепной реакции (ПЦР).
В обосновании укоренившегося подхода к лечению пародонтита в современной литературе подчеркивается ведущая роль в возникновении воспалительной патологии пародонта микробной бляшки, включающей в свой состав великое множество микроорганизмов, обитающих в полости рта.
С учетом изложенного целью настоящего исследования стало изучение роли антагонистических отношений между компонентами микробиоценоза пародонта, направленное на поиск потенциальных пародонтопротекторов, а также оценка влияния ФД на его состав.
Материал и методы
Для достижения цели исследования мы выбрали метод молекулярного анализа ДНК: ПЦР-диагностику в реальном времени (ПЦР-РВ), позволяющий, по нашему мнению, на сегодняшний день наиболее корректно сравнивать численность бактерий, составляющих микробиоценоз пародонта.
Научная работа проведена с использованием оборудования Центра коллективного пользования научным оборудованием «Генетический полиморфизм» при Институте общей генетики им. Н.И. Вавилова РАН при участии А.В Шибаевой (Институт биохимической физики им. Н.М. Эмануэля), которой совместно с О.А. Зориной и др. на основании методов молекулярного анализа ДНК удалось идентифицировать виды микроорганизмов, превалирующих на пародонте здоровых людей: Veillonella parvula и Streptococcus sanguinis [15]. Эти микроорганизмы было предложено рассматривать в качестве кандидатных пародонтопротекторов. Для их детекции мы использовали диагностические системы на основе ПЦР-РВ. В ходе выполнения работы была впервые проведена валидация оригинальных тест-систем на основе ПЦР-РВ формата Taqman для количественного анализа V. parvula и S. sanguinis, подтверждена их специфичность в отношении целевых видов бактерий при анализе содержимого пародонтальных карманов (Патент 2619172 РФ, Патент 2621858 РФ), а также способа оценки обсемененности пародонта патогенными бактериями с применением ПЦР-РВ (Патент 2607046 РФ) [16–19].
В исследование вошли пациенты, проходившие клинико-диагностическое обследование и санацию в отделении пародонтологии кафедры пародонтологии МГМСУ им. А.И. Евдокимова с 2011 по 2017 г.
Выборка включала 155 пациентов (возрастной контингент от 17 до 70 лет). Контрольная группа (1) состояла из здоровых лиц без патологии пародонта и без ФД – 40 человек, средний возраст которых не превышал 28,7 года. Группа 2 состояла из 40 пациентов без заболеваний пародонта с диагнозом ФД (средний возраст не превышал 26,5 года). Группу 3 (40 пациентов) составили пациенты с диагнозом «хронический пародонтит» (ХП), но без ФД (средний возраст пациентов не превышал 43,7 года). Группа 4 состояла из пациентов, у которых ХГП сочетался с ФД (35 пациентов), средний возраст не превышал 41,4 года.
В исследовании участвовали 62 мужчины и 93 женщины. Число женщин в группе 1 составило 24, в группе 2 – 28, в группе 3– 21, в группе 4 – 20; у мужчин группа 1 включала 16 человек, группа 2 – 12, группа 3 – 19, группа 4– 15 пациентов.
Возрастные особенности групп, по нашему мнению, могут быть объяснены особенностями течения каждой из исследуемых патологий (ХП чаще ассоциирован с возрастными изменениями в тканях пародонта лиц старше 35 лет, в то время как ФД часто диагностируется у пациентов молодого возраста.
Для выполнения микробиологического исследования осуществляли забор содержимого наиболее глубоких участков пародонтальных карманов с помощью стерильных бумажных эндодонтических штифтов, которые затем помещали в пробирку с реактивом «Проба-Рапид» (ООО «НПО ДНК-Технология», Россия) объемом 0,5 мл и транспортировали в лабораторию в охлажденном состоянии в течение 6 часов. Забор биологического материала (проб) у каждого пациента проведен в две пробирки, на стадии выделения ДНК и проведения ПЦР содержимое каждой пробирки анализировали отдельно.
Суммарную ДНК микробов пародонтального смыва пациентов выделяли при помощи набора реагентов «Проба-ГС» (ООО «НПО ДНК-Технология», Россия) в соответствии с инструкцией к набору реагентов. Препарат ДНК, соответствовавший 1/10 объема одного смыва (50 мкл), растворяли в 50 мкл элюирующего раствора. В качестве матрицы для проведения одной ПЦР-реакции использовали 5 мкл полученного препарата.
Результаты ПЦР-РВ регистрировали с определением значения порогового цикла (Ct). С целью нормировки сигнала (учета разброса в количестве взятого биоматериала и эффективности экстракции ДНК) для каждого образца определяли величину относительного Ct (∆Сt). Для этого из величины «абсолютного Ct» для специфического набора праймеров и зонда, усредненного по двум образцам одной серии, вычитали усредненную величину Ct общей бактериальной массы для тех же двух образцов серии. Статистической обработке подвергали данные, выраженные в форме ∆Сt. Диагностическая система для детекции человеческой ДНК сокращенно обозначалась КВМ – контроль взятия материала. Этот показатель отражал содержание на пародонте геномной ДНК человека.
Статистическую обработку данных проводили с помощью пакета Statistica 8.0 для Windows по стандартным методикам вариационной статистики для непараметрических данных.
Результаты исследования
Результаты бактериальной оценки микробиома пародонта у всех обследуемых лиц представлены в табл. 1–6. По данным исследования, у пациентов групп 3 и 4 (т.е. у пациентов с ХГП) выявлялась обсемененность патогенными в отношении пародонта бактериями в показателях выше порогового уровня (табл. 1).
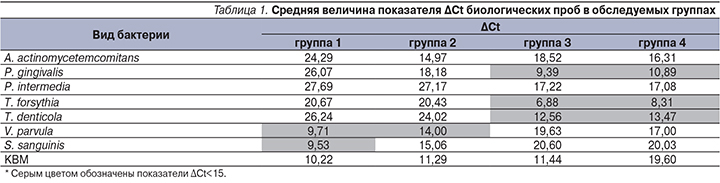
Медианные величины значений средних показателей обсемененности пародонтопатогенами биологического материала представлены в табл. 2. Полученные значения свидетельствуют о том, что обсемененность патогенами пародонта пациентов группы 3 (только ХГП) несколько превышает аналогичные показатели пациентов группы 4 (сочетание ХГП+ФД). Обратная ситуация наблюдается в отношении пародонтопротекторов V. parvula и S. sanguinis при сравнении пациентов с пародонтитом и здоровых в отношении пародонта лиц. Анализируя показатели КВМ, следует отметить, что и у пациентов с ХГП+ФД отмечается уменьшение количества ДНК человека в биологическом материале – 18, 10 цикла.

Анализ ∆Сt биологических проб лиц контрольной группы и пациентов групп 2–4 свидетельствует о том, что для пациентов с ХП характерны некоторые микробиологические особенности по сравнению с контрольной группой (табл. 3). Значимые различия в показателях ∆Сt характерны для бактерий P. gingivalis, T. forsythia, T. denticola, P. intermedia, S. sanguinis, V. parvula. Различия при сравнении групп 3 и 4 по показателю обсемененности A. actinomy-cetemco-mitans достоверно менее выражены.
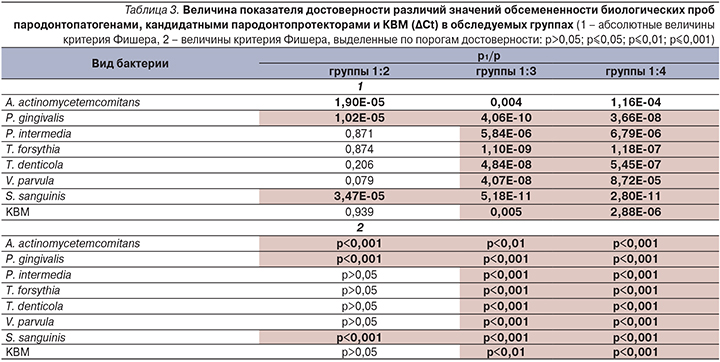
По результатам оценки показателей КВМ следует отметить достоверные различия, при сопоставлении показателей групп 1, 3 и особенно группы 4.
При анализе данных групп 1 и 2 значимые различия отмечены для бактерий A. actinomycetemcomitans, P. gingivalis, а также S. sanguinis.
Далее выборки пациенты были разделены по гендерному признаку. Показатели мужчин и женщин оценивались по аналогичному принципу, что и ранее, а именно: средние показатели контрольной группы соотносились со средними значениями остальных трех групп (табл. 4 и 5).
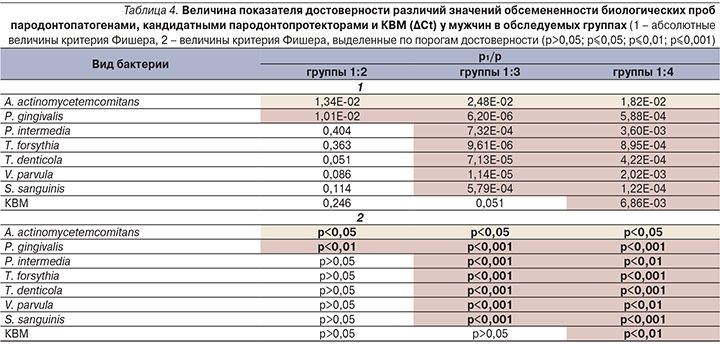
Результаты, полученные при сравнении показателей мужчин и женщин контрольной группы и групп 2–4 могут свидетельствовать о возможном взаимном влиянии пародонтопатогенов, кандидатных пародонтопротекторов и бактерий микробиоценоза кишечника. Другим интересным выводом является вероятность того, что сочетание патологии ЖКТ с воспалительной патологией пародонта приводит к утяжелению течения последней.

Мы посчитали логичным сравнить показатели обсемененности биологического материала пациентов с пародонтитом и пациентов с сочетанной патологией пародонта и ФД (группы 3 и 4). Результат сравнения представлен в табл. 6.
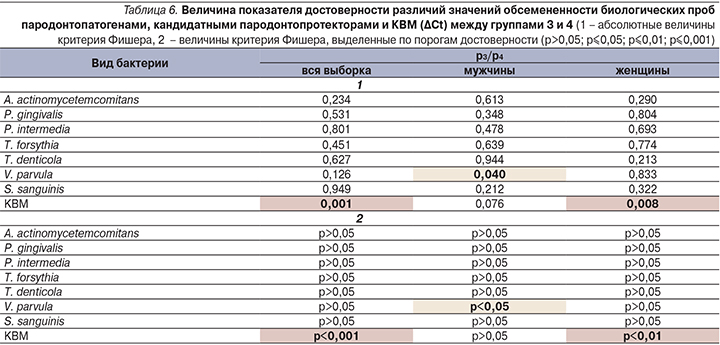
Достоверные значения различий ∆Сt биологических проб между группой пациентов с ХП и пациентов, у которых ХП сочетался с ФД, выявлены нами исключительно для кандидатного пародонтопротектора V. parvula. Различие в содержании V. parvula на пародонте мужчин группы 4 более выражены, чем в группе 3, тем не менее они находятся на грани достоверности, что ограничивает диапазон их использования для вынесения дальнейших значимых выводов. Интересные данные получены при сопоставлении значений групп 3 и 4 по показателю КВМ как в целом, так и в женской группе, что говорит о значимом увеличении содержания геномной ДНК человека на пародонтальных тканях пациентов, у которых пародонтит сочетается с диспепсическим синдромом.
Заключение
Анализируя результаты исследования, следует отметить, что в комплекс дополнительных методов обследования больных ФД следует включать исследование полости рта и микрофлоры пародонтальных карманов с помощью методов молекулярной диагностики, т.к. постоянное присутствие пародонтопатогенов в тканях пародонта может значительно усугублять качество жизни пациентов с сочетанной патологией. Количественная оценка микроорганизмов, населяющих пародонт, с помощью ПЦР-РВ позволяет представить обобщенный параметр соотношения количества патогенов к кандидатным протекторам тканей пародонта в качестве одного из критериев эффективности санации.



