Системный артрит у детей является вариантом ювенильного (юношеского) идиопатического артрита (ЮИА), при котором наряду с собственно артритом развиваются различные внесуставные проявления, такие как фебрильная лихорадка, кожные высыпания, спленомегалия, гепатомегалия, лимфаденопатия, миоперикардит, пневмонит, полисерозит и др. [1]. Сложности терапии системного ЮИА (сЮИА) во многом связаны с тем, что до настоящего времени неполностью расшифрован патогенез заболевания. Считают, что в его основе лежат нарушения клеточного и гуморального звеньев иммунитета: активация макрофагов, цитокинов, таких как интерлейкин-1 (ИЛ-1), ИЛ-6 и ИЛ-18 [2–4]. Исходя из этого определен комплексный подход к лечению, который ставит целью достижение управляемого течения сЮИА на основе одновременного использования нескольких лекарственных препаратов, действующих на разные звенья патогенеза заболевания [5, 6]. Наиболее часто назначают нестероидные противовоспалительные препараты (НПВП), глюкокортикоcтероиды (ГКС) и иммунодепрессанты. Однако почти у 50 % пациентов традиционно применяемая лекарственная терапия не контролирует течение заболевания, не предотвращает прогрессирование костно-хрящевой деструкции, а в ряде случаев приводит к развитию тяжелых, иногда необратимых последствий (например, низкорослость, задержка полового развития, надпочечниковая недостаточность, остеопороз при длительном применении ГКС) [1].
Доказанная роль ИЛ-6, одного из основных провоспалительных цитокинов, в патогенезе сЮИА стала обоснованием применения при этом заболевании ингибитора рецепторов ИЛ-6. В ряде клинических исследований был изучен тоцилизумаб (Актемра) – гуманизированное моноклональное антитело к рецепторам ИЛ-6 [7]. Положительные результаты, показавшие устойчивое клиническое улучшение и безопасность терапии тоцилизумабом у детей с сЮИА в возрасте 2 лет и старше, стали основанием для регистрации этого препарата для лечения сЮИА. В России тоцилизумаб включен в стандарты первичной медико-санитарной и специализированной медицинской помощи детям при юношеском артрите с системным началом [8], а также в клинические рекомендации Союза педиатров России по ведению детей с юношеским артритом с системным началом [9].
С учетом эффективности тоцилизумаба логично предположить, что его применение не только изменяет течение и исходы заболевания, но потенциально способно снизить прямые и косвенные финансовые затраты, связанные с ведением пациентов, страдающих сЮИА.
В связи с этим следует отметить, что за последнее время интерес к фармакоэкономической оценке социально-экономического бремени сЮИА чрезвычайно высок как в мире, так и в России. В частности, в российском исследовании [10] выявлены значительные финансовые затраты системы здравоохранения на ведение пациентов с ЮИА, складывающиеся из расходов на фармакотерапию, стационарное лечение и т.д. Еще более существенными оказываются косвенные расходы, связанные с ЮИА, которые определяются экономическим ущербом для общества от снижения трудоспособности родителей больных детей, а также от различных социальных выплат. При этом в абсолютном выражении косвенные расходы в несколько раз превышают прямые затраты. Важной составляющей также являются т.н. нематериальные, или неосязаемые, затраты, обусловленные потерями пациента как личности и члена общества. К сожалению, провести стоимостную оценку этих нематериальных затрат на сегодняшний день не представляется возможным [11].
Подчеркнем, что сЮИА [М08.2] входит в Перечень жизнеугрожающих и хронических прогрессирующих редких (орфанных) заболеваний, приводящих к сокращению продолжительности жизни граждан или их инвалидности [12].

Отсюда становится понятной необходимость проведения фармакоэкономической оценки применения тоцилизумаба у российских детей с сЮИА, а также определение возможного социально-экономического эффекта от внедрения данного лекарственного препарата в широкую клиническую практику, что и стало целью настоящего исследования.
Методы
На подготовительном этапе исследования проведен информационный поиск в библиографических базах данных PubMed (MedLine), Cochrane, ISPOR, «Российская Медицина», национальном регистре клинических исследований США ClinicalTrials.gov, архивах ежегодных встреч, проводимых Американской коллегией ревматологов и Европейской антиревматической лигой, а также в электронных банках документов Министерства здравоохранения РФ, Министерства труда и социальной защиты. Проанализированы международные и отечественные клинические рекомендации, результаты клинических исследований по оценке эффективности и безопасности терапии сЮИА, а также изучена нормативно-правовая база по вопросам оказания медицинской помощи детям с ЮИА в РФ и их социального обеспечения.
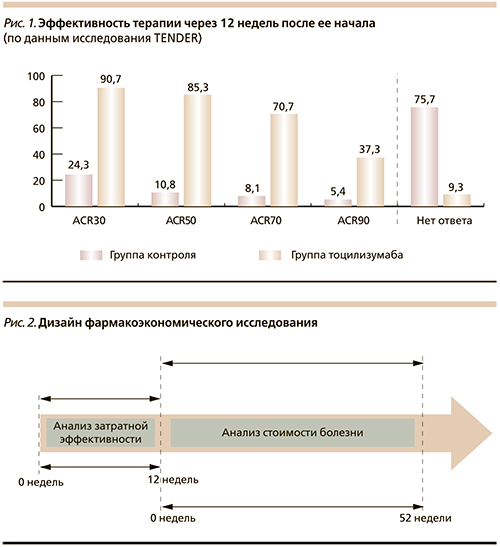
Из первично отобранных публикаций результатов клинических исследований тоцилизумаба в терапии сЮИА для целей настоящей работы было выделено рандомизированное многоцентровое двойное слепое плацебо-контролируемое клиническое исследование TENDER [13], включавшее две фазы. Дизайн первой фазы исследования (рандомизированное двойное слепое плацебо-контролируемое в двух параллельных группах) предусматривал сравнительное изучение эффективности и безопасности 12-недельной терапии тоцилизумабом в комбинации с метотрексатом (MT), ГКС и НПВП по сравнению с традиционно применяемой терапией (MT, ГКС, НПВП). На момент начала терапии все дети имели активный сЮИА длительностью 6 месяцев и более и неадекватный ответ на терапию НПВП и ГКС. Через 12 недель после начала терапии у 85 % пациентов в группе тоцилизумаба по сравнению с 24 % в контрольной группе был достигнут ответ по критериям ACR30 и купирована лихорадка (p < 0,001). Следует подчеркнуть, что значимое клиническое улучшение наблюдалось у большинства пациентов уже после первой инфузии тоцилизумаба – две трети детей имели ответ ACR30 на второй неделе исследования. При этом 54 % пациентов контрольной группы удовлетворяли критериям не ответивших на терапию в двойной слепой фазе исследования, тогда как в группе тоцилизумаба доля больных, не ответивших на лечение, составила 1 %. По завершении первой фазы исследования все пациенты контрольной группы были переведены на терапию тоцилизумабом (открытая фаза). При оценке эффективности терапии через 52 недели было показано, что 59 % детей имели ответ ACR90 при отсутствии лихорадки, у 48 % приостановлен активный воспалительный процесс в суставах, а у 52 % отменена терапия ГКС. Следует отметить, что во время двойной слепой фазы исследования частота развития инфекционных осложнений составила 3,4 и 2,9 случаев на 100 пациенто-лет в группах тоцилизумаба и контроля соответственно.
В открытой фазе исследования частота инфекционных осложнений составила 3 на 100 пациенто-лет.
На основании данных исследования TENDER нами была разработана фармакоэкономическая модель оценки целесообразности введения тоцилизумаба в традиционные схемы терапии сЮИА (НПВП, ГКС и иммунодепрессанты) с определением коэффициента «затраты–эффективность».
В модели рассматривали две равные по числу (по 100 человек в каждой) группы пациентов с сЮИА, рефрактерных к терапии НПВП и ГКС. Эти условные группы были сопоставимыми по клиническим, демографическим и иным характеристикам. Средняя масса тела пациента в условиях модели составила 30 кг. Принимали, что в обеих группах назначили терапию МТ 70 % пациентов, преднизолоном – 90 %. Средняя доза МТ на 1 подкожное введение составила 10 мг (из расчета 9,4 мг/м2) 1 раз в неделю; средняя суточная доза преднизолона для перорального приема – 9 мг (из расчета 0,3 мг/кг). Пациенты второй группы дополнительно получали терапию тоцилизумабом в дозе 8 мг/кг (240 мг на введение), препарат вводили внутривенно 1 раз в 2 недели. При выборе режима дозирования руководствовались данными исследования TENDER, а также инструкциями по медицинскому применению препаратов МТ, преднизолон и Актемра.
В условиях модели принимали, что лекарственную терапию первоначально проводили в стационаре (4 недели). По завершении стационарного этапа лечения пациенты продолжали получать назначенный курс в амбулаторно-поликлинических условиях в течение 8 недель. Таким образом, общий временной горизонт модели оценки затратной эффективности терапии составил 12 недель (рис. 2).

На основании данных исследования TENDER об эффективности терапии (рис. 1) и определенных в модели затратах на нее, рассчитан показатель затратной эффективности сравниваемых стратегий.
На следующем этапе исследования анализировалась стоимость болезни с моделированием прямых медицинских затрат на рутинное ведение пациентов с сЮИА, а также косвенных затрат, которые несет государство в связи с оплатой листов временной нетрудоспособности (ВН), выплатой пенсий и пособий, а также упущенного вклада в ВВП. Временной горизонт модели на данном этапе исследования составил 1 год (52 недели; рис. 2). При построении модели оценки стоимости болезни исходили из допущения о том, что терапевтический эффект, отмеченный на 12-й неделе у пациентов, получавших традиционную терапию, сохраняется до года. Данное допущение основано на том, что включенные в исследование TENDER пациенты получали иммуносупрессивную терапию в течение длительного периода до начала исследования и это позволяет с большой долей вероятности считать достигнутый к 12-й неделе ответ максимально возможным для данных больных или близким к таковому при назначении традиционной терапии. Правомерность такого допущения подкреплена и результатами ряда других клинических исследований [1, 14, 15]. В группе тоцилизумаба на основании данных об эффективности терапии в открытой расширенной фазе исследования TENDER рассчитан средний уровень ответа по критериям ACR30, 50, 70, 90. В разработанной модели не учитывалась возможность перехода пациентов из группы традиционной терапии в случае ее неэффективности на терапию генно-инженерным биологическим препаратом (тоцилизумаб), однако допускали отмену тоцилизумаба при развитии тяжелых побочных явлений. Расчет прямых медицинских затрат включал затраты на фармакотерапию, амбулаторно-поликлиническую и стационарную медицинскую помощь.
Затраты на фармакотерапию
При расчете затрат на фармакотерапию учитывали зарегистрированные предельные отпускные цены производителя на препараты Методжект (раствор для инъекций 10 мг/мл, Медак ГмбХ), Преднизолон (таблетки 5 мг, Мосхимфармпрепараты им. Н.А. Семашко) и Актемра (концентрат для приготовления раствора для инфузий 20 мг/мл, Ф. Хоффманн-Ля Рош Лтд.) по состоянию на 1 августа 2013 г. (табл. 1). Выбор лекарственного препарата МТ, вводимого инъекционно (Методжект), обусловлен наличием показаний к его применению – полиартрит у пациентов с тяжелым ювенильным хроническим артритом в активной форме. Другие формы препарата метотрексат не зарегистрированы для применения у пациентов с ЮИА.

В соответствии с утвержденным МЗ РФ порядком оказания медицинской помощи детям по профилю «ревматология» считали, что подкожное введение метотрексата осуществляется под наблюдением специалиста в кабинете врача-ревматолога, а внутривенное введение тоцилизумаба – в дневном стационаре. При этом учитывали установленные территориальной программой государственных гарантий (ТПГГ) в Москве нормативы финансовых затрат на оказание медицинской помощи детям по профилю «ревматология».
Затраты на стационарное лечение включали плановые госпитализации, внеплановые госпитализации по поводу обострений заболевания и тяжелых осложнений проводимой терапии (табл. 2, 3). Принимали, что плановое обследование больных в стационарных условиях проводят дважды в год (в соответствии с протоколом ведения пациентов с сЮИА). Вероятность развития обострений заболевания при назначении традиционной терапии и терапии тоцилизумабом, а также частоту развития тяжелых осложнений противоревматической терапии считали равной приведенным в исследовании TENDER.

При расчете затрат на стационарное лечение принимали, что средняя продолжительность госпитализации составляет 28 дней, стоимость 1 койко-дня в детском ревматологическом отделении рассчитывали исходя из норматива финансовых затрат, установленного территориальной программой государственных гарантий оказания гражданам РФ бесплатной медицинской помощи в Москве на 2013 г.
Расчет косвенных затрат
В анализ косвенных затрат включены затраты государства, связанные с выплатами социальных пенсий и пособий по уходу, оплатой больничных листов (б/л), а также потери, обусловленные недопроизводством ВВП.
В условиях разработанной модели исходили из предположения, что все дети имеют статус ребенка-инвалида и право на получение социальной пенсии. Также предполагали, что в связи с необходимостью ухода за тяжелобольным ребенком, не достигшим клинически значимого улучшения (ответ по критерию ACR30), один из родителей оставляет работу, а родители остальных пациентов оформляют б/л, частота оформления и продолжительность которого, в рамках построенной модели, определяются уровнем ответа: при ACR30 – б/л на 120 дней (4 б/л по 30 дней), при ACR90 – 0 дней (т.е. без б/л; табл. 3). При этом считали, что все родители находятся в трудоспособном возрасте, а страховой стаж составляет более 8 лет. Допущение модели подтверждается данными российских исследователей [10]. При проведении расчетов руководствовались действующим законодательством в области социального обеспечения граждан в Москве.
Затраты на выплату пенсий
Право детей-инвалидов на получение социальной пенсии закреплено Федеральным законом № 166-ФЗ от 15.12.2001 «О государственном пенсионном обеспечении в Российской Федерации». Размер социальной пенсии в 2013 г. составил 8 861,54 руб. Постановлением Правительства Москвы № 514-ПП от 01.11.2011 «Об установлении размеров отдельных социальных выплат некоторым категориям граждан на 2012 и 2013 гг.» определен городской социальный стандарт пенсии (12 тыс. руб.), до которого производится региональная доплата (табл. 4).
Затраты на ежемесячные выплаты по уходу
Порядок установления ежемесячной выплаты неработающим трудоспособным лицам, осуществляющим уход за детьми-инвалидами в возрасте до 18 лет, регулируется указом Президента Российской Федерации № 175 от 26.02.2013 «О ежемесячных выплатах лицам, осуществляющим уход за детьми-инвалидами и инвалидами с детства I группы» и постановлением Правительства Российской Федерации № 397 от 02.05.2013 «Об осуществлении ежемесячных выплат неработающим трудоспособным лицам, осуществляющим уход за детьми-инвалидами в возрасте до 18 лет или инвалидами с детства I группы». Размер ежемесячной выплаты родителям по уходу за ребенком-инвалидом составляет 5500 руб. Вместе с тем учитывали, что в Москве родители детей-инвалидов имеют право на получение дополнительной ежемесячной компенсационной выплаты, что закреплено постановлением Правительства Москвы от 15.05.2007 № 351-ПП «О дополнительных мерах социальной поддержки отдельных категорий родителей, опекунов (попечителей), занятых уходом за ребенком-инвалидом или инвалидом с детства в возрасте до 23 лет». Размер ежемесячной компенсационной выплаты определен постановлением Правительства Москвы № 514-ПП от 01.11.2011 «Об установлении размеров отдельных социальных выплат некоторым категориям граждан на 2012 и 2013 гг.» и составляет 6000 руб. (табл. 4).
Затраты на оплату листов временной нетрудоспособности
В соответствии с Федеральным законом № 255-ФЗ от 29.12.2006 «Об обязательном социальном страховании на случай временной нетрудоспособности и в связи с материнством» пособие по ВН одного из родителей в связи с уходом за больным ребенком-инвалидом в возрасте до 15 лет выплачивается за счет средств бюджета Фонда социального страхования Российской Федерации за весь период амбулаторного лечения или совместного пребывания с ребенком в стационарном лечебно-профилактическом учреждении с 1-го дня ВН, но не более чем за 120 календарных дней в календарном году. Размер пособия по ВН исчисляется путем умножения размера дневного пособия на число календарных дней, приходящихся на период временной нетрудоспособности по формулам:
Размер пособия по ВН = Размер дневного пособия по ВН × Продолжительность ВН.
Размер дневного пособия по ВН = Средний дневной заработок × Поправочный коэффициент.
При этом поправочный коэффициент при амбулаторном лечении ребенка за первые 10 календарных дней определяется в зависимости от продолжительности страхового стажа родителя (в условиях модели – более 8 лет, поправочный коэффициент – 100 %), в последующие дни составляет 50 %. Средний дневной заработок рассчитывается по формуле:
Заработок застрахованного лица за два календарных года, предшествующих году наступления ВН/730 дней.
Принимая во внимание вышеизложенную методику расчета размера пособия по ВН, в условиях модели средний дневной заработок рассчитан исходя из среднегодовой заработной платы в Москве в 2012 г. (ФСГС).
Недопроизводство ВВП
Упущенный вклад в производство валового внутреннего продукта (табл. 5, 6), обусловленный ВН родителей, а в ряде случаев и неизбежностью увольнения в связи с необходимостью ухода за тяжелобольным ребенком, рассчитан по методу «фрикционных затрат». Данный метод предполагает учет потерь ВВП только до тех пор, пока нарушенная производительность труда не будет восстановлена: трудовые обязанности временно нетрудоспособного работника перераспределены между другими сотрудниками, а уволившемуся работнику найдена замена. С этой целью рассчитанные за весь период отсутствия на рабочем месте потери ВВП умножаются на коэффициент «фрикционных затрат». В условиях разработанной модели коэффициент «фрикционных затрат» составил 1/10. Формула расчета недопроизводства ВВП следующая: Дневной ВВП на 1 занятого в экономике × Продолжительность периода нетрудоспособности × 1/10.
Анализ чувствительности
Поскольку настоящее исследование выполнено методом моделирования с использованием ряда допущений, с целью оценки достоверности результатов, а также их чувствительности к изменениям исходных параметров в рамках анализа чувствительности определена затратная эффективность сравниваемых медицинских технологий с учетом социально-экономических условий РФ.

Анализ «затраты–эффективность»
Показатель «затраты–эффективность» (cost-effectiveness ratio, CER) рассчитан по формуле:
CER = C/Ef, где С – стоимость фармакотерапии (в руб.); Ef – эффективность терапии.
Результаты
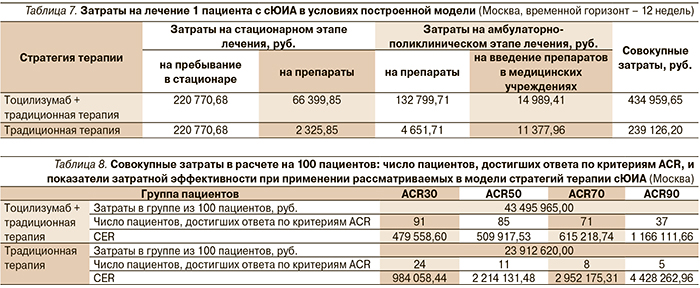
На первом этапе нашего исследования при рассмотрении затрат на стационарном этапе (4 недели) расходы системы здравоохранения составили 223 096,53 и 287 170,53 руб. на 1 пациента в группе традиционной терапии и группе тоцилизумаба соответственно. Сравнение затрат на амбулаторно-поликлиническое лечение (8 недель) детей с сЮИА в рассматриваемых группах показывает, что расходы на 1 пациента при применении тоцилизумаба составляют 147 789,12 руб., без его применения – 16 029,67 руб. Совокупные медицинские затраты в группе традиционной терапии достигают 239 126,20 руб., в группе тоцилизумаба – 434 959,65 руб. на 1 пациента. Абсолютная разница в затратах составляет 195 833,45 руб. на 1 пациента (табл. 7).
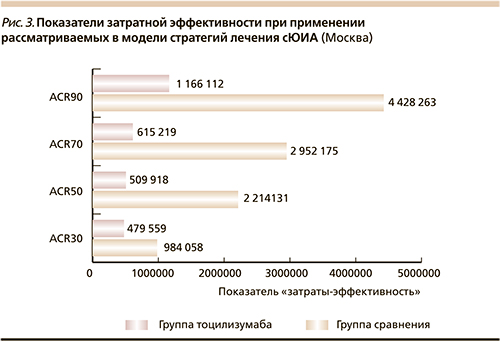
Исходя из полученных данных и эффективности анализируемых стратегий терапии, были рассчитаны и сопоставлены показатели «затраты–эффективность» (CER). Показатель CER по частоте достижения ответа ACR90 для группы традиционной терапии через 12 недель составил 4 428 262,96 руб. на 1 пациента, а для группы тоцилизумаба – 1 166 111,66 руб. Затратная эффективность сравниваемых технологий в расчете на 1 пациента, достигшего ответа ACR70, составила 2 952 175,31 и 615 218,74 руб. соответственно. Наряду с этим в группе тоцилизумаба также наблюдаются меньшие значения CER по показателям ACR50 и ACR30 (табл. 8, рис. 3). Таким образом, затратная эффективность тоцилизумаба в условиях построенной модели всегда более предпочтительна по сравнению с группой традиционной терапии.
На втором этапе моделировали прямые медицинские и косвенные затраты при продолжительности лечения 1 год. Исходя из принятых в модели вероятностей, в группе традиционного ведения пациентов с сЮИА медицинские затраты составляют 1 372 972,19 руб. на 1 пациента, при назначении тоцилизумаба – 1 404 520,63 руб. на 1 пациента (табл. 9). При анализе структуры прямых финансовых расходов выявлено, что в группе тоцилизумаба более 50 % затрат приходятся на фармакотерапию. Обращает на себя внимание, что затраты на внеплановые госпитализации в группе традиционного ведения пациентов более чем в 12 раз превосходят таковые в группе Актемры.
Финансовые потери бюджета в социальной сфере составляют 426 144,63 руб. на 1 пациента в группе традиционного ведения, 226 729,10 руб. – в группе тоцилизумаба (рис. 4).
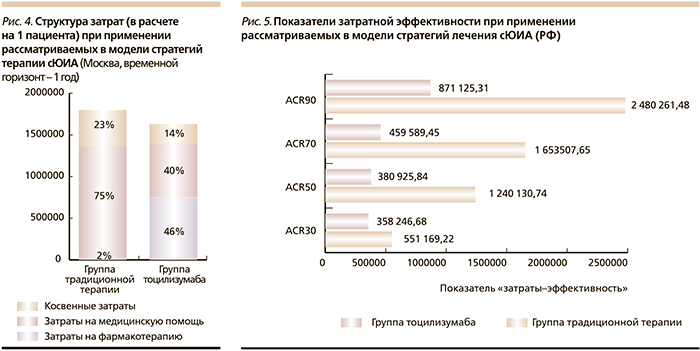
Выполненный в рамках анализа чувствительности анализ на примере РФ показывает, что существенное влияние на результаты моделирования оказывают установленные в регионе нормативы финансовых затрат на оказание гражданам бесплатной медицинской помощи, размеры социальных выплат, а также общий уровень благосостояния общества. Определено, что на примере РФ стратегия терапии cЮИА, предусматривающая назначение тоцилизумаба, также целесообразна, что отражается предпочтительными показателями затратной эффективности (рис. 5)
Выводы
Сравнительный фармакоэкономический анализ традиционной стратегии (НПВП, ГКС и иммунодепрессанты) лечения сЮИА у пациентов детского возраста и стратегии терапии, предусматривающей назначение тоцилизумаба, выявляет наибольшую экономическую целесообразность применения тоцилизумаба. Несмотря на то, что с учетом 12-недельного временного горизонта суммарные затраты на эту стратегию оказались в 1,8 раза выше по сравнению с тактикой традиционного ведения пациентов, показатели затратной эффективности при применении препарата тоцилизумаб всегда более предпочтительны. Так, затратная эффективность на 1 пациента, достигшего ответа по критериям ACR90 и ACR70, для Актемры в 3,8 и 4,8 раза соответственно ниже по сравнению с тактикой традиционного ведения пациентов. То же можно наблюдать в отношении затратной эффективности тоцилизумаба по показателям ACR50 и ACR30. Это связано главным образом с высокой эффективностью терапии тоцилизумабом и низкой эффективностью лечения при традиционном ведении пациентов.
При моделировании затрат в сравниваемых группах пациентов на 1 год определено, что затраты на госпитализацию по поводу обострений сЮИА в группе пациентов, получавших МТ и преднизолон, в 12,7 раза превосходили таковые в группе тоцилизумаба. Следует отметить, что основную долю затрат (50 %) в группе тоцилизумаба составляли затраты на фармакотерапию (прямые затраты).
С точки зрения государства, применяемая стратегия лечения должна быть направлена в т.ч. и на снижение экономических потерь из-за пропусков работы, снижения затрат на выплату пенсий по инвалидности и т.д. Так, косвенные затраты в группе Актемры ниже таковых в группе сравнения. При анализе структуры непрямых затрат обращает на себя внимание различие в средних расходах государства на выплату пособий по уходу за ребенком-инвалидом: в группе Актемры они составляют 17 984,85 руб. в расчете на 1 пациента, а в группе сравнения – 104 466,00 руб., т.е. выше в 5,8 раз. То же наблюдается и при анализе показателя недопроизводства ВВП (154 253,55 руб. в группе контроля и 39 630,70 руб. в группе тоцилизумаба). Это связано в первую очередь с высокой клинической эффективностью Актемры в лечении сЮИА, снижением частоты обострений заболевания и, соответственно, снижением необходимости ухода родителей за ребенком-инвалидом.При этом результаты последних клинических исследований позволяют утверждать, что в последующие годы различия в затратах между группами будут расти.
Снижение потребности в назначении ГКС, а зачастую и полная их отмена, восстановление нормальных темпов физического развития детей, существенное замедление как деструктивных процессов в суставах, так и системного поражения внутренних органов при применении тоцилизумаба приведут к снижению как прямых, так и косвенных затрат. Наряду с этим низкоэффективная в купировании системных проявлений заболевания и предотвращении эрозивных процессов в суставах терапия иммунодепрессантами и ГКС за счет тяжелой инвалидизации пациентов, безусловно, будет требовать всевозрастающих затрат.
Проведенный фармакоэкономический анализ демонстрирует клинико-экономическую целесообразность стратегии лечения сЮИА препаратом Актемра, характеризующуюся как более предпочтительными показателями затратной эффективности, так и снижением социально-экономического бремени болезни.



