Введение
Рак поджелудочной железы является четвертой по значимости причиной смерти от солидных злокачественных новообразований в РФ, на его долю приходится 7% всех случаев смерти от рака. Во всем мире рак поджелудочной железы занимает 13-е место по частоте и 8-е – как причина смерти. В большинстве стран заболеваемость составляет 8–12 случаев на 100 тыс. человек в год. Средний риск развития рака поджелудочной железы в течение жизни составляет 1 на 67. Прирост показателей смертности от рака поджелудочной железы среди мужчин за 10 лет составил 5,6%, среди женщин – 7,61%. Ранняя диагностика рака представляется трудной, а зачастую невыполнимой задачей. На момент установления диагноза у 52% пациентов, как правило, имеются отдаленные метастазы, у 26% – вовлечены регионарные лимфатические узлы [1].
В случае неоперабельного местнораспространенного и метастатического процесса при раке поджелудочной железы основным методом лечения является противоопухолевая лекарственная терапия. Выбор режима ХТ при метастатическом РПЖ определяется в первую очередь состоянием пациента, при этом спектр цитостатиков, эффективных при РПЖ, весьма ограничен [2].
В настоящее время комбинация гемцитабина и nab-паклитаксела является одним из наиболее популярных среди специалистов режимов лечения метастатического рака поджелудочной железы благодаря сочетанию высокой эффективности с умеренной токсичностью [3].
Nab-паклитаксел представляет собой нанодисперсный паклитаксел, стабилизированный альбумином. Данная структура существенно меняет свойства паклитаксела, которому альбумин обеспечивает доставку и накопление в опухолевой ткани [4, 5].
В крупном рандомизированном исследовании III фазы MPACT по сравнению эффективности сочетания наб-паклитаксела и гемцитабина и гемцитабина в монорежиме при метастатическом РПЖ было продемонстрировано сатистически значимое улучшение общей выживаемости в группе комбинированного лечения и составило 8,7 против 6,6 месяца в группе гемцитабина, значительное увеличение частоты объективных эффектов – с 7% в группе монотерапии до 23% в группе комбинированного лечения [6], что примерно соответствует частоте объективных эффектов при применении режима FOLFIRINOX в исследовании PRODIGE 4/ACCORD 11, считающегося наиболее эффективным, но при этом и наиболее токсичным [7] В исследовании MPACT значительная когорта пациентов была преимущественно представлена пациентами Восточной Европы. Проведенный под-анализ результатов исследования с выделением только пациентов Восточной Европы показал, что польза от добавления к гемцитабину nab-паклитаксела у них существенно меньше, чем у других когорт пациентов России [8]. Возможными причинами этого могут быть более высокая токсичность комбинированной химиотерапии, приводящая к редукции доз препаратов, а также менее благоприятное исходное состояние пациентов, которое не позволило добиться реализации эффекта несколько более токсичного лечения.
По данным российского ретроспективного исследования эффективности и токсичности, комбинация наб-паклитаксела с гемцитабином продемонстрировала достаточно высокую эфективность: объективный ответ зарегистрирован в 34 (25,4%) случаях, медиана времени без прогрессирования составила 6,1 месяца, медиана продолжительности жизни – 14,2 [9].
Цель исследования: оценка эффективности и безопасности комбинации гемцитабина и наб-паклитаксела для больных местнораспространенным и генерализованным раком поджелудочной железы.
Методы
Проанализированы данные о 23 пациентах, получавших лечение наб-паклитакселом и гемцитабином по поводу местнораспространенного и генерализованного рака поджелудочной железы в нашем учреждении в 2018–2020 гг. Критериями отбора для терапии были: возраст пациентов 18 лет и старше, функциональный статус по шкале ECOG ≤2, патоморфологическое подтверждение диагноза, наличие измеримых очагов опухоли по критериям RECIST. Допускалась предшествовавшая терапия противоопухолевыми препаратами, а также лучевая терапия и хирургическое вмешательство. Обязательным критерием было подписанное информированное согласие на лечение.
Наб-паклитаксел вводили внутривенно капельно в дозе 125 мг/м2, гемцитабин – в дозе 1000 мг/м2 в 1-й, 8 и 15-й дни 28-дневного цикла. До лечения и каждые 2 месяца от начала лечения больным выполнялось комплексное обследование, в т.ч. спиральная компьютерная или магнитно-резонансная томография, для оценки распространенности опухоли и оценки эффективности лечения. Оценивались непосредственный противоопухолевый эффект по критериям RECIST, время до прогрессирования заболевания, общая выживаемость, нежелательные явления на фоне противоопухолевой терапии.
Статистическая обработка данных осуществлялась с помощью программ статистического пакета SPSS (IBM SPPS Statistics v. 20). Для оценки показателей динамической выживаемости использовали метод Каплана–Майера.
Результаты
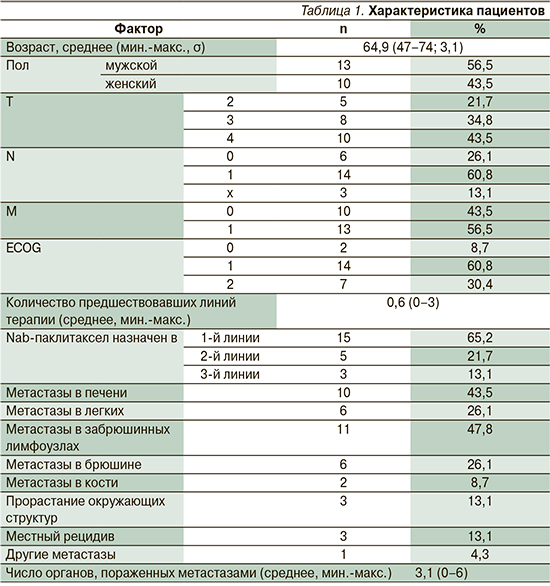
В анализируемую группу вошли 23 пациента в возрасте от 47 до 74 лет, средний возраст составил 64.9 лет, 13 (56,5%) мужчин, 10 (43,5%) женщин.
У 2 (8,7%) пациентов диагностирован первичный местнораспространенный неоперабельный процесс, у 16 (69,7%) – исходно метастатический, у 5 (21,7%) – генерализация после радикального лечения. У 8(34,8%) пациентов отмечено изолированное поражение органов – печени (2), легких (1) или забрюшинных лимфоузлов (5), у остальных отмечено от 2 до 6 зон поражения. Большинство (60,8%) пациентов на момент начала терапии имели удовлетворительное общее состояние при наличии симптомов заболевания (ECOG-1), состояние 30,4% пациентов соответствовало ECOG-2 и только у 8,7% – ECOG-0.
Характеристика группы пациентов представлена в табл. 1.
Гистологически преобладала аденокарцинома G2 – 86,9% (20), аденокарцинома G3 составила 13,1% (3).
Большинству пациентов наб-паклитаксел был назначен в 1-й линии терапии – 15 (65,2%), 5 (21,7%) – во второй и 3 (13,1%) – в третьей линии.
Противоопухолевая терапия наб-паклитакселом и гемцитабином проводилась до прогрессирования заболевания или непереносимой токсичности. Среднее количество курсов составило 4,3 (от 2 до 8). Всем пациентам препараты исходно назначались в стандартных дозировках. В процессе лечения 4 (17,4%) пациентам в связи с развитием гематологической токсичности дозы обоих цитостатиков были редуцированы на 25%. Отсрочки введения препаратов и начала циклов в связи с неразрешившимися явлениями гематологической и негематологической токсичности зарегистрированы у 7 (30,4%) пациентов. Основной причиной прекращения терапии стало прогрессирование болезни до 60,8% (14), в 1 случае препараты были отменены из-за гематологической токсичности (4,3%), в 1 случае – из-за негематологической токсичности (4,3%).
Непосредственные результаты лечения с применением наб-паклитаксела/гемцитабина представлены в табл. 2.

Объективный противоопухолевый эффект (ЧР) составил 26,1% (6), у 73,9% (17) достигнут контроль над опухолью (ЧР+СТ). Прогрессирование отмечено у 26,1% больных.
Медиана ВБП при терапии наб-паклитакселом/гемцитабином составила 6,0 месяцев, медиана ОВ – 9,7, это ниже, чем в ретроспективном анализе. Данное обстоятельство может быть связано с небольшим объемом группы и большой долей цензурированных наблюдений.
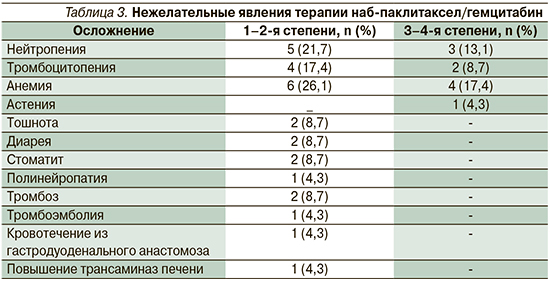
Спектр зарегистрированных нежелательных явлений представлен в табл. 3. Как видно из таблицы, профиль токсичности был в целом достаточно благоприятным. Превалировали гематологические осложнения: нейтропения в 34,7% случаев (3–4-й степеней – 13,1%), тромбоцитопения – в 34,7% случаев (3–4 степеней – 8,7%), анемия – в 43,5% (3–4 степеней – 17,4%). Данные осложнения послужили основанием для редукции доз (17,4%), отсрочки введения цитостатиков (17,3%) и в одном случае – для отмены терапии (4,3%). Негематологическая токсичность встречалась достаточно редко, но у 4 (17,4%) больных введение цитостатиков из-за нее было отложено. Это было связано с повышением трансаминаз, с тромбозом периферических вен, кровотечением из анастомоза. В 1 (4,3%) случае у пациентки развилась тромбоэмболия мелких ветвей легочной артерии, и лечение полностью прекращено.
Обсуждение
Согласно полученным в исследовании данным, комбинация наб-паклитаксела и гемцитабина показала себя достаточно эффективной. Результаты в плане объективного эффекта и показателей выживаемости в основном соответствуют ранее приведенным данным мультицентрового ретроспективного анализа MPACT (6.7) Показатель медианы ВБП также полностью соответствует данным российского мультицентрового ретроспективного анализа (10). Кроме того, нами отмечена удовлетворительная переносимость изучаемой комбинации цитостатиков. Наиболее частыми явлениями токсичности в нашем исследовании оказались гематологические, которые послужили основанием для редукции доз, отсрочки введений и в одном случае – для отмены препаратов. Вместе с тем, несмотря на относительную редкость по сравнению с гематологическими, считаем, что негематологические проявления токсичности были более значимыми, поскольку не только приводили к отсрочке курса лечения и полной отмене терапии, но и были более клинически значимыми. Вероятно, это связано с их характером и развитием на фоне распространенного опухолевого процесса, а также с трудностями их лечения. Однако в целом, поскольку в нашу группу больных вошли пациенты с функциональным статусом по шкале ECOG ≤2, можно говорить о том, что имеются возможности использования этой комбинации у ослабленных больных.
Заключение
В проведенном исследовании наб-паклитаксел в сочетании с гемцитабином продемонстрировал клиническую эффективность при лечении местнораспространенного рака поджелудочной железы, сравнимую с результатами многоцентровых международных и российских исследований. Данная комбинация характеризуется благоприятным профилем токсичности и может быть использована даже ослабленными пациентами с ECOG-2.
Однако необходимо тщательнее мониторировать нежелательные явления негематологического профиля, поскольку, несмотря на их относительную редкость, их выраженность и характер могут существенно влиять на ход лечения пациентов с данной тяжелой онкопатологией.
Источник финансирования
НИР согласно госзаданию.
Вклад авторов
Концепция и дизайн исследования – Владимирова Л.Ю., Абрамова Н.А. Сбор и обработка материала – Абрамова Н.А., Попова И.Л., Тихановская Н.М., Рядинская Л.А., Льянова А.А., Новоселова К.А., Сторожакова А.Э., Мягкова В.С., Теплякова М.А., Страхова Л.К. Кабанов С.Н., Калабанова Е.А., Саманева Н.Ю., Светицкая Я.В., Тишина А.В., Ежова М.О. Статистическая обработка данных – Новоселова К.А. Написание текста – Абрамова Н.А. Редактирование – Владимирова Л.Ю. Перевод – Теплякова М.А.



