Введение
Хронический панкреатит (ХП) нередко сочетается рефлюкс-эзофагитом (РЭ) различной степени выраженности [1, 2]. Однако, несмотря на всевозрастающую популяционную распространенность ХП и гастроэзофагеальной рефлюксной болезни (ГЭРБ), характер изменений кровотока в слизистой оболочке (СО) желудка и двенадцатиперстной кишки (ДПК) при коморбидности ХП и ГЭРБ в точности не установлен. При заболеваниях поджелудочной железы большинство клинических и экспериментальных исследований были посвящены изучению тканевой микрогемоциркуляции в зависимости от выраженности панкреатита [3, 4], а также особенностям васкуляризации при ХП и раке поджелудочной железы [5–7]. Между тем у больных язвенной болезнью желудка и ДПК была выявлена четкая взаимосвязь изменений микроциркуляции, моторики и морфологии СО этих отделов желудочно-кишечного тракта [8–11]. Исходя из вероятных сходных функциональных и морфологических изменений гастродуоденальной зоны при сочетании ХП и ГЭРБ, необходимость соответствующих функционально-морфологических исследований становится очевидной.
Целью нашего исследования была оценка состояния регионарного кровотока в СО тела, антрального отдела желудка и ДПК больных с сочетанием ХП и ГЭРБ в зависимости от гастродуоденальной моторной активности, морфологических изменений гастродуоденальной СО и их возраста.
Методы
В исследование был включен 41 (27 мужчин и 14 женщин) больной ХП в возрасте от 20 до 64 лет (средний возраст – 40,0±2,3 года) с наличием ГЭРБ, проявившейся изжогой (1-я группа), и 25 практически здоровых лиц (15 мужчин и 10 женщин) в возрасте от 22 до 46 лет (средний возраст – 34,4±4,3 года), составивших контрольную группу (2-я группа).
Согласно классификации TIGAR-O [12], у включенных в исследование больных имел место токсико-метаболический вариант ХП. Исходя из Манчестерской классификации ХП [13], у всех больных определена легкая или средняя степень тяжести заболевания. При оценке степени тяжести учитывались наличие: 1) панкреатической абдоминальной боли; 2) периодического или регулярного приема анальгетиков; 3) нарушений экзокринной и/или эндокринной функций; 4) морфологических признаков поражения поджелудочной железы при компьютерной томографии (КТ) или ультразвуковом исследовании (УЗИ) органов брюшной полости; 5) перипанкреатических осложнений. Эндоскопические изменения СО пищевода оценивали, согласно 2-му пересмотру Лос-Анджелесской классификации: степень N – отсутствие изменений; степень M – минимальные изменения; степень А – одна или более эрозий менее 5 мм длиной между двумя складками СО; степень В – одна или более эрозий более 5 мм длиной между двумя складками СО; степень С – более одной эрозии, выходящей за пределы двух складок, но не распространяющейся на всю окружность пищевода; степень D – распространение эрозий на всю окружность пищевода [14, 15]. РЭ A–D-степеней мы относили к ГЭРБ, а изменения СО пищевода N–M-степеней – к неэрозивной рефлюксной болезни (НЭРБ). Среди 41 больного с сочетанием ХП и ГЭ 30 (73,2%) отнесены к НЭРБ и 11 (26,8%) – к ГЭРБ.
Помимо общеклинического обследования всем пациентам были проведены УЗИ или КТ брюшной полости, определение экзокринной и эндокринной функций поджелудочной железы, эзофагогастродуоденоскопия с биопсией СО тела, антрального отдела желудка и луковицы ДПК. Морфологическое состояние СО оценивали в срезах, окрашенных гематоксилином и эозином с раздельной оценкой (степень выраженности – 0–3, в баллах) воспалительной (мононуклеарной) инфильтрации, кишечной (или желудочной) метаплазии и железистой атрофии. Скорость гастродуоденального мукозального кровотока измеряли полярографическим методом (LP-60, Чехия) по клиренсу водорода во время эзофагогастродуоденоскопии и вычисляли по формуле: К=69,3/Т/2 мл/мин/100 г, где Т/2 – время полувыведения водорода (в минуту), требующееся для уменьшения первоначальной величины кровотока на 50%.
Сопоставительные исследования кровотока в гастродуоденальной СО и гастродуоденальной моторики были проведены 23 больным. Влияние моторной активности на уровень микроциркуляции в гастродуоденальной СО определяли по характеру полярогрофических кривых кровотока, которые при наличии фазы возбуждения гладкомышечных клеток стенки желудка и ДПК отражали изменения трансмукозной разности потенциалов [16]. При этом полярографическая кривая отражала не только скорость регионарного кровотока, но и состояние периодической моторной активности желудка и ДПК, отчетливо манифестируя медленные (базальный электрический ритм) и быстрые волны (спайковые потенциалы) крупно- и мелковолнистыми колебаниями [10, 17, 18]. При анализе полярографической кривой выделяли 2 фазы гастродуоденальной моторики: 1-я – фаза моторного покоя и 2-я – фаза моторной активности. Особенности гистологических изменений и скорости кровотока в гастродуоденальной СО в возрастном аспекте были изучены у 20 больных старше 50 лет (средний возраст – 56,7±0,6 года) и у 21 – моложе 50 лет (средний возраст – 35,7±0,8 года).
При статистической обработке данных использовали компьютерную программу «Microsoft Excel v. 10» (Microsoft, США). Количественные параметры исследования были представлены в виде среднего значения и стандартной ошибки среднего значения с определением 95% доверительного интервала (p<0,05).
Результаты
Анализ гистологических данных больных с сочетанием ХП и ГЭРБ по сравнению с лицами контрольной группы выявил значимое преобладание в СО ДПК лимфоплазмоцитарной инфильтрации, желудочной метаплазии и железистой атрофии, а также существенное снижение высоты ворсинок и недостоверное утолщение СО, вероятно из-за ее отечности (см. таблицу). Морфологические изменения в СО луковицы ДПК у больных 1-й группы сопровождались существенным (на 26,2%) снижением скорости кровотока по сравнению с его уровнем у лиц с неизмененной СО. В СО антрального отдела желудка пациентов с сочетанием ХП и ГЭРБ по сравнению со здоровыми людьми превалировали воспалительные изменения (отечность и гиперемия СО) с более выраженными лимфоплазмоцитарной инфильтрацией, кишечной метаплазией и атрофией, подтвержденной значимой редукцией высоты железистого слоя. Кровоток в СО антрального отдела желудка у больных 1-й группы по сравнению с его уровнем у здоровых лиц был существенно ниже. Перестройка СО тела желудка в виде значимо преобладающих лимфоплазмоцитарной инфильтрации и атрофии желез у пациентов с сочетанием ХП и ГЭРБ по сравнению с лицами контрольной группы сопровождалась несущественным снижением скорости кровотока.
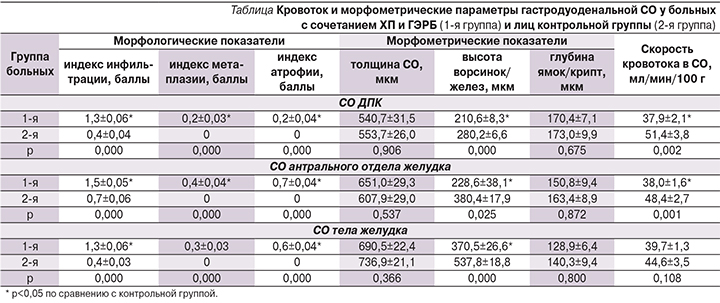
Морфологические исследования гастродуоденальной СО, проведенные на пациентах с сочетанием ХП и ГЭРБ в возрастных группах моложе и старше 50 лет, обнаружили в старшей возрастной группе существенное превалирование кишечной метаплазии (0,47±0,09 против 0,22±0,04 балла; р=0,007) и атрофии (0,80±0,08 против 0,53±0,06 балла; р=0,007) в антральном отделе желудка и атрофии желез (0,78±0,12 против 0,36±0,06 балла; р=0,001) и лимфоплазмоцитарной инфильтрации (1,53±0,11 против 0,92±0,02 балла; р=0,001) в теле желудка. Анализ изменений скорости кровотока в различных отделах гастродуоденальной СО у лиц старше 50 лет по сравнению с пациентами моложе 50 лет (рис. 1) показал существенное снижение кровотока в теле желудка (р=0,038) и антральном отделе (р=0,01), в то время как в СО луковицы ДПК уровень кровотока был примерно одинаковым (р>0,05).
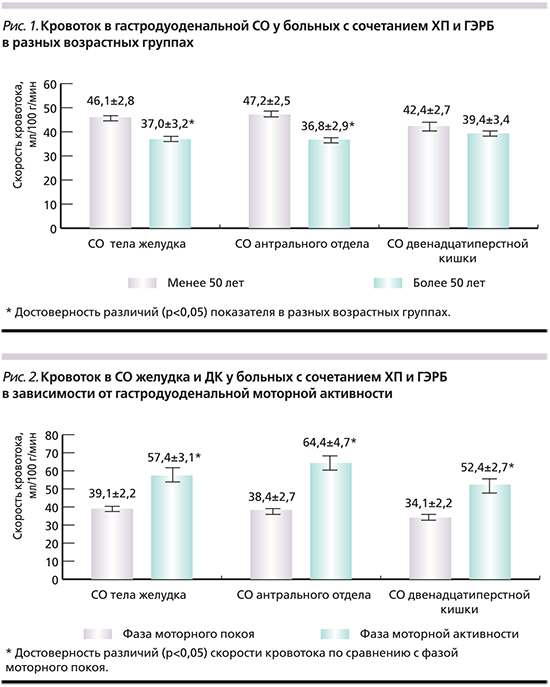
Исследование взаимосвязи кровотока в СО тела и антрального отдела желудка, а также луковицы ДПК и гастродуоденальной моторной активности выявило значимое (в среднем в 1,5–1,7 раза) увеличение скорости кровотока в фазе моторной активности по сравнению с фазой моторного покоя (р=0,001) у всех больных ХП во всех отделах гастродуоденальной СО (рис. 2).
Обсуждение
Полученные результаты интересны в плане сопряженности нарушений гастродуоденальной моторной деятельности и мукозальной микроциркуляции, которые могли привести к нарушению тканевой перфузии и морфологическим изменениям СО [19]. С учетом однонаправленности моторно-микроциркуляторных изменений, наблюдавшихся не только у больных коморбидными ХП и ГЭРБ, но и у пациентов с язвенной болезнью желудка и ДПК [8, 19], логично предположить, что гастродуоденальный моторно-микроциркуляторный континуум, являясь центральным эффекторным механизмом гастропротекции [20], позволяет по-новому оценить универсальный эффект восстановления микроциркуляции при нормализации моторной деятельности в эзофагогастродуоденальной зоне, которая нарушается и при ХП, и при ГЭРБ. Имеет значение и более медленное улучшение эзофагеальной моторики, и исчезновение изжоги у больных НЭРБ по сравнению с ГЭРБ [21].
Уменьшение кровотока у больных атрофией СО желудка, выявленное в нашем исследовании, могло быть обусловлено редукцией капсаициновых нервных окончаний в антральном отделе желудка и пониженной экспрессией кальцитонин-ген-родственного пептида, стимулирующего кровоток, а также ослаблением протективного биосинтеза простагландинов [22] и снижением уровня гастрина-17 [23]. Рассматривается гипотеза нарушения микроциркуляции, вызванного асимметричным диметиларгинином (ADMA) – клиническим и экспериментальным биомаркером гастритического повреждения [24]. По данным авторитетных авторов, регуляция стимулов, контролирующих секрецию бикарбонатов и мукозальный дуоденальный кровоток, является синхронной и нераздельной [25]. Поэтому сходный уровень скорости кровотока в ДПК у больных разного возраста можно объяснить примерно одинаковой и невыраженной степенью ХП – легкой или средней – с относительно сохраненной экзокринной функцией поджелудочной железы, включающей выработку бикарбонатов и обеспечивающей барьерную функцию ДК.
Наличие существенного прироста скорости кровотока в СО тела, антрального отдела и луковицы ДПК в ответ на функциональную нагрузку – мышечное сокращение – свидетельствовало о сохранении адекватной адаптивной реакции ДПК и желудка у больных легкой и средней степеней ХП. Этот эффект может быть следствием активации афферентных капсаициновых нейронов такими физиологическими стимулами, как растяжение желудка [26].
Заключение
Полученные данные свидетельствуют, что у больных ХП в сочетании с ГЭРБ или НЭРБ гистологические изменения гастродуоденальной СО сопровождались по сравнению со здоровыми лицами понижением скорости мукозального кровотока, связанным с железистой атрофией тела и антрального отдела желудка, более выраженной у пациентов старше 50 лет. Подтверждена возможность электрохимической регистрации гастродуоденальной моторной активности по характеру полярографических кривых клиренса водорода, отражающих скорость мукозального кровотока. Обнаруженные когерентные изменения гастродуоденальной моторной активности и скорости мукозального кровотока обоснованно позволяют предполагать возможность их ассоциированной медикаментозной коррекции.
В этом плане большое значение имеет выбор медикаментозных препаратов с учетом их возможного стимулирующего или редуцирующего влияния на кровоток. При этом назначение препаратов, нормализующих эзофагогастродуоденальную моторику, может способствовать улучшению микроциркуляции в СО желудка и ДПК при коморбидных ХП и ГЭРБ.



