По современным представлениям, ночные кошмары относят к группе парасомний. Одним из важных факторов, индуцирующих их появление, является прием различных лекарственных средств, в таком случае ночные кошмары называют лекарственно-индуцированными. Частота лекарственно-индуцированных ночных кошмаров точно не установлена, но при приеме некоторых препаратов (например, мефлохина) она может достигать 59%. Механизм развития ночных кошмаров при применении лекарственных средств чаще всего обусловлен их влиянием на различные рецепторы и нейротрансмиттерные системы: адренергическую, дофаминергическую и холинергическую. Среди классов лекарственных препаратов, прием которых чаще ассоциируется с развитием ночных кошмаров, рассматриваются антидепрессанты, противопаркинсонические средства, анальгетики, препараты, применяющиеся для лечения заболеваний сердечно-сосудистой системы, и некоторые другие. Тактика ведения пациентов с развитием лекарственно-индуцированных ночных кошмаров предполагает выявление и отмену лекарственного средства, индуцировавшего ночной кошмар или снижение его дозировки, а также при возможности назначение данного препарата в утреннее время. Профилактика лекарственно-индуцированных ночных кошмаров заключается в соблюдении принципов рациональной фармакотерапии, прежде всего в избегании превышения допустимой дозировки лекарственных средств.
Для цитирования: Остроумова Т.М., Остроумова О.Д., Кочетков А.И., Переверзев А.П. Лекарственно-индуцированные ночные кошмары. Фарматека. 2019;26(9):35–46. DOI: https://dx.doi.org/10.18565/pharmateca.2019.9.35-46
Введение
Согласно классификации нарушений сна 3-го пересмотра (International Classification of Sleep Disorders-Third Edition, ICSD-3), ночные кошмары (НК) относят к группе парасомний, связанных с быстрым сном [1]. НК характеризуются наличием повторяющихся неприятных сновидений, которые представляют собой проявление интенсивной психической деятельности в фазу быстрого сна [2].
Критерии постановки диагноза НК [1, 2]:
А. Повторяющиеся эпизоды продолжительных, очень неприятных и хорошо запоминающихся сновидений, обычно связанных с угрозой жизни, здоровья или физической целостности человека.
В. При пробуждении из неприятного сновидения пациент быстро приходит в состояние нормального сна.
С. Содержание сновидений или расстройства сна, вызывающиеся пробуждением из такого сновидения, вызывают клинически значимое нарушение социальной, профессиональной или других важных областей жизни человека, что подтверждается наличием одного из следующих проявлений:
- Расстройство настроения (сохранение ночных впечатлений, тревога, дисфория).
- Боязнь спать (тревога при укладывании, боязнь сна или кошмаров).
- Нарушение когнитивных функций (повторяющиеся образы из сновидения, нарушения концентрации или памяти).
- Негативное воздействие на жизнь окружающих (ночное беспокойство).
- Проблемы поведения (сопротивление укладыванию, боязнь темноты).
- Дневная сонливость.
- Чувство усталости или нехватки энергии.
- Нарушение производственной или учебной деятельности.
- Нарушение межличностного/социального взаимодействия.
НК могут быть как идиопатическими, так и вызванными посттравматическим стрессовым расстройством (ПТСР), психическими заболеваниями, тревожными и депрессивными расстройствами, а также возникать на фоне приема или отмены ряда препаратов (лекарственно-индуцированные НК – ЛИНК) [3, 4].
Распространенность
НК чаще встречаются в детском возрасте (60–75% популяции) [2], однако их распространенность в общей популяции достигает 4% [1]. До 85% лиц с НК имеют один НК в течение года, 8–29% – ежемесячные, 2–6% – еженедельные НК [5]. В кросс-секционном популяционном исследовании FINRISK Study [6] (13 922 участника [6515 мужчин и 7407 женщин] в возрасте 25–74 лет) НК чаще встречались у женщин, чем у мужчин (4,8 и 2,9% соответственно; р<0,001), однако распространенность НК увеличивалась с возрастом у мужчин (р<0,001), но не у женщин. Распространенность ЛИНК неизвестна.
Факторы риска
К факторам риска развития НК во взрослом возрасте относятся женский пол, инсомния, тревожные расстройства и депрессия, частые головные боли, вечерний хронотип у женщин («совы»), сниженный ответ кортизола на пробуждение у женщин [6–8]. Также в небольшом исследовании [9] (15 пациентов с НК [13 женщин, 2 мужчин, средний возраст – 31,5±6,2 года] и 15 здоровых добровольцев [13 женщин, 2 мужчин, средний возраст – 29,6±3,5 лет]) у пациентов с НК были ниже уровни триглицеридов (122,8±71,7 и 162,4±8,8 мг/дл соответственно; р=0,007), общего холестерина (162,5±10,8 и 194,3±28,8 мг/дл соответственно; р=0,017) и липопротеинов низкой плотности (88,8±15,2 и 121,4±25,1 мг/дл соответственно, р=0,006). Специфические факторы риска развития лекарственно-индуцированных НК неизвестны.
Патогенез
Лекарственные средства (ЛС), влияющие на адренергическую, дофаминергическую и холинергическую передачи, имеют также важную роль в формировании НК, поскольку данные нейротрансмиттеры могут участвовать в модуляции фаз сна [10].
Ацетилхолин является нейромодулятором, влияющим на быстрый сон [11, 12]. Холинергические агонисты обладают способностью увеличивать продолжительность быстрого сна, тогда как антагонисты – ее уменьшать [13]. Достаточно большое количество ЛС обладает антихолинергической активностью, в т.ч. и ингибиторы ацетилхолинэстеразы, которые широко применяются в терапии болезни Альцгеймера [14, 15].
На фоне приема антигипертензивных препаратов, влияющих на рецепторы к норадреналину (β-адреноблокаторы и α1-адреноагонисты), НК встречались в 34% случаев [10]. Механизм возникновения НК при приеме β-адреноблокаторов (БАБ) не изучен. Считается, что липофильные БАБ (метопролол и пропранолол) могут проникать через гематоэнцефалический барьер и блокировать β2- и/или 5-гидрокситриптаминовые (5-НТ) рецепторы в ЦНС [16], однако гидрофильные БАБ (атенолол) также могут вызывать НК [16]. БАБ также обладают способностью снижать ночную секрецию мелатонина [17] и сокращать долю REM-сна [18].
Дофамин. Стимуляция дофаминовых рецепторов часто приводит к возникновению НК. Использование препаратов, применяемых в лечении болезни Паркинсона, может приводить к различным нарушениям сна, в т.ч. и к НК [10, 19].
Серотонин также вовлечен в цикл сон–бодрствование: его активность максимальна в период бодрствования и минимальна во время сна.
В частности, во время NREM-сна концентрация серотонина снижается и достигает своего минимума в период REM-сна [11]. Например, селективные ингибиторы обратного захвата серотонина (СИОЗС) могут вызывать НК [10], хотя некоторые из них (например, флувоксамин) используют для лечения НК [20].
Гамма-аминомасляная кислота (ГАМК). Помимо антидепрессантов ингибирующим влиянием на быстрый сон обладают следующие ЛС [10]: барбитураты, бензодиазепины, небензодиазепиновые снотворные средства и симпатомиметики. Ряд авторов полагают, что механизм возникновения НК на фоне их применения связан с влиянием на рецепторы ГАМК [10].
Лекарственные средства, способные вызывать ЛИНК
Существует достаточно большое количество ЛС из разных групп, прием которых ассоциирован с развитием НК (см. таблицу).
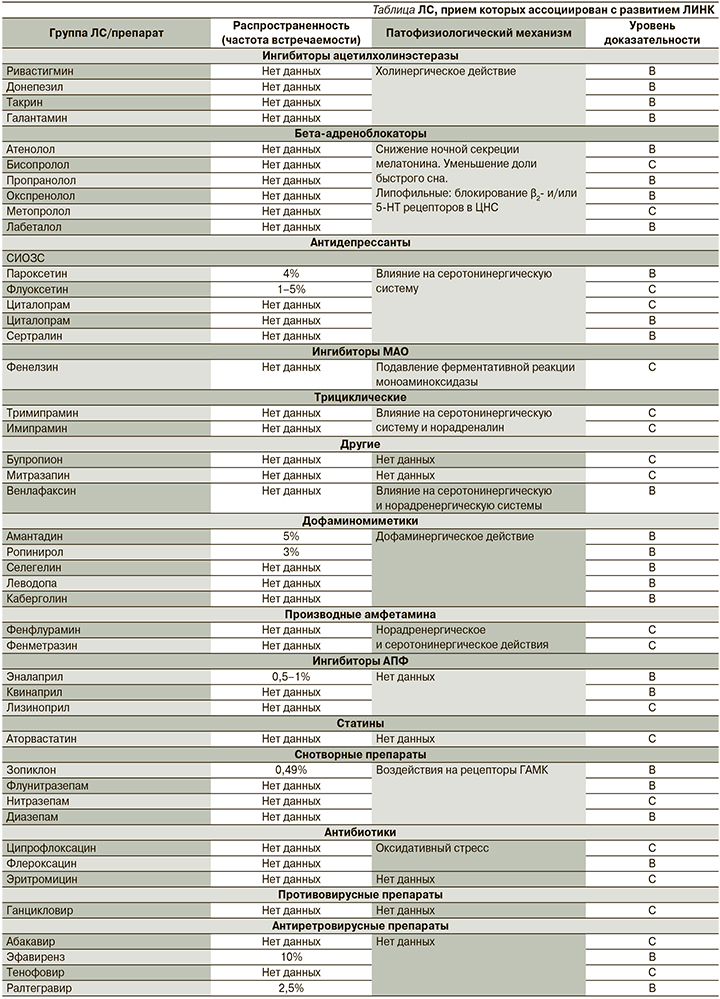
Ингибиторы ацетилхолинэстеразы
В ряде публикаций прием донепезила [21], ривастигмина, такрина [10] и галантамина [22, 23] был ассоциирован с НК. НК на фоне приема галантамина описаны, в частности, в работе S.M. Stahl et al. [23], которые проанализировали побочные эффекты галантамина по результатам трех рандомизированных двойных слепых клинических исследований. В исследование были включены 698 пациентов с болезнью Альцгеймера, разделенных на три группы: больных, получавших 16 мг галантамина (n=279), получавших 24 мг галантамина (n=705), и 714 больных, получавших плацебо. Было установлено, что в подгруппе пациентов, получавших галантамин в дозировке 24 мг/сут, НК встречались статистически значимо чаще, чем в группе плацебо (р=0,02).
Бета-адреноблокаторы
В популяционном исследовании C. Bengtsson et al. [24] (1302 женщины, возраст – 38–60 лет, 4,6% получали терапию БАБ, 4,3% диуретиками, 12,7% БАБ и другими антигипертензивными препаратами) у 13% женщин, получавших БАБ, были отмечены НК. Однако авторы не выявили статистически значимых различий по сравнению с женщинами, не получавшими антигипертензивную терапию. В обзоре J.F. Pagel et al. [10] выявлена связь между НК и приемом атенолола, бетаксолола, бисопролола, лабетолола, окспренолола и пропранолола.
Cove-Smith J.R. et al. [25] провели рандомизированное двойное слепое перекрестное исследование для сравнения побочных эффектов метопролола и атенолола (n=17, средний возраст – 51,4 года, 11 женщин). Липофильный БАБ, который получали пациенты (14 человек принимали пропранолол, 2 – пиндолол, 1 – окспренолол), был заменен на плацебо на 3 недели, после чего пациентам назначался либо метопролол 100 мг/cут, либо атенолол 100 мг/cут также на 3 недели. Во время приема плацебо у всех пациентов статистически значимо уменьшилось количество НК (p<0,01). Статистически значимых различий по частоте НК при сравнении атенолола и метопролола с плацебо, а также двух препаратов между собой выявлено не было.
Также в одном исследовании частота НК была выше у пациентов, получавших пропранолол (n=135), по сравнению с больными, получавшими лабеталол (n=805; 2,3 и 0,3% соответственно) [26]. Похожие результаты были получены при сравнении частоты побочных эффектов со стороны ЦНС (инсомния, НК, депрессия) при приеме пропранолола (23%) и бетаксолола (10%) [27]. В другой работе [28] НК статистически значимо (p<0,001) чаще встречались при приеме метопрололола и пропранолола по сравнению с атенололом. В единичной публикации описаны НК на фоне применения бисопролола [29].
Имеются данные о возникновении НК у пациентов, получавших метопролол [30, 31]. G. Boriani et al. [30] описали клинический случай пациента 55 лет, получавшего нифедипин 60 мг/сут, аспирин 325 мг/сут и симвастатин 10 мг/сут. Через 3 месяца после добавления к терапии метопролола 100 мг 2 раза в день у пациента начались НК. При уменьшении дозировки метопролола до 50 мг/сут состояние пациента не изменилось, а при замене метопролола на атенолол в дозировке 100 мг/сут НК полностью регрессировали. A.I.A. Ahmed et al. [31] описали возникновение НК у пожилого пациента, получавшего низкую дозу метопролола (25 мг/сут), аспирин 80 мг/сут, оксазепам 5 мг/сут и вальпроевую кислоту 500 мг 2 раза в день. После замены метопролола на амлодипин 10 мг/сут НК регрессировали в течение 1 недели. При повторном визите через 3 месяца НК у пациента также отмечено не было. Авторы считают, что у больного мог быть медленный метаболизм метопролола, однако генетическое тестирование не проводилось.
Ингибиторы ангиотензин-превращающего фермента
Прием нескольких ингибиторов АПФ ассоциировался с возникновением НК: каптоприла [32], эналаприла и квиниприла [10]. Согласно данным Центра фармаконадзора Нидерландов Lareb [33], НК на фоне приема эналаприла развились у 5 пациентов (отношение шансов [ОШ]=0,62; 95% доверительный интервал [ДИ] – 0,26–1,5), каптоприла – у 3 (ОШ – 0,15; 95% ДИ – 0,37–3,6) и периндоприла – у 1 пациента, однако полученные данные статистически не значимы. Кроме того, описан единичный клинический случай возникновения НК на фоне приема 10 мг лизиноприла у женщины 63 лет с ожирением [34]. Механизм возникновения НК на фоне приема ингибиторов АПФ не изучен, однако в одном экспериментальном исследовании интравентрикулярное введение ангиотензина II уменьшило длительность REM-сна [35].
Блокаторы рецепторов ангиотензина
Опубликован клинический случай возникновения НК на фоне прима валсартана [36].
Статины
P.J. Gregoor [37] описал НК у пациентки 72 лет, возникшие через 5 дней после добавления 10 мг аторвастатина к ее постоянной терапии (75 мг левотироксина, 5 мг амлодипина, 100 мг атенолола и 50 мг лозартана). S. Cham et al. [38] опубликовали серию из 12 случаев изменения настроения и поведения пациентов, получавших статины. У одного молодого больного, которому был назначен аторвастатин для лечения семейной гиперлипидемии в дозировке 20 мг, через 2 недели после начала приема препарата развились НК (содержание сна включало ножи и оружие, один из НК был настолько пугающим, что пациент после пробуждения выпрыгнул через окно), когнитивные нарушения (проблемы с концентрацией и вниманием в школе, вплоть до серьезных трудностей с чтением через месяц приема препарата), снохождение и тревожное расстройство, однако у пациента в семейном анамнезе имелись психические заболевания.
После двухлетней терапии аторвастатином пациент самостоятельно прекратил прием препарата и все симптомы регрессировали. Через 6 недель пациент снова начал принимать аторвастатин, после чего возобновились НК и когнитивные нарушения. Через 2 недели после повторной попытки приема аторвастатина пациент совершил самоубийство.
Антидепрессанты
СИОЗС. В единичных работах описаны НК у пациентов на фоне приема флуоксетина [39], пароксетина [40], сертралина [41] и циталопрама [42].
Ингибиторы МАО. Описано несколько клинических случаев НК на фоне отмены фенелзина [43–45]. С другой стороны, опубликованы серия случаев [46] и проспективное исследование [47], в которых фенелзин успешно использовался в лечении НК при ПТСР.
Трициклические антидепрессанты. На фоне приема ТЦА (таких, как тримипрамин и имипрамин) пациенты могут не запоминать свои сны, т.е. снижается частота воспроизведения снов [48, 49]. При этом тримипрамин может, наоборот, вызывать более приятные сны [48]. Возможно, возникновение НК на фоне приема ТЦА связано с режимом дозирования ЛС. Так, в двух исследованиях сравнивалось влияние однократного приема препаратов перед сном и многократного в течение суток (суточная доза была разделена на 3 приема в течение дня) [50, 51]. При приеме ТЦА на ночь 78,6% [50] и 47% [51] всех снов являлись НК, в то время как при многократном приеме в течение суток частота НК составляла лишь 11,5% [50] или они вовсе не возникали [51]. Отмена ТЦА также может приводить к НК [52–55]. При этом НК развиваются не только при передозировке имипрамина [52], но и у пациентов, получавших имипрамин в дозировке 150–300 мг/сут [53, 55]. С другой стороны, в публикации серии из 10 случаев НК у пациентов с ПТСР ТЦА существенно уменьшали частоту НК [56].
Другие антидепрессанты. Случаи НК также описаны на фоне приема норадренергического и селективного серотонинергического антидепрессанта митразапина [57–60]. Двухлетний мониторинг Австралийского комитета по оценке побочных реакций (ADRAC) показал, что НК на фоне приема митразапина были отмечены лишь у 14 лиц из практически 500 тыс. пациентов [61].
В единичной публикации описан клинический случай развития НК при приеме атипичного антидепрессанта бупропиона [62]. В исследовании по изучению применения венлафаксина с длительным высвобождением (XR) для профилактики мигрени и головной боли напряжения НК были отмечены у 1,8% пациентов с мигренью, но не у лиц с болью напряжения [63]. В исследовании S.P. Lam et al. [64] изменение схемы лечения 15 пациентов с депрессией с СИОЗС или ингибиторов обратного захвата серотонина и норадреналина на бупропион или полная отмена препаратов уменьшали частоту НК.
Дофаминомиметики
По данным J.F. Pagel et al. [10], НК связаны с приемом каберголина и некоторых противопаркинсонических препаратов (амантадина, леводопы, ропинирола, селегелина). Возникновение НК может также быть ассоциировано с дозировкой и способом введения противопаркинсонических препаратов. Так, S. Kumar et al. [65] в своей работе установили, что у пациентов с болезнью Паркинсона и НК (n=48) по сравнению с пациентами без НК (n=101) была выше средняя суточная дозировка леводопы (524,39±274,46 против 406,99±269,06 мг; р=0,025) и селегелина (10,00±0 против 9,32±1,74 мг; р=0,013), а при дуоденальной инфузии геля леводопы–карбидопы частота НК статистически значимо уменьшилась (p=0,0075) [66].
Производные амфетамина
В литературе опубликованы клинические случаи возникновения НК при приеме фенфлурамина [67–69] и фенметразина [70]. В одной из работ частота возникновения НК была статистически значимо линейно ассоциирована с дозировкой фенфлурамина [69].
Cнотворные препараты
Имеются данные о способности зопиклона и флунитразепама изменять содержание снов и вызывать НК [10]. Так, в постмаркетинговом исследовании НК на фоне приема зопиклона развились у 101 (0,49%) пациента, что являлось одним из самых частых побочных эффектов [71]. Флунитразепам увеличивал количество неприятных снов и по сравнению с группой плацебо вызывал более неприятные сны с агрессивным содержанием [72, 73]. Диазепам вызывал НК у детей [74] и взрослых [75, 76]. Также опубликован клинический случай НК при применении нитразепама [77].
С другой стороны, нитразепам уменьшал частоту НК в двойном слепом перекрестном исследовании [78].
Антибактериальные препараты
Фторхинолоны. НК являются довольно редким побочным эффектом ципрофлоксацина и флероксацина. В исследовании безопасности и эффективности ципрофлоксацина (9473 пациента) они развились лишь у одного [79]. В другой работе [80] среди 85 пациентов, получавших флероксацин, НК или галлюцинации отмечены у 7 участников. Опубликован клинический случай пациентки 24 лет, получавшей 500 мг ципрофлоксацина в связи с гастроэнтеритом. Через 2 дня после начала приема препарата у больной возникли НК, она стала раздражительной и тревожной в течение дня. НК полностью регрессировали после окончания курса лечения ципрофлоксацином (5 дней) [81]. Также имеются данные о возникновении НК на фоне приема ципрофлоксацина у 2 детей (4 и 5 лет) [82]. Точный механизм возникновения НК при приеме фторхинолонов не известен, однако в одной экспериментальной работе ципрофлоксацин вызывал оксидативный стресс в гиппокампе [83], который также играет важную роль в патофизиологии НК [8].
Макролиды. В доступной литературе опубликовано три клинических случая НК на фоне приема эритромицина [84–86]. N.R. Williams [84] описал НК у пациентки 23 лет, получавшей 250 мг эритромицина 4 раза в день для лечения сепсиса: НК развился через 48 часов после начала лечения. R.J. Black et al. [85] описали НК, который развился на следующий день после начала лечения пациентки 21 года, принимавшей эритромицин в дозировке 250 мг/сут для лечения акне. В течение следующего месяца больная продолжила терапию эритромицином, на фоне которой отмечала минимум 2 НК каждую неделю. В недавно опубликованном клиническом случае M.E. Møller et al. [86] также описана молодая пациентка 19 лет с синдромом Элерса–Данло и замедленным опорожнением желудка, которой был назначен прием 250 мг эритромицина 4 раза в день. НК развились в течение первой недели приема препарата, их частота составила 3–7 раз в неделю. Во всех трех клинических случаях НК на фоне приема эритромицина развились у молодых женщин без психических заболеваний в анамнезе и полностью регрессировали после отмены препарата [84–86]. Однако, принимая во внимание тот факт, что между данными публикациями прошло около 30 лет, НК можно отнести к крайне редким возможным побочным эффектам эритромицина.
Противовирусные препараты
Опубликован 1 клинический случай [87] развития НК и галлюцинаций на 15-й день терапии ганцикловиром внутривенно в дозе 5 мг/кг (300 мг) раз в 12 часов у женщины 45 лет со СПИДом и цитомегаловирусным ретинитом. У пациентки не было ВИЧ-энцефалопатии, инфекционных заболеваний ЦНС и психических заболеваний в анамнезе. Ганцикловир был отменен, и больной был назначен галоперидол в дозе 2 мг, после чего НК регрессировали. В связи с ухудшением симптомов цитомигаловирусного ретинита пациентке была назначена поддерживающая доза ганцикловира (300 мг/сут), на фоне которой НК и галлюцинации не повторялись. Авторы считают, что НК у больной возникли в связи с тем, что ее клиренс креатинина по формуле Кокрофта–Голта варьировался в пределах 0,62–0,80 мл/с, соответственно дозировка ганцикловира не должна была превышать 2,5 мг/кг/сут, в то время как пациентка получала 10 мг/кг/сут.
Антиретровирусные препараты
НК на фоне приема абакавира описаны в двух клинических эпизодах [88, 89]. В обоих случаях симптомы развились в течение первого месяца терапии. На фоне приема эфавиренза частым (>10%) побочным эффектом стали яркие сны [90], а также описан клинический случай возникновения НК [91]. Кроме того, описана серия случаев (9 пациентов) возникновения НК в течение менее 48 часов после добавления к терапии эфавирензом тенофовира [92]. Авторы не смогли объяснить причину НК у данных больных. В мета-анализе эффективности и безопасности ралтегравира у 2,5% пациентов, получавших препарат в дозе 400 мг 2 раза в день, развились «ненормальные» сны и НК [93].
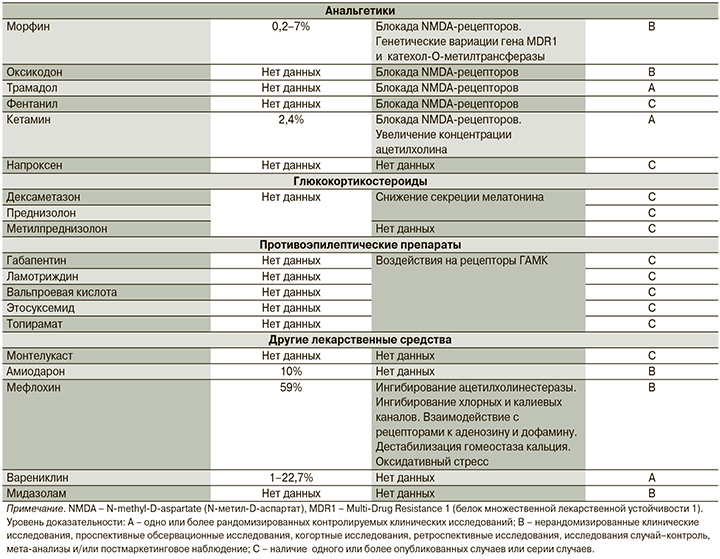
Анальгетики
Частота НК у пациентов, получающих морфин, колеблется в пределах 0,2–7% [94–96]. В перекрестном двойном слепом исследовании E. Kalso et al. [97] (n=10) было выявлено статистически значимо (р <0,05) больше НК при пероральном приеме морфина по сравнению с подкожным введением.
В другом проспективном исследовании [94] (2696 послеоперационных пациентов) не было выявлено статистически значимых различий в частоте НК при внутривенном и эпидуральном введении препарата. В серии клинических случаев НК развивались также при интратекальном введении морфина [98]. В проспективном исследовании P. Glare et al. [95] не было выявлено статистически значимых различий в частоте НК в группах пациентов, получавших разные дозировки морфина, однако больные получали множество сопутствовавших препаратов, которые могли влиять на возникновение НК. С помощью метода логистической регрессии J.R. Ross et al. [99] показали, что появление НК стало одним из предикторов изменения терапии с морфина на оксикодон (ОШ=3,58; 95% ДИ – 1,04–12,25; р=0,04), однако в другой работе подобной связи выявлено не было [100]. Кроме того, оксикодон тоже может вызывать НК [101, 102], хотя и реже, чем морфин [102]. В проспективном рандомизированном двойном слепом исследовании НК развились только в группе пациентов, получавших трамадол, а не морфин [103].
По результатам систематического обзора рандомизированных клинических исследований N. Elia et al. [104], частота НК на фоне приема кетамина составляет 2,4% (ОШ =2,64; 95% ДИ – 0,76–9,62; число больных в экспериментальной группе по сравнению с контрольной, необходимое для выявления дополнительного неблагоприятного исхода [Number Needed to Harm] – 62). В систематическом обзоре K. Laskowski et al. НК встречались чаще при использовании кетамина по сравнению с плацебо [105]. В открытом исследовании дозировки кетамина до 117 мкг/кг/мин или 7 мг/кг/ч в 90% случаев приводили к тревожным нарушениям, дисфории и НК [106]. В исследовании на здоровых добровольцах [107] частота НК, возникших дома (а не в стационаре), была выше у лиц, получавших субанестетические дозы кетамина, по сравнению с группой плацебо (p=0,008).
Также описан клинический случай НК при использовании трансдермального пластыря с фентанилом [101].
Механизм развития НК при применении опиодных анальгетиков не до конца ясен. Он может быть связан с блокадой рецепторов к N-метил-D-аспартату (NMDA) [108], генетическими вариациями гена MDR1 (multidrug resistance-1 gene) и катехол-О-метилтрансферазы при применении морфина [99], увеличением концентрации ацетилхолина при применении кетамина [109].
В отношении неопиодных анальгетиков в доступной литературе имеется публикация одного клинического случая развития НК у пациента, получавшего напроксен [110].
Противоэпилептические препараты
Согласно базе данных ВОЗ, габапентин, ламотриджин, вальпроевая кислота, этосуксимид и топирамат могут вызывать НК [111]. C другой стороны, в серии клинических случаев [112] габапентин уменьшал частоту НК у пациентов с ПТСР. Топирамат показал свою эффективность в отношении терапии НК при ПТСР в трех публикациях серий кинических случаев [113–115] и одном небольшом рандомизированном плацебо-контролируемом исследовании [116].
Глюкокортикостероиды
Согласно базе данных нежелательных побочных реакций ВОЗ VigiBase [111], НК встречаются при использовании дексаметазона, преднизолона и метилпреднизолона. R. Turner et al. [117] описали несколько случаев НК у пациентов с онкологическими заболеваниями, получавших дексаметазон в дозе 8–12 мг/сут. D. Clifton et al. [118] описали два клинических наблюдения НК у пациентов без тревожных и депрессивных расстройств, получавших высокие дозы дексаметазона или преднизолона. В одной работе на фоне применения интраназальных кортикостероидов у 9 (в т.ч. 2 детей) человек из 429 участников исследования развились «ненормальные сны», у 14 (в т. ч. 4 детей) – НК. Анализ по влиянию конкретных препаратов на НК не проводился [119]. Дексаметазон и преднизолон снижают секрецию мелатонина, что может потенциально приводить к развитию НК [120].
Другие лекарственные препараты
Монтелукаст. По результатам анализа Шведской базы данных побочных эффектов (Swedish Adverse Drug Reaction database, SWEDIS) [121], на фоне приема монтелукаста у 48 детей развились «психиатрические» побочные эффекты ( инсомния, кошмары, галлюцинации, ажитация и др.), из них у 15 (53% младше 5 лет) развились НК. G. Cereza et al. [122] опубликовали серию из 24 случаев (большинство пациентов были детьми в возрасте 2–7 лет) НК на фоне приема монтелукаста.
Амиодарон. Имеется ряд публикаций, в которых описаны НК на фоне приема амиодарона [123, 124]. Например, в работе D.E. Ward et al. [123] НК и «очень яркие» сновидения встречались у 10% пациентов, получавших терапию амиодароном.
Мефлохин. НК – очень частый побочный эффект противомалярийного препарата мефлохина [125, 126]. В одном из исследований [125] у 43 (59%) из 73 пациентов, получавших мефлохин, развились НК, которые сохранялись в среднем около месяца. Очень яркие сны и НК на фоне приема мефлохина описываются пациентами как «четкие, как в кино» и «живо вспоминающиеся даже несколько дней спустя» [127], что может являться продромальной стадией развития психоза [126]. Патогенетический механизм развития НК при применении мефлохина не до конца изучен, однако существуют данные, согласно которым нейротоксический эффект препарата может быть связан с ингибированием ацетилхолинестеразы [126], хлорных [128] и калиевых [129] каналов, взаимодействием с рецепторами к аденозину и дофамину [130], дестабилизацией гомеостаза кальция [128, 129], а также с оксидативным стрессом и последующей дегенерацией нейронов [131].
Варениклин. НК достаточно часто возникали на фоне применения варениклина в рандомизированных и когортных исследованиях [132–138]. Частота НК у пациентов, получающих варениклин, колеблется в очень широких пределах – от 1 до 22,7% (134, 136–138]. В своем мета-анализе K.H. Thomas et al. [139] показали, что применение варениклина увеличивало риск развития «ненормальных» снов (ОШ =2,38; 95% ДИ – 2,05–2,77). Лишь в одном рандомизированном двойном слепом исследовании M.J. Eisenberg et al. [140] не выявили статистически значимых различий по частоте НК у пациентов с острым коронарным синдромом, получавших варениклин, по сравнению с плацебо. В исследовании N. Fouz-Rosónet al. [134] не было отмечено статистически значимых отличий по частоте НК между группами пациентов, получавших 0,5 и 1 мг варениклина. H.E. Tulloch et al. [135] обнаружили, что частота нарушений сна (НК, инсомнии и др.) на фоне приема варениклина выше по сравнению с применением заместительной терапии никотином (р<0,001), однако субанализ по отдельным нозологиям не проводился. T.B. Baker et al. [141] показали что риск ярких снов при применении пластыря с никотином ниже по сравнению с применением варениклина. Однако Н. Tomioka et al. [142], проанализировавшие базу данных специального регистра из более чем 400 курильщиков, принимавших участие в 3-месячной программе по отказу от курения, не обнаружили статистически значимой разницы в частоте НК между пациентами, получавшими варениклин и пластырь с никотином. Наконец, в систематическом обзоре и мета-анализе P.-H. Chang et al. [143] показано, что «ненормальные» сны чаще встречались у пациентов, получавших варениклин в комбинации с никотиновым пластырем, по сравнению с пациентами, получавшими варениклин и пластырь с плацебо (ОШ = 1,20; 95% ДИ – 0,78–1,84).
Мидазолам. В двух исследованиях описано развитие НК у детей при премедикации мидазоламом [144, 145].
Диагностика ЛИНК
Стандартизированные шкалы разработаны в основном для пациентов с ПТСР, например, используются шкала для клинической диагностики ПТСР (Clinician Administered PTSD Scale, CAPS) и ее модификации [20]. Также применяют симптоматический опросник (Symptom Checklist-90, SCL-90) [20]. Специфических шкал для диагностики ЛИНК не существует, соответственно, необходим тщательный сбор анамнеза пациента и анализ всех принимаемых им ЛС.
Тактика ведения пациентов с ЛИНК
Не существует четких рекомендаций по лечению ЛИНК. При наличии НК необходимы тщательный сбор анамнеза и принимаемых им ЛС, а также оценка эмоционального состояния пациента. Риск НК на фоне применения системных глюкокортикостероидов может быть потенциально снижен временем назначения препаратов (в утренние часы) и/или дополнительным назначением препаратов с седативным эффектом на ночь [146]. Если отмена или замена препарата, вызывающего НК, невозможна, существует ряд психотерапевтических методик, которые могут использоваться для лечения НК [20].
Прогноз
В случае выявления и отмены ЛС, вызвавшего НК, прогноз благоприятен. Во всех вышеописанных исследованиях НК полностью регрессировали после отмены такого препарата.
Заключение
Таким образом, ЛИНК являются малоизвестным практикующим врачам побочным эффектом ряда ЛС. Список лекарственных препаратов, прием которых ассоциирован с возникновением НК, достаточно широк, а механизмы их развития сложны, многообразны и в большинстве случаев недостаточно изучены. Поэтому повышение информированности врачей разных специальностей о данной нежелательной побочной реакции, своевременные мероприятия по коррекции выявленных нарушений сна, включающие в т.ч. возможную отмену вызвавших НК препаратов, а также профилактика развития данной побочной реакции имеют очень важное значение.
1. Sateia M.J. International classification of sleep disorders-third edition: highlights and modifications. Chest. 2014;146(5):1387–94. Doi: 10.1378/chest.14-0970.
2. Полуэктов М.Г. Диагностика и лечение расстройств сна. М. 2016;193–97.
3. Aurora R.N., Zak R.S., Auerbach S.H., et al. Best practice guide for the treatment of nightmare disorder in adults. J Clin Sleep Med. 2010;6(4):389–401.
4. Остроумова О.Д, Исаев Р.И., Переверзев А.П.Лекарственно-индуцированная инсомния у пациентов пожилого и старческого возраста.Журнал неврологии и психиатрии им. С.С. Корсакова. 2019;119(8):142–52.
5. Hasler B.P., Germain A. Correlates and treatments of nightmares in adults. Sleep Med Clin. 2009;4(4):507–17. Doi: 10.1016/j.jsmc.2009.07.012
6. Sandman N., Valli K., Kronholm E., et al. Nightmares: risk factors among the Finnish general adult population. Sleep. 2015;38(4):507–14. Doi: 10.5665/sleep.4560.
7. Nagy T., Salavecz G., Simor P., et al. Frequent nightmares are associated with blunted cortisol awakening response in women. Physiol Behav. 2015;147:233–37. Doi: 10.1016/j.physbeh.2015.05.001.
8. Nielsen T. Nightmares associated with the eveningness chronotype. J Biol Rhythms. 2010;25(1):53–62. Doi: 10.1177/0748730409351677.
9. Agargun M.Y., Mustafa G., Savas C.A.,. et al. Nightmares and serum cholesterol level: a preliminary report. J Nerv Ment Dis. 2005;50(6):361–64. Doi: 10.1177/070674370505000613.
10. Pagel J.F., Helfter P. Drug induced nightmares – an etiology based review. Hum Psychopharmacol. 2003;18(1):59–67. Doi: 10.1002/hup.465.
11. Ковальзон В.М. Нейрофизиология и нейрохимия сна. В кн.: Сомнология и медицина сна. Национальное руководство памяти А.М. Вейна и Я.И. Левина. Под ред.М.Г. Полуэктова. М.: Медфорум. 2016.
12. Литвиненко И.В. Нарушения сна и памяти, ацетилхолин при некоторых нейродегенеративных заболеваниях, применение пролонгированной формы галантамина. Неврология, нейропсихиатрия, психосоматика. 2012;4(2):100–5.
13. Steriade M. Brain electrical activity and sensory processing during waking and sleep states. In: Kryger M.H., Roth T., Dement W.C. (Eds.) Principles and practice of sleep medicine (5th ed.). St. Louis, MO: Elsevier Saunders. 2005. P. 101–19. Doi: 10.1016/B0-72-160797-7/50016-1.
14. Дамулин И.В., Яхно Н.Н. Болезнь Альцгеймера и сосудистая деменция. М., 2002.
15. Захаров В.В., Яхно Н.Н. Когнитивные расстройства в пожилом и старческом возрасте. М., 2005.
16. Conant J., Engler R., Janowsky D., et al. Central nervous system side effects of β-adrenergic blocking agents with high and low lipid solubility. J Cardiovasc Pharmacol. 1989;13(4):656–61.
17. Brismar K., Mogensen L., Wetterberg L. Depressed melatonin secretion in patients with nightmares due to β‐adrenoceptor blocking drugs. Acta Med Scand. 1987;221(2):155–58. Doi: 10.1111/j.0954-6820.1987.tb01260.x.
18. Betts T.A., Alford C. β-Blockers and sleep: a controlled trial. Eur J Clin Pharmacol. 1985;28(1):65–8. Doi: 10.1007/bf00543712.
19. Нодель М.Р., Ковров Г.В. Нарушения сна при болезни Паркинсона: подходы к лечению и профилактике. Неврология, нейропсихиатрия, психосоматика. 2017;9(4):88–94.
20. Morgenthaler T.I., Auerbach S., Casey K.R., et al. Position paper for the treatment of nightmare disorder in adults: an American Academy of Sleep Medicine position paper. J Clin Sleep Med. 2018;14(6):1041–55. Doi: 10.5664/jcsm.7178.
21. Kitabayashi Y., Ueda H., Tsuchida H., et al. Donepezil-induced nightmares in mild cognitive impairment. Psychiatry Clin Neurosci. 2006;60(1):123–24. Doi: 10.1111/j.1440-1819.2006.01474.x.
22. Corbo J.M., Brown J.N., Moss J.M. Galantamine-associated nightmares and anxiety. Consult Pharm. 2013;28(4):243–46. Doi: 10.4140/TCP.n.2013.243.
23. Stahl S.M., Markowitz J.S, Papadopoulos G., et al. Examination of nighttime sleep-related problems during double-blind, placebo-controlled trials of galantamine in patients with Alzheimer’s disease. Curr Med Res Opin. 2004;20(4):517–24. Doi: 10.1185/030079904125003214.
24. Bengtsson C., Lennartsson J., Lindquist O., et al. Sleep disturbances, nightmares and other possible central nervous disturbances in a population sample of women, with special reference to those on antihypertensive drugs. Eur J Clin Pharmacol. 1980;17(3):173–77. Doi: 10.1007/bf00561896.
25. Cove-Smith J.R., Kirk C.A. CNS-related side-effects with metoprolol and atenolol. Eur J Clin Pharmacol. 1985;28(1):69–72. Doi: 10.1007/bf00543713.
26. Due D.L., Giguere G.C., Plachetka J.R. Postmarketing comparison of labetalol and propranolol in hypertensive patients. Clin Ther. 1986;8(6):624–31.
27. Davidov M.E., Glazer N., Wollam G., et al. Comparison of betaxolol, a new β1-adrenergic antagonist, to propranolol in the treatment of mild to moderate hypertension. Am J Hypertens. 1988;1(3):206S–210S. Doi: 10.1093/ajh/1.3.206S.
28. Westerlund A. Central nervous system side-effects with hydrophilic and lipophilic β-Blockers. Eur J Clin Pharmacol. 1985;28(1):73–6. Doi: 10.1007/bf00543714.
29. Kuriyama S. Bisoprolol-induced nightmares. J Hum Hypertens. 1994;8(9):730.
30. Boriani G., Biffi M., Strocchi E., et al. Nightmares and sleep disturbances with simvastatin and metoprolol. Ann Pharmacother. 2001;35(10):1292. Doi: 10.1345/aph.1A079.
31. Ahmed A.I.A., van Mierlo P., Jansen P. Sleep disorders, nightmares, depression and anxiety in an elderly patient treated with low-dose metoprolol. Gen Hosp Psychiatry. 2010;32(6):646.e5–e7. Doi: 10.1016/j.genhosppsych.2010.04.008.
32. Haffner C.A., Smith B.S., Pepper C. Hallucinations as an adverse effect of angiotensin converting enzyme inhibition. Postgrad Med J. 199369(809):240. Doi: 10.1136/pgmj.69.809.240.
33. Lareb Database.
34. Brockman M.M., Pharm D., Trewet C.B., et al. Lisinopril-induced nightmares. Pharmacotherapy. 2010;30(8):864. Doi: 10.1592/phco.30.8.864.
35. Gvilia I., Angara C., McGinty D., et al. Different neuronal populations of the rat median preoptic nucleus express c-fos during sleep and in response to hypertonic saline or angiotensin-II. J Physiol. 2005;569(2):587–99. Doi: 10.1113/jphysiol.2005.097212.
36. Kastalli S., El A.S., Loueslati M.H., et al. Nightmares induced by valsartan. Therapie. 2006;61(1):
81–2. Doi: 10.2515/therapie:2005069.
37. Gregoor J.P. Atorvastatin may cause nightmares. Br Med J. 2006;332(7547):950. Doi: 10.1136/bmj.332.7547.950.
38. Cham S., Koslik H.J., Golomb B.A. Mood, personality, and behavior changes during treatment with statins: A case series. Drug Saf Case Rep. 2016;3(1):1–13. Doi: 10.1007/s40800-015-0024-2.
39. Lepkifker E., Dannon P.N., Iancu I., et al. Nightmares related to fluoxetine treatment. Clin Neuropharmacol. 1995;18(1):90–4.
40. Kobayashi T., Yamauchi M. A case of serial nightmares and oneiroid state under paroxetine for senile depression. Psychogeriatrics. 2012;12(1):54–7. Doi: 10.1111/j.1479-8301.2011.00382.x.
41. McRae A.L., Brady K.T., Mellman T.A., et al. Comparison of nefazodone and sertraline for the treatment of posttraumatic stress disorder. Depress Anxiety. 2004;19(3):190–96. Doi: 10.1002/da.20008.
42. Arora G., Sandhu G., Fleser C. Citalopram and nightmares. J Neuropsychiatry Clin Neurosci. 2012;24(2):E43. Doi: 10.1176/appi.neuropsych.11040096.
43. Joyce P.R., Walshe J. Nightmares during phenelzine withdrawal. J Clin Psychopharmacol. 1983;3(2):121.
44. Palladino A. Jr. Adverse reactions to abrupt discontinuation of phenelzine. J Clin Psychopharmacol. 1983;3(3):206–7.
45. Akindele M.O., Evans J.I., Oswald I. Mono-amine oxidase inhibitors, sleep and mood. Electroencephalogr Clin Neurophysiol. 1970;29(1):47–56. Doi: 10.1016/0013-4694(70)90078-7.
46. Hogben G.L., Cornfield R.B. Treatment of traumatic war neurosis with phenelzine. Arch Gen Psychiatry. 1981;38(4):440–45. Doi: 10.1001/archpsyc.1981.01780290074008.
47. Lerer B., Bleich A., Kotler M., et al. Posttraumatic stress disorder in Israeli combat veterans: effect of phenelzine treatment. Arch Gen Psychiatry. 1987;44(11):976–81. Doi: 10.1001/archpsyc.1987.01800230056010.
48. Schredl M., Berger M., Riemann D. The effect of trimipramine on dream recall and dream emotions in depressive outpatients. Psychiatry Res. 2009;167(3):279–86. Doi: 10.1016/j.psychres.2008.03.002.
49. Whitman R.M., Pierce C.M., Maas J.W., et al. Drugs and dreams II: Imipramine and prochlorperazine. Compr Psychiatry. 1961;2(4):219–26. Doi: 10.1016/s0010-440x(61)80014-x.
50. Flemenbaum A. Pavor nocturnus: a complication of single daily tricyclic or neuroleptic dosage. Am J Psychiatry. 1976;133(5):570–72. Doi: 10.1176/ajp.133.5.570.
51. Strayhorn J.M., Nash J.L. Frightening dreams and dosage schedule of tricyclic and neuroleptic drugs. J Nerv Ment Dis. 1978;166(12):878–80. Doi: 10.1097/00005053-197812000-00008.
52. Lewis S.A., Oswald I. Overdose of tricyclic anti-depressants and deductions concerning their cerebral action. Br J Psychiatry. 1969;115(529):1403–10. Doi: 10.1192/bjp.115.529.1403.
53. Dilsaver S.C., Feinberg M., Greden J.F. Antidepressant withdrawal symptoms treated with anticholinergic agents. Am J Psychiatry. 1983;140(2):249–51. Doi:10.1176/ajp.140.2.249.
54. Boisvert D., Chouinard G. Rebound cardiac arrhythmia after withdrawal from imipramine: A case report. Am J Psychiatry. 1981;138(7):985–86. Doi: 10.1176/ajp.138.7.985.
55. Kantor S.J. Depression: when is psychotherapy not enough? Psychiatr Clin North Am. 1990;13(2):241–54.
56. Boehnlein J.K., Kinzie J.D., Ben R., et al. One-year follow-up study of posttraumatic stress disorder among survivors of Cambodian concentration camps. Am J Psychiatry. 1985;142(8):956–59. Doi: 10.1176/ajp.142.8.956.
57. Mathews M., Basil B., Evcimen H., et al. Mirtazapine-Induced Nightmares. Prim Care Companion J Clin Psychiatry. 2006;8(5):311. Doi: 10.4088/pcc.v08n0510b.
58. Dang A., Garg G., Rataboli P.V. Mirtazapine induced nightmares in an adult male. Br J Clin Pharmacol. 2009;67(1):135–36. Doi: 10.1111/j.1365-2125.2008.03305.x.
59. Felthous A.R., Wenger P.J., Hoevet R. Acute psychosis associated with dissociated sleep-wakefulness state after mirtazapine treatment. Pharmacotherapy. 2010;30(4):145e–50e. Doi: 10.1592/phco.30.4.423.
60. Menon V., Madhavapuri P. Low-Dose mirtazapine-induced nightmares necessitating its discontinuation in a young adult female. J Pharmacol Pharmacother. 2017;8(4):182–84. Doi: 10.4103/jpp.JPP_116_17.
61. Australian Adverse Drug Reactions Advisory Committee (ADRAC). Convulsions and blood dyscrasias with mirtazapine. Aust Adverse Drug React Bull. 2003;22:18–9.
62. Balon R. Bupropion and nightmares. Am J Psychiatry. 1996;153(4):579–80. Doi: 10.1176/ajp.153.4.579b.
63. Adelman L.C., Adelman J.U., Von Seggern R., et al. Venlafaxine extended release (XR) for the prophylaxis of migraine and tension-type headache: A retrospective study in a clinical setting. Headache. 2000;40(7):572–80. Doi: 10.1046/j.1526-4610.2000.00089.x.
64. Lam S.P., Zhang J., Tsoh J., et al. REM sleep behavior disorder in psychiatric populations. J Clin Psychiatry. 2010;71(8):1101–103. Doi: 10.4088/JCP.l05877gry.
65. Kumar S., Bhatia M., Behari M. Sleep disorders in Parkinson’s disease. Mov Disord. 2002;17(4):775–81. Doi: 10.1002/mds.10167.
66. Buongiorno M., Antonelli F., Cámara A., et al. Long-term response to continuous duodenal infusion of levodopa/carbidopa gel in patients with advanced Parkinson disease: The Barcelona registry. Park Relat Disord. 2015;21(8):871–76. Doi: 10.1016/j.parkreldis.2015.05.014.
67. Alvi M.Y. Unusual Effect of Fenfluramine. Br Med J. 1969;4(5677):237. Doi: 10.1136/bmj.4.5677.237-c.
68. Hooper A.C. Fenfluramine and Dreaming. Br Med J. 1971;3(5769):305. Doi: 10.1136/bmj.3.5769.305-b.
69. Mullen A., Wilson C.W., Wilson B.P. Dreaming, fenfluramine, and vitamin C. Br Med J. 1977;1(6053):70–2. Doi: 10.1136/bmj.1.6053.70.
70. Oswald I. Sleep, dreaming and drugs. Proc R Soc Med. 1969;62(2):151–53.
71. Allain H., Delahaye C., Le Coz F., et al. Postmarketing surveillance of zopiclone in insomnia: Analysis of 20,513 cases. Sleep. 1991;14(5):408–13. Doi: 10.1093/sleep/14.5.408.
72. Gaillard J.M., Phelippeau M. Benzodiazepine induced modifications of dream content: The effect of flunitrazepam. Neuropsychobiology. 1976;2(1):37–44. Doi: 10.1159/000117527.
73. Gaillard J.M., Phelippeau M. Change in the mental contents in the paradoxical stage and in stage 2 under the effects of a benzodiazepine, flunitrazepam. Encephale. 1977;3(1):35–47.
74. McGarry P.M. A double-blind study of diazepam, droperidol, and meperidine as premedication in children. Can Anaesth Soc J. 1970;17(2):157–65. Doi: 10.1007/bf03004666.
75. Burdine W.E. Diazepam in a general psychiatric practice. Am J Psychiatry. 1964;121(6):589–92. Doi: 10.1176/ajp.121.6.589.
76. Hollister L.E., Conley F.K., Britt R.H., et al. Long-term use of diazepam. JAMA. 1981;246(14):1568–70.
77. Girwood R.H. Nitrazepam nightmares. BMJ. 1973;1(5849):353. Doi: 10.1136/bmj.1.5849.353.
78. Ellingsen P.A. Double‐blind trial of triazolam 0.5 mg vs. nitrazepam 5 mg in outpatients. Acta Psychiatr Scand. 1983;67(3):154–58. Doi: 10.1111/j.1600-0447.1983.tb00336.x.
79. Schacht P., Arcieri G., Hullmann R. Safety of oral ciprofloxacin. An update based on clinical trial results. Am J Med. 1989;87(5A):98S–102S. Doi:10.1016/0002-9343(89)90033-8.
80. Bowie W.R., Willetts V., Jewesson P.J. Adverse reactions in a dose-ranging study with a new long-acting fluoroquinolone, fleroxacin. Antimicrob Agents Chemother. 1989;33(10):1778–82. Doi:10.1128/aac.33.10.1778.
81. Dang A., Kamat R., Padmanabh R. Ciprofloxacin induced nightmares in an adult patient. Indian J Psychiatry. 2008;50(4):305–6. Doi:10.4103/0019-5545.44757.
82. Dey S.K. Nightmare due to ciprofloxacin in young patients. Indian Pediatr. 1995;32(8):918–20.
83. Rawi S.M., Mourad I.M., Arafa N.M.S., et al. Effect of ciprofloxacin and levofloxacin on some oxidative stress parameters in brain regions of male albino rats. African J Pharm Pharmacol. 2011;5(16):1888–97. Doi: 10.5897/AJPP11.417.
84. Williams N.R. Erythromycin: A case of nightmares. Br Med J (Clin Res Ed). 1988;296(6616):214. Doi: 10.1136/bmj.296.6616.214-d.
85. Black R.J., Dawson T.A.J. Drug points: Erythromycin and nightmares. BMJ. 1988;296(6628):1070.
86. Møller M.E., Aziz Q., Juel J. Erythromycin induced nightmares. J Neurogastroenterol Motil. 2016;22(3):539–40. Doi: 10.5056/jnm16046.
87. Chen J.L., Brocavich J.M., Lin A.Y. Psychiatric disturbances associated with ganciclovir therapy. Ann Pharmacother. 1992;26(2):193–95. Doi: 10.1177/106002809202600210.
88. Soler Palacin P., Aramburo A., Moraga F.A., et al. Neuropsychiatric reaction induced by abacavir in a pediatric human immunodeficiency virus-infected patient. Pediatr Infect Dis J. 2006;25(4):382. Doi: 10.1097/01.inf.0000207467.39022.cc.
89. Colebunders R., Hilbrands R., De Roo A., et al. Neuropsychiatric reaction induced by abacavir. Am J Med. 2002;113(7):616. Doi: 10.1016/s0002-9343(02)01259-7.
90. Abers M.S., Shandera W.X., Kass J.S. Neurological and psychiatric adverse effects of antiretroviral drugs. CNS Drugs. 2014;28(2):131–45. Doi: 10.1007/s40263-013-0132-4.
91. Couzigou C., Seang S., Morand‐Joubert L., et al. Efficacy of etravirine for treatment of acute HIV meningoencephalitis. Clin Infect Dis. 2009;48(6):e62–5. Doi:10.1086/597109.
92. Allavena C., Le Moal G., Michau C., et al. Neuropsychiatric adverse events after switching from an antiretroviral regimen containing efavirenz without tenofovir to an efavirenz regimen containing tenofovir: A report of nine cases. Antivir Ther. 2006;11(2):263–65.
93. Teppler H., Brown D.D., Leavitt R.Y., et al. Long-term safety from the raltegravir clinical development program. Curr HIV Res. 2011;9(1):40–53.
94. Flisberg P., Rudin A., Linnér R., et al. Pain relief and safety after major surgery A prospective study of epidural and intravenous analgesia in 2696 patients. Acta Anaesthesiol Scand. 2003;47(4):457–65. Doi: 10.1034/j.1399-6576.2003.00104.x.
95. Glare P., Walsh D., Sheehan D. The Adverse Effects of Morphine : Dosing for Chronic Cancer Pain. Am J Hosp Palliat Med. 2006;23(3):229–35. Doi: 10.1177/1049909106289068.
96. Chao J. Retrospective analysis of Kadian (morphine sulfate sustained-release capsules) in patients with chronic, nonmalignant pain. Pain Med. 2005;6(3):262–65. Doi:10.1111/j.1526-4637.2005.05033.x.
97. Kalso E., Heiskanen T., Rantio M., et al. Epidural and subcutaneous morphine in the management of cancer pain: A double-blind corss-over study. Pain. 1996;67(2–3):443–49. Doi: 10.1016/0304-3959(96)03161-2.
98. Njee T.B., Irthum B., Roussel P., et al. Intrathecal morphine infusion for chronic non-malignant pain: A multiple center retrospective survey. Neuromodulation. 2004;7(4):249–59. Doi: 10.1111/j.1094-7159.2004.04210.x.
99. Ross J.R., Riley J., Taegetmeyer A.B., et al. Genetic variation and response to morphine in cancer patients: catechol-O-methyltransferase and multidrug resistance-1 gene polymorphisms are associated with central side effects. Cancer. 2008;112(6):1390–403. Doi: 10.1002/cncr.23292.
100. Riley J., Branford R., Droney J., et al. Morphine or oxycodone for cancer-related pain? A randomized, open-label, controlled trial. J Pain Symptom Manage. 2015;49(2):161–72. Doi: 10.1016/j.jpainsymman.2014.05.021.
101. Onofrio S., Vartan C.M., Nazario M., et al. The use of transdermal buprenorphine in complex regional pain syndrome: a report of two cases. J Pain Palliat Care Pharmacother. 2016;30(2):124–27. Doi: 10.3109/15360288.2016.1173756.
102. Mucci-LoRusso P., Berman B.S., Silberstein P.T., et al. Controlled-release oxycodone compared with controlled release morphine in the treatment of cancer pain. Eur J Pain. 1998;2(3):239–49.
103. Wirz S., Wartenberg H.C., Wittmann M.T.S., et al. Post-operative pain therapy with controlled release oxycodone or controlled release tramadol following orthopedic surgery: A prospective, randomized, double-blind investigation. Pain Clin. 2005;17(4):367–76. Doi: 10.1163/156856905774482733.
104. Elia N., Tramèr M.R. Ketamine and postoperative pain – A quantitative systematic review of randomised trials. Pain. 2005;113(1–2):61–70. Doi: 10.1016/j.pain.2004.09.036.
105. Laskowski K., Stirling A., McKay W.P., et al. A systematic review of intravenous ketamine for postoperative analgesia. Can J Anesth. 2011;58(10):911–23. Doi: 10.1007/s12630-011-9560-0.
106. Kiefer R.T., Rohr P., Ploppa A., et al. Efficacy of ketamine in anesthetic dosage for the treatment of refractory complex regional pain syndrome: An open-label phase II study. Pain Med. 2008;9(8):1173–201. Doi: 10.1111/j.1526-4637.2007.00402.x.
107. Blagrove M., Morgan C.J., Curran H.V., et al. The incidence of unpleasant dreams after sub-anaesthetic ketamine. Psychopharmacology (Berl). 2009;203(1):109–20. Doi: 10.1007/s00213-008-1377-3.
108. Hayashi Y., Morinaga S., Zhang J., et al. BK channels in microglia are required for morphine-induced hyperalgesia. Nat Commun. 2016;31(7):11697. Doi: 10.1038/ncomms11697.
109. Kim S.H., Price M.T., Olney J.W., et al. Excessive cerebrocortical release of acetylcholine induced by NMDA antagonists is reduced by GABAergic and α2-adrenergic agonists. Mol Psychiatry. 1999;4(4):344–52.
110. Bakht F.R., Miller L.G. Naproxen-Associated Nightmares. South Med J. 1991;84(10):1271–73. Doi: 10.1097/00007611-199110000-00027.
111. VigiBase.
112. Hamner M.B., Brodrick P.S., Labbate L.A. Gabapentin in PTSD: A retrospective, clinical series of adjunctive therapy. Ann Clin Psychiatry. 2001;13(3):141–46.
113. Berlant J., van Kammen D.P. Open-label topiramate as primary or adjunctive therapy in chronic civilian posttraumatic stress disorder: A preliminary report. J Clin Psychiatry. 2002;63(1):15–20. Doi: 10.4088/jcp.v63n0104.
114. Berlant J.L. Prospective open-label study of add-on and monotherapy topiramate in civilians with chronic nonhallucinatory posttraumatic stress disorder. BMC Psychiatry. 2004;4:1–6. Doi:10.1186/1471-244X-4-24.
115. Alderman C.P., McCarthy L.C., Condon J.T., et al. Topiramate in combat-related posttraumatic stress disorder. Ann Pharmacother. 2009;43(4):635–41. Doi: 10.1345/aph.1L578.
116. Tucker P., Trautman R.P., Wyatt D.B,. et al. Efficacy and safety of topiramate monotherapy in civilian posttraumatic stress disorder: A randomized, double-blind, placebo-controlled study. J Clin Psychiatry. 2007;68(2):201–6. Doi: 10.4088/jcp.v68n0204.
117. Turner R., Elson E. Sleep disorders. Steroids cause sleep disturbance. BMJ. 1993;29;306(6890):1477–78. Doi: 10.1136/bmj.306.6890.1477-d.
118. Clifton D., Ross M., O’Callaghan C. Psychiatric sequelae of corticosteroid use in hematology in Australia: A qualitative study. Nurs Heal Sci. 2018;20(1):125–31. Doi: 10.1111/nhs.12395.
119. Pokladnikova J., Meyboom R.H.B., Vlcek J., et al. Intranasally administered corticosteroids and neuropsychiatrie disturbances: A review of the International Pharmacovigilance Programme of the World Health Organization. Ann Allergy, Asthma Immunol. 2008;101(1):67–73. Doi: 10.1016/S1081-1206(10)60837-X.
120. Hilty D., Young J.S., Bourgeois J.A., et al. Algorithms for the assessment and management of insomnia in primary care. Patient Prefer Adherence. 2009;3:9–20.
121. Wallerstedt S.M., Brunlöf G., Sundström A., et al. Montelukast and psychiatric disorders in children. Pharmacoepidemiol Drug Saf. 2009;18(9):858–64. Doi: 10.1002/pds.1794.
122. Cereza G., Garcia Doladé N., Laporte J.R. Nightmares induced by montelukast in children and adults. Eur Respir J. 2012;40(6):1574–75. Doi: 10.1183/09031936.00092812.
123. Ward D.E., Camm A.J., Spurrell R.A. Clinical antiarrhythmic effects of amiodarone in patients with resistant paroxysmal tachycardias. Br Heart J. 1980;44(1):91–5. Doi: 10.1136/hrt.44.1.91.
124. Haffajee C.I., Love J.C., Alpert J.S., et al. Efficacy and safety of long-term amiodarone in treatment of cardiac arrhythmias: Dosage experience. Am Heart J. 1983;106(4 Pt 2):935–43. Doi: 10.1016/0002-8703(83)90019-4.
125. Ringqvist A., Bech P., Glenthøj B., et al. Acute and long-term psychiatric side effects of mefloquine: A follow-up on Danish adverse event reports. Travel Med Infect Dis. 2015;13(1):80–8. Doi: 10.1016/j.tmaid.2014.10.021.
126. Ritchie C.E., Block J., Nevin R.L. Psychiatric side effects of mefloquine: Applications to forensic psychiatry. J Am Acad Psychiatry Law. 2013;41(2):224–35.
127. Peterson A.L., Seegmiller R.A., Schindler L.S. Severe neuropsychiatric reaction in a deployed military member after prophylactic mefloquine. Case Rep Psychiatry. 2011;2011:1–4. Doi: 10.1155/2011/350417.
128. Maertens C., Wei L., Droogmans G., et al. Inhibition of volume-regulated and calcium-activated chloride channels by the antimalarial mefloquine. J Pharmacol Exp Ther. 2000;295(1):29–36.
129. Gribble F.M., Davis T.M., Higham C.E., et al. The antimalarial agent mefloquine inhibits ATP-sensitive K-channels. Br J Pharmacol. 2000;131(4):756–60. Doi: 10.1038/sj.bjp.0703638.
130. Weiss S.M., Benwell K., Cliffe I.A., et al. Discovery of nonxanthine adenosine A2Areceptor antagonists for the treatment of Parkinson’s disease. Neurology. 2003;61(11 Suppl. 6):S101–6. Doi: 10.1212/01.wnl.0000095581.20961.7d.
131. Milatovic D., Jenkins J.W., Hood J.E., et al. Mefloquine neurotoxicity is mediated by non-receptor tyrosine kinase. Neurotoxicology]. 2011;32(5):578–85. Doi: 10.1016/j.neuro.2011.01.001.
132. Savage R.L., Zekarias A., Caduff-Janosa P. Varenicline and abnormal sleep related events. Sleep. 2015;38(5):833–37. Doi: 10.5665/sleep.4686.
133. Harrison-Woolrych M., Ashton J. Psychiatric adverse events associated with varenicline: An intensive postmarketing prospective cohort study in New Zealand. Drug Saf. 2011;34(9):763–72. Doi: 10.2165/11594450-000000000-00000.
134. Fouz-Rosón N., Montemayor-Rubio T., Almadana-Pacheco V., et al. Effect of 0,5 mg versus 1 mg varenicline for smoking cessation: a randomized controlled trial. Addiction. 2017;112(9):1610–19. Doi: 10.1111/add.13855.
135. Tulloch H.E., Pipe A.L., Els C., et al. Flexible, dual-form nicotine replacement therapy or varenicline in comparison with nicotine patch for smoking cessation: A randomized controlled trial. BMC Med. 2016;14(1):1–10. Doi: 10.1186/s12916-016-0626-2.
136. Gonzales D., Hajek P., Pliamm L., et al. Retreatment with varenicline for smoking cessation in smokers who have previously taken varenicline: A randomized, placebo-controlled trial. Clin Pharmacol Ther. 2014;96(3):390–96. Doi: 10.1038/clpt.2014.124.
137. Kasliwal R., Wilton L.V., Shakir S.A. Safety and drug utilization profile of varenicline as used in general practice in England: interim results from a prescription-event monitoring study. Drug Saf. 2009;32(6):499–507. Doi:10.2165/00002018-200932060-00006.
138. Williams K.E., Reeves K.R., Billing C.B. et al. A double-blind study evaluating the long-term safety of varenicline for smoking cessation. Curr Med Res Opin. 2007;23(4):793–801. Doi: 10.1185/030079907X182185.
139. Thomas K.H., Martin R.M., Knipe D.W., et al. Risk of neuropsychiatric adverse events associated with varenicline: Systematic review and meta-analysis. BMJ. 2015;350:h1109. Doi: 10.1136/bmj.h1109.
140. Eisenberg M.J., Windle S.B., Roy N., et al. Varenicline for smoking cessation in hospitalized patients with acute coronary syndrome. 2015;133(1):21–31. Doi: 10.1161/CIRCULATIONAHA.115.019634.
141. Baker T.B., Piper M.E., Stein J.H., et al. Effects of nicotine patch vs varenicline vs combination nicotine replacement therapy on smoking cessation at 26 weeks: A randomized clinical trial. JAMA. 2016;315(4):371–79. Doi: 10.1001/jama.2015.19284.
142. Tomioka H., Wada T., Yamazoe M., et al. Ten-year experience of smoking cessation in a single center in Japan. Respir Investig. 2019;57(4):380–87. Doi: 10.1016/j.resinv.2019.01.007.
143. Chang P.H., Chiang C.H., Ho W.C., et al. Combination therapy of varenicline with nicotine replacement therapy is better than varenicline alone: A systematic review and meta-analysis of randomized controlled trials. BMC Public Health. 2015;15(1):1–8. Doi: 10.1186/s12889-015-2055-0.
144. Funk W., Jakob W., Riedl T., et al. Oral preanaesthetic medication for children: Double-blind randomized study of a combination of midazolam and ketamine vs midazolam or ketamine alone. Br J Anaesth. 2000;84(3):335–40. Doi: 10.1093/oxfordjournals.bja.a013435.
145. Alderson P.J., Lerman J. Oral premedication for paediatric ambulatory anaesthesia: a comparison of midazolam and ketamine. Can J Anaesth. 1994;41(3):221–26. Doi: 10.1007/BF03009834.
146. Liu D., Ahmet A., Ward L., et al. A practical guide to the monitoring and management of the complications of systemic corticosteroid therapy. Allergy, Asthma Clin Immunol. 2013;9(1):30. Doi:10.1186/1710-1492-9-30.
Автор для связи: О.Д. Остроумова, д.м.н., профессор кафедры клинической фармакологии и пропедевтики внутренних болезней, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет); зав. лабораторией клинической фармакологии и фармакотерапии, РНИМУ им. Н.И. Пирогова, Российский геронтологический научно-клинический центр, Москва, Россия; e-mail: ostroumova.olga@mail.ru
Адрес: 119991, Россия, Москва, ул. Трубецкая, 8, стр. 2





