Введение
Щитовидная железа (ЩЖ) синтезирует тиреоидные гормоны, участвующие в обеспечении развития организма и функционировании метаболических процессов [1]. Для синтеза тиреоидных гормонов необходим йод, поступающий в организм с пищей.
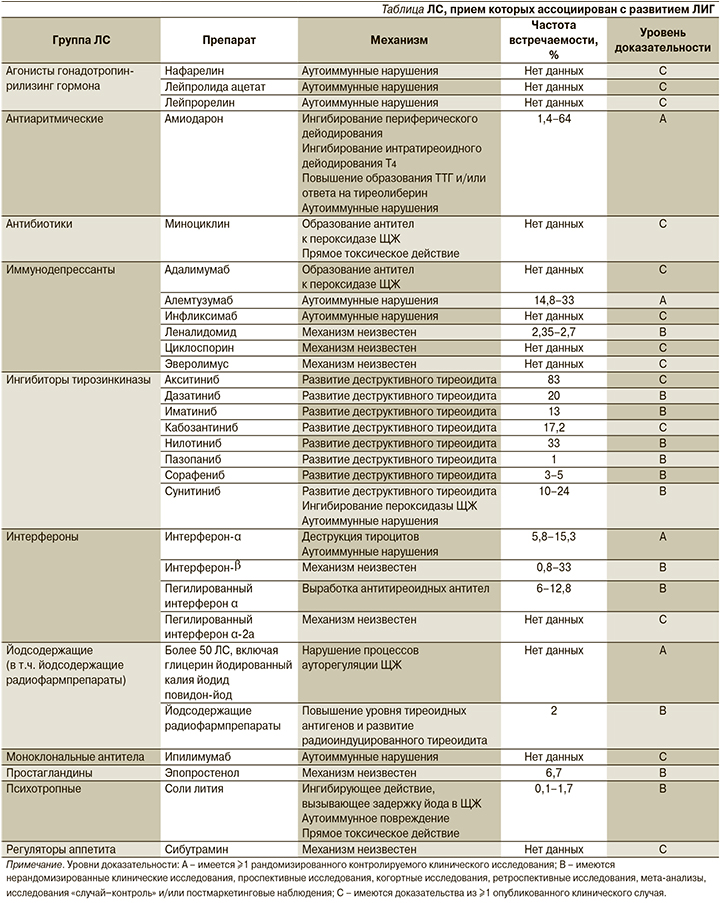
В клетках ЩЖ йод окисляется с помощью фермента пероксидазы, затем переносится белком-переносчиком тиреоглобулином к молекулам тирозола. Этот процесс называется «органификация» [2]. Норма ежедневного потребления йода составляет 150–250 мкг/сут, поступление ≥1000 мкг йода в сутки оказывает токсический эффект. Нормально функционирующая ЩЖ при поступлении избытка йода подавляет органификацию (эффект Вольфа–Чайкова), а затем в процессе ауторегуляции возобновляет ее [2]. Длительное избыточное поступление йода в организм вызывает нарушение процессов ауторегуляции ЩЖ, что проявляется развитием гиперфункции железы – гипертиреоза. Это может происходить в регионах с повышенным содержанием йода, а также в результате употребления йода в больших количествах, например, при приеме йодсодержащих лекарственных средств (ЛС). Гипертиреоз такой этиологии называется лекарственно-индуцированным (ЛИГ). Среди ЛС, вызывающих гипертиреоз, необходимо прежде всего упомянуть амиодарон, некоторые противоопухолевые средства (иммунодепрессанты, ингибиторы тирозинкиназы), йодсодержащие контрастные вещества, интерфероны и др. [2]. Перечень и механизмы действия ЛС, прием которых ассоциирован с развитием гипертиреоза, представлены в табл. 1.
Распространенность
Распространенность гипертиреоза различной этиологии в мире составляет от 0,2 до 1,3% в районах с достаточным количеством йода [1]. Отмечается, что количество случаев заболевания за последние десятилетия продолжает расти, причем число женщин с гипертиреозом в 10 раз выше числа мужчин с этой патологией, составляя от 0,5 до 2% в районах с достаточным содержанием йода [3]. Более высокая распространенность гипертиреоза встречается в странах с йододефицитом главным образом из-за возникновения токсического узлового зоба, преимущественно у пожилых пациентов, частота колеблется от 0,4 до 2% [3].
Распространенность ЛИГ не изучена. Однако известна распространенность гипертиреоза, вызванного приемом отдельных групп препаратов. Так, например, распространенность амиодарон-индуцированного гипертиреоза составляет от 1,4 до 64%, алемтузумаб-индуцированного гипертиреоза – от 14,8 до 33%, литий-индуцированного гипертиреоза – от 0,1 до 1,7% [2].
Факторы риска развития ЛИГ
К факторам риска развития гипертиреоза, индуцированного приемом ЛС, относят [2]: сопутствующую патологию ЩЖ (например, тиреоидит Хашимото, гемитиреоидэктомия), наличие патологии ЩЖ в анамнезе (например, послеродовая дисфункция ЩЖ и др.), отягощенный семейный анамнез по заболеваниям ЩЖ, женский пол.
Также выявлены отдельные факторы риска развития ЛИГ для некоторых групп ЛС/отдельных ЛС, представленные в соответствующих разделах данного обзора.
Патофизиологические механизмы ЛИГ
В настоящее время установлены не все механизмы развития ЛИГ, среди основных выделяют [2]:
- ингибирование процессов дейодирования в организме (на уровне ЩЖ, на периферическом уровне);
- аутоиммунные нарушения (в т.ч. образование антитиреоидных антител);
- повышение образования тиреотропного гормона (ТТГ) и/или избыточный ответ на тиреолиберин;
- прямое токсическое действие – деструкция тироцитов (развитие деструктивного тиреоидита).
Рассмотрим подробнее отдельные группы ЛС, способные вызывать ЛИГ (табл. 1).
Агонисты гонадотропин-рилизинг гормона
Существуют описания клинических случаев возникновения гипертиреоза, индуцированного приемом агонистов гонадотропин-рилизинг гормона – нафарелина, лейпролида ацетата, лейпрорелина. Во всех случаях отмечалось повышение титра антитиреоидных антител [4–6]. Только в одном случае потребовалось назначение терапии метимазолом [6], в остальных случаях после отмены препарата эутиреоз был достигнут самостоятельно [4–6].
Амиодарон
Амиодарон – антиаритмическое средство, используемое в терапии суправентрикулярных и желудочковых нарушений ритма, на 37,5% своей массы состоит из йода (75 мг йода в таблетке массой 200 мг) и имеет структуру, схожую с тиреоидными гормонами [2, 7, 8]. Амиодарон-индуцированный гипертиреоз чаще встречается в районах с дефицитом йода, соотношение мужчин и женщин – 3:1 [1]. Его распространенность составляет 1,4–64%, а время, необходимое для развития гипертиреоза, вызванного приемом амиодарона, варьируется от 1 до 24 месяцев с момента начала терапии [2].
К факторам риска развития амиодарон-индуцированного гипертиреоза помимо общих факторов риска развития ЛИГ относят возраст менее 62 лет, индекс массы тела менее 21 кг/м2 и/или сопутствующий зоб [2].
Существует несколько возможных механизмов развития амиодарон-индуцированного гипертиреоза. Тип 1 чаще встречается среди пациентов с ранее существовавшими или имеющимися факторами риска развития патологии ЩЖ (аутоиммунные тиреоидные заболевания, многоузловой зоб и др.). Тип 2 возникает в результате деструктивного воспалительного тиреоидита, развивающегося из-за избытка циркулирующих тиреоидных гормонов в кровотоке. Тип 3 – смешанный, включает механизмы развития типов 1 и 2 [2, 9].
Для дифференциальной диагностики амиодарон-индуцированного гипертиреоза 1-го и 2-го типов используют такие лабораторные показатели, как уровень поглощения радиоактивного йода ЩЖ, уровень интерлейкина-6 в сыворотке, уровень антител против тиреоглобулина, пероксидазы щитовидной железы или рецептора тиреосвязывающего глобулина. Кроме того, возможно дифференцировать эти типы с помощью допплерографии ЩЖ. Нормальное или повышенное поглощение радиоактивного йода ЩЖ, несмотря на высокую экскрецию йода с мочой, нормальный или незначительно повышенный уровень интерлейкина-6, высокий уровень тиреоид-ассоциированных антител и повышенная васкуляризация при допплерографии – признаки амиодарон-индуцированного гипертиреоза 1-го типа. Напротив, низкое поглощение радиоактивного йода, низкий уровень интерлейкина-6, отсутствие антител к структурам ЩЖ и низкий уровень васкуляризации будут связаны с развитием амиодарон-индуцированного гипертиреоза 2-го типа. Помимо вышеперечисленных методов дифференциальной диагностики возможно использование сцинтиграфии с 99mTc-метокси-изобутил-изонитритом. В процессе проведения процедуры радиофармпрепарат накапливается клетками с большим количеством митохондрий, а некротические и апоптотические клетки не могут его захватить из-за разрушенного потенциала их митохондриальной мембраны [8].
Способ и длительность лечения амиодарон-индуцированного гипертиреоза зависят от механизма его развития. При условии отмены амиодарона у пациентов с типом 1 гипертиреоз проходит в течение 6–9 месяцев из-за длительной элиминации амиодарона. Пациенты с типом 2 могут достигнуть эутиреоза в течение 3–5 месяцев [8]. Поскольку амиодарон-индуцированный гипертиреоз часто сочетается с сердечно-сосудистой патологией и ассоциирован с высокой заболеваемостью и смертностью, необходимо достигнуть эутиреоза как можно быстрее, особенно пациентам с нарушенной функцией левого желудочка и пожилым больным. Для терапии амиодарон-индуцированного гипертиреоза типа 1 применяются тионамиды с/без использования натрия или калия перхлората, блокирующие синтез тиреоидных гормонов и истощающие интратиреоидные запасы йода. Эти ЛС неэффективны для пациентов с амиодарон-индуцированным гипертиреозом 2-го типа, для лечения которых необходимо использовать стероидные гормоны (противовоспалительный и мембраностабилизирующий эффекты). Для терапии гипертиреоза смешанного типа используются комбинации метимазола, натрия или калия перхлората и стероидов [8–10].
В Федеральных клинических рекомендациях по диагностике и лечению токсического зоба (2014) [11] имеются отдельные положения, касающиеся профилактики, диагностики и лечения амиодарон-индуцированной гиперфункции щитовидной железы. Так, на фоне терапии амиодароном оценку функции ЩЖ рекомендуется проводить перед назначением амиодарона через 1 и 3 месяца после начала лечения и далее с интервалом в 3–6 месяцев. При развитии амиодарон-индуцированного гипертиреоза необходимо уточнение его типа: 1-го (йодиндуцированный) или 2-го (деструктивный тиреоидит). Решение о прекращении приема амиодарона на фоне развившегося тиреотоксикоза должно быть принято индивидуально на основании консультации кардиолога и наличия или отсутствия альтернативной эффективной антиаритмической терапии. Тиамазол должен быть использован для лечения 1-го типа амиодарон-индуцированного тиреотоксикоза, глюкокортикостероиды – 2-го типа амиодарон-индуцированного тиреотоксикоза. При выраженном амиодарон-индуцированном тиреотоксикозе, в случае когда отсутствует ответ на монотерапию тиамазолом или глюкокортикоидами (в зависимости от типа), а также в ситуациях, когда тип заболевания не может быть точно определен, показано назначение комбинации тиреостатиков и глюкокортикостероидов. У пациентов с амиодарон-индуцированным тиреотоксикозом в отсутствие эффекта от комбинированной терапии тиамазолом и преднизолоном необходимо выполнение тиреоидэктомии.
Антибиотики
Имеется несколько описаний клинических случаев развития гипертиреоза на фоне приема миноциклина – полусинтетического антибиотика тетрациклинового ряда. Механизмы развития миноциклин-индуцированного гипертиреоза связывают с прямым цитотоксическим действием препарата, а также образованием антитиреоидных антител [2, 12]. Интраоперационно у таких пациентов обнаруживается «черная» щитовидная железа, что связано с накоплением пигментных глобул в апикальной части фолликулярных клеток [13].
Иммунодепрессанты
Гипертиреоз развивается примерно у 1/3 пациентов без предшествовавшей патологии ЩЖ в результате терапии алемтузумабом. В ряде небольших исследований показано, что риск развития гипертиреоза, вызванного приемом иммунодепрессантов, повышен у пациентов с уже имеющейся патологией ЩЖ. Кроме того, существует вероятность рецидива гипертиреоза, лимфоцитарного (аутоиммунного) или послеродового тиреоидита [14]. Также возможно развитие гипертиреоза, ассоциированного с приемом других иммунодепрессантов: адалимумаба, инфликсимаба, леналидомида, циклоспорина, эверолимуса, хотя рандомизированных контролируемых исследований ни для одного из этих препаратов не проводилось (описаны отдельные клинические случаи развития гипертиреоза, ассоциированного с приемом этих препаратов) [2].
В рекомендациях Европейской тиреоидологической ассоциации (ЕТА) 2019 г. [14], посвященных дисфункциям ЩЖ при проведении иммунодепрессивной терапии, рекомендована оценка функции ЩЖ каждые 3 месяца в течение 4 лет после последней дозы алемтузумаба. Кроме того, перед началом иммуновосстановительной терапии рекомендуется определять уровень ТТГ, а при его отклонении – трийодтиронина (Т3) и тироксина (Т4).
Ингибиторы тирозинкиназы
Гипертиреоз могут вызывать некоторые ингибиторы тирозинкиназы, в число которых входят, к примеру, сунитиниб и сорафениб. По данным одного из исследований, сорафениб-индуцированный гипертиреоз был диагностирован у 23,9% пациентов [2]: у них обнаружены сниженный уровень ТТГ и повышены уровни свободных Т3 и Т4, гипертиреоз сменялся гипотиреозом в среднем через 2,3 месяца [2]. В одном из ретроспективных исследований гипертиреоз, вызванный приемом сунитиниба, развился у 4 из 15 пациентов [2]. Также имеется ретроспективное исследование, по данным которого при терапии ингибиторами тирозинкиназы второго поколения (иматиниб, нилотиниб, дазатиниб) у 45% пациентов развились нарушения функции ЩЖ, в число которых вошел и гипертиреоз. У трех пациентов в крови были обнаружены антитиреоидные антитела [15]. Кроме перечисленных ингибиторов тирозинкиназы гипертиреоз может развиваться при приеме акситиниба, кабозантиниба, пазопаниба [2].
Интерфероны
Гипертиреоз, индуцированный приемом интерферона-α, может проявляться как аутоиммунное повреждение ЩЖ или как деструктивный воспалительный тиреоидит [2]. Для дисфункции ЩЖ при приеме интерферона-α типично развитие гипертиреоза, который постепенно переходит в гипотиреоз. Также существуют описания клинических случаев, в которых на фоне приема пегилированных интерферонов и рибавирина у больных были обнаружены антитела к пероксидазе ЩЖ и бифазный характер нарушения (гипер- и гипотиреоз) [2]. Риск развития гипертиреоза, вызванного интерфероном-α, выше у некурящих пациентов, пациентов женского пола, европеоидной расы, а также у пациентов с наличием антител к пероксидазе ЩЖ, с патологией ЩЖ в анамнезе. По литературным данным, гипертиреоз чаще развивается у больных, принимающих интерферон-α в качестве терапии гепатита С, чем гепатита В [2].
Моноклональные антитела
Существует описание клинического случая возникновения гипертиреоза у пациентки, принимавшей ипилимумаб для терапии меланомы. В данном случае для восстановления эутиреоза применяли йопаноевую кислоту и метимазол [16].
Простагландины
Имеются данные о возможности возникновения гипертиреоза у пациентов с легочной артериальной гипертензией, для лечения которой применяли эпопростенол [17, 18]. При обследовании таких пациентов отмечалось отсутствие аутоантител к клеткам ЩЖ, развитие диффузного зоба, а также гомогенное поглощение препарата при проведении сцинтиграфии ЩЖ.
Психотропные ЛС
Длительное лечение препаратами лития приводит к развитию гипертиреоза гораздо реже, чем к возникновению гипофункции ЩЖ, однако необходимо учитывать вероятность его развития у таких пациентов. Точный механизм развития литий-индуцированного гипертиреоза неизвестен, но наиболее вероятные – это выработка аутоантител к клеткам ЩЖ, прямое токсичное действие препаратов лития с развитием деструктивного тиреоидита, а также индукция ими задержки йода в ЩЖ. При этом после прекращения терапии препаратами лития восстанавливается эутиреоз [17]. Пациентам, принимающим соли лития, рекомендуется проводить клинический и биохимический мониторинг функции ЩЖ с интервалом в 6 месяцев. Особое внимание на тиреотоксический эффект этих препаратов необходимо обращать пациентам с маниакально-депрессивным расстройством, т.к. развитие гипертиреоза значительно ухудшает их состояние [19].
Регуляторы аппетита
В литературе имеется описание одного случая развития гиперфункции ЩЖ и тиреоидита у пациента, принимавшего сибутрамин, однако в данном случае имела место передозировка препарата [2].
Йодсодержащие препараты (в т.ч. йодсодержащие радиофармпрепараты)
Имеются данные о возможности возникновения гипертиреоза на фоне приема ЛС с высоким содержанием йода (глицерин йодированный, калия йодид, повидон-йод и т.д.). Всего группа йодсодержащих препаратов, способных индуцировать гипертиреоз, содержит более 50 наименований [2]. Существует описание клинического случая возникновения субклинического гипертиреоза у пациента после коронарографии с йодсодержащим контрастом [2].
В Федеральных клинических рекомендациях по диагностике и лечению токсического зоба (2014) [11] для терапии йодиндуцированного тиреотоксикоза рекомендуется использовать β-адреноблокаторы в виде монотерапии или в комбинации с тиамазолом.
Клиническая картина, диагностика и дифференциальная диагностика ЛИГ
Состояния и симптомы, ассоциированные с развитием ЛИГ, отличаются разнообразием. Среди них в литературе описаны [2] следующие: нарушение аппетита, фибрилляция предсердий, фотофобия, диплопия, нарушение менструальной функции, снижение толерантности к физической нагрузке, экзофтальм, мышечная слабость, утомляемость, нарушение моторики кишечника, диарея, нарушение терморегуляции, потливость, нарушение фертильности, когнитивные нарушения, раздражительность, тахикардия, периферические отеки, нарушение сна, инсомния, увеличение ЩЖ, тремор, колебания веса.
Для диагностики ЛИГ помимо сбора анамнеза и осмотра необходимо установление факта приема ЛС, которые могут вызывать гипертиреоз, а также определение содержания ТТГ, Т3 и Т4 в сыворотке. Особенности диагностики амиодарон-индуцированного гипертиреоза указаны в соответствующем разделе.
Для проведения успешного лечения ЛИГ необходимо дифференцировать с гипертиреозом, возникающим при различных заболеваниях и состояниях. К ним относятся [2] хориокарцинома, наличие функционально активных метастазов рака ЩЖ, болезнь Грейвса, тиреоидит, токсический узловой зоб, болезнь Пламмера, ТТГ-продуцирующая аденома, гипофизарная резистентность к гормонам ЩЖ.
Лечение пациентов с ЛИГ
Для успешного лечения гипертиреоза, вызванного приемом ЛС, желательно его отменить. При выборе терапии ЛИГ необходимо учитывать патофизиологию процесса, происходящего в ЩЖ.
В основном используются следующие группы лекарственных препаратов: β-адреноблокаторы, блокаторы кальциевых каналов, глюкокортикостероиды, препараты йода, тионамиды (метимазол, пропилтиоурацил и др.). В случае развития резистентности к проводимой медикаментозной терапии возможно проведение тиреоидэктомии [2, 20]. Лечение амиодарон-индуцированного гипертиреоза зависит от его типа и подробно описано в соответствующем разделе статьи.
Профилактика
Профилактика ЛИГ включает [2]:
- отказ от использования ЛС, способных вызывать гипертиреоз (по возможности);
- предварительный скрининг на наличие патологии ЩЖ перед началом лечения препаратами, прием которых ассоциирован с развитием ЛИГ;
- своевременную коррекцию нарушений функции ЩЖ;
- употребление адекватного количества селена;
- информирование пациентов о возможности развития симптомов заболевания и необходимости обращения к врачу для своевременной коррекции;
- применение альтернативных схем лечения пациентов с наличием факторов риска развития ЛИГ.
Рекомендации Американской тиреоидологической ассоциации (2016) [21] включают общее положение по профилактике ЛИГ. Так, согласно данным рекомендациям, пациентам, принимающим препараты, способные вызывать гипертиреоз, необходимо проводить клиническое обследование и определение гормонов ЩЖ с интервалом в 6 месяцев.
Заключение
Поскольку количество случаев ЛИГ в настоящее время продолжает расти, для профилактики, своевременного выявления и коррекции этой патологии ЩЖ необходимо повышение информированности врачей разных специальностей о существовании такого побочного эффекта у ряда ЛС. В случае необходимости назначения препаратов, способных вызывать развитие ЛИГ, необходимо перед началом их приема оценить функцию ЩЖ, а также мониторировать ее состояния в процессе лечения.



