Лекарственные поражения являются одной из актуальных проблем современной медицины, что обусловлено в первую очередь лавинообразным ростом числа новых лекарственных препаратов, внедряемых в клиническую практику, широким и часто бесконтрольным использованием биологически активных добавок (БАДов) и средств нетрадиционной медицины.
Печень является основным барьером на пути фактически всех чужеродных веществ, попадающих в организм человека. Большинство лекарственных средств (ЛС) хорошо всасывается в желудочно-кишечном тракте и поступает в печень, где биотрансформируется в основном под действием различных изоферментов цитохрома Р450. Дополнительные этапы метаболизма предполагают связывание с глюкуронидом или сульфатом. Образующиеся гидрофильные метаболиты переносятся транспортными белками, находящимися на мембранах гепатоцитов, в плазму или желчь и выводятся через почки или желудочно-кишечный тракт. Изменения активности печеночных ферментов (наследственный полиморфизм генов, заболевания печени, индукция или ингибирование под действием других лекарств) могут приводить к повышению или снижению концентрации ЛС в плазме и, соответственно, к появлению нежелательных реакций или ухудшению эффективности.
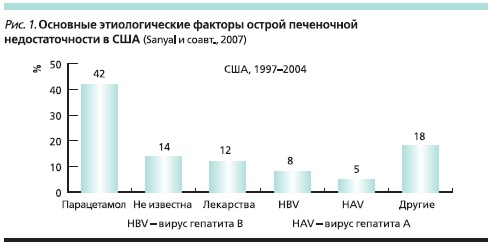
В свою очередь ЛС могут оказывать токсическое действие на печень. В частности, лекарственная гепатотоксичность (ЛГТ) является одной из основных причин острой печеночной недостаточности [1]. M. Russo и соавт. [2] проанализировали причины острой печеночной недостаточности в США (1990–2002), потребовавшей трансплантации печени. У 15 % больных наблюдалась ЛГТ, связанная с применением парацетамола (почти в половине случаев), а также изониазида, пропилтиоурацила, фенитоина и вальпроевой кислоты. В другом аналогичном исследовании в США лекарства были причиной острой печеночной недостаточности более чем в половине случаев, главным образом вследствие отравления парацетамолом (рис. 1).
Варианты лекарственного поражения печени
Около 1000 ЛС как хорошо изученных, так и новых могут вызывать гепатотоксические реакции [3]. Спектр ЛГТ включает практически все известные морфологические и клинические варианты поражений печени – от небольшого повышения активности аминотрансфераз до фульминантного гепатита и декомпенсированного цирроза печени [4]. В целом в результате приема лекарств наиболее тяжелые формы поражения печени (фульминантная печеночная недостаточность) наблюдаются в 0,0001–0,001 % случаев, но характеризуются высокой летальностью (до 70 %), умеренные или тяжелые формы – в 0,01–1 % случаев (летальность до 10 %), легкие – в 0,1–10,0 % (как правило, протекают бессимптомно). При этом в большинстве случаев (более 90 %) имеет место острое поражение печени, хронические формы встречаются значительно реже (менее чем в 10 %) [26]. Следует учитывать, что один препарат способен вызывать разные типы гепатотоксичности. Немногие ЛС оказывают дозозависимое гепатотоксическое действие, чаще встречаются идиосинкразические реакции, малопредсказуемые и возникающие с определенной задержкой (от 5 до 90 дней) после приема препарата. Подобные реакции чаще развиваются среди женщин (около 70 % случаев).
Классическим примером дозозависимой ЛГТ является действие парацетамола. Под влиянием изоферментов цитохрома Р450 он превращается в N-ацетил-р-бензохинонимин (NAPQI), который связывается с глутатионом. В терапевтических дозах парацетамол не оказывает токсического действия на печень, однако при приеме высоких доз препарата (более 15 г) запасы глутатиона в печени могут истощаться. В этом случае NAPQI более чем на 70–90 % связывается с макромолекулами гепатоцитов, вызывая их некроз и апоптоз. Гепатотоксичность парацетамола возрастает при одновременном приеме алкоголя и лекарственных препаратов, метаболизирующихся с помощью ферментов системы цитохрома Р450 (например, фенитоина, рифампицина и др.). Определенная дозозависимость гепатотоксичности свойственна и некоторым другим лекарственным веществам, в т. ч. амиодарону (стеатогепатит), циклофосфамиду (некроз гепатоцитов), циклоспорину (холестаз), метотрексату (некроз гепатоцитов, фиброгенез), ниацину (ишемический некроз), оральным контрацептивам (аденомы печени) [5].
Большинство ЛС в терапевтических дозах сравнительно редко вызывают поражение печени. Частота идиосинкразических реакций составляет от 1 : 1000 до 1 : 100 тыс. [5]. Выделяют различные механизмы развития поражения печени.
Лекарственные вещества являются сравнительно небольшими молекулами и обычно не вызывают иммунного ответа. Однако они могут связываться с ферментами, а образующиеся комплексы мигрируют на поверхность гепатоцита и индуцируют образование антител или цитотоксические Т-клеточные реакции (рис. 2) [6, 7]. Вторичный цитокиновый ответ вызывает воспаление и дополнительную гепатотоксичность, опосредованную нейтрофилами, которые выделяют протеазы и реактивные кислородные радикалы [8]. Иммуноопосредованное повреждение печени сопровождается апоптозом, который приводит к гибели клеток под действием внутриклеточных каспаз [9].
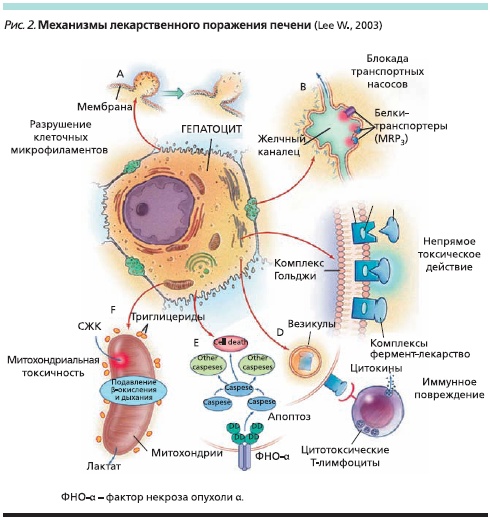
Некоторые лекарственные вещества связываются с протеинами, транспортирующими соли желчных кислот. В результате нарушается ток желчи и развивается холестаз. При накоплении токсичных желчных кислот возможно вторичное повреждение гепатоцитов, в частности, за счет апоптоза.
Еще одним возможным механизмом ЛГТ является нарушение функции митохондрий за счет подавления β-окисления и/или дыхательных ферментов [10]. При этом нарушается метаболизм свободных жирных кислот, а в клетках печени откладываются триглицериды. Кроме того, развивается лактацидоз и образуются кислородные радикалы, вызывающие дальнейшее повреждение митохондриальной ДНК. При применении ЛС также может развиваться стеатогепатит, характеризующийся образованием крупных капель жира в клетках печени и воспалительными изменениями ее ткани.
В развитии ЛГТ могут принимать участие различные клетки. Например, активация звездчатых клеток приводит к фиброзу, а миграция макрофагов вызывает формирование гранулем. Химиотерапевтические ЛС повреждают эндотелиальные клетки синусоидов с развитием веноокклюзионной болезни [11].
Выделяют различные варианты идиосинкразических лекарственных реакций со стороны печени, которые во многом определяются механизмом ее поражения (см. таблицу).
Таблица.Идиосинкразические лекарственные реакции со стороны печени [Lee].
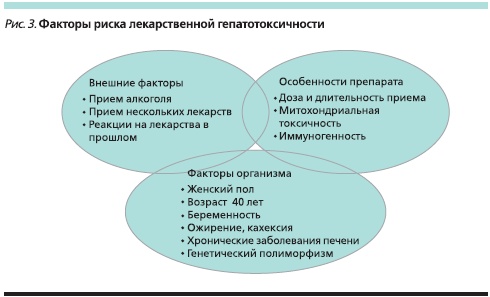
Лекарственное поражение печени возможно при любом приеме ЛС у каждого пациента, однако выделяют ряд факторов, которые ассоциируются с повышенной частотой ЛГТ (рис. 3).
Диагностика ЛГТ
Возможность ЛГТ необходимо обсуждать для всех пациентов с дисфункцией печени. Особенно большое значение имеет тщательное изучение анамнеза, причем следует анализировать применение не только рецептурных, но и безрецептурных ЛС, в т. ч. растительного происхождения, с учетом увеличения частоты сообщений о гепатотоксичности лекарственных трав [12, 13]. Каких-либо специфических клинических или морфологических признаков лекарственного поражения печени не существует, поэтому в первую очередь следует исключить другие причины ее дисфункции, например вирусную инфекцию, злоупотребление алкоголем и т. п. (хотя их наличие не исключает возможности присоединения ЛГТ). Установить причинно-следственную связь между применением определенного препарата и изменениями печени часто бывает трудно, т. к. больные нередко одновременно получают различные ЛС. Критерием такой связи может служить хронологическая зависимость (появление симптомов через 5–90 дней после первого приема препарата), однако наблюдается и отсроченная реакция печени на прием ЛС. Так, при анализе данных 366 больных ЛГТ в Японии показано, что поражение печени в четверти случаев развивалось через 90 и более дней после начала приема препарата (рис. 4) [27].

Среди других возможных признаков причинно-следственной связи между приемом ЛС и поражением печени рассматривают улучшение ее состояния в течение нескольких недель после прекращения лечения, наличие факторов риска (пожилой возраст, употребление алкоголя), отсутствие других причин поражения печени, предшествующий опыт применения соответствующих ЛС, реакция на повторный прием лекарств [5, 14]. Дополнительные трудности в установлении лекарственной природы поражения печени обусловлены отсутствием специфических диагностических тест-систем, нередко и наличие предшествовавшего хронического заболевания печени. В целом диагноз лекарственного поражения печени обоснован, если в связи с приемом ЛС выявляется повышение активности АЛТ или уровня прямого билирубина (> 2 норм) либо одновременное повышение уровней АСТ, щелочной фосфатазы (ЩФ) и общего билирубина (> 2 норм хотя бы для одного из этих показателей).
Профилактика и лечение ЛГТ
Лечение ЛГТ предполагает немедленную отмену препаратов, которые могли быть ее причиной. В легких случаях этого обычно достаточно для восстановления функции печени. При тяжелых аллергических реакциях, как правило, назначают кортикостероиды, хотя в контролируемых исследованиях их эффективность не изучалась. При наличии холестатического поражения печени часто используют урсодезоксихолевую кислоту, S-аденозил-Lметионин. Специфических антидотов, которые могли бы быть использованы для лечения тяжелых гепатотоксических реакций, не существует. Исключение составляет N-ацетилцистеин, являющийся донатором свободных SH-групп. Его введение, особенно в первые 8–10 часов после передозировки парацетамола, позволяет предотвращать тяжелое поражение печени и быстро снижать активность аминотрансфераз [15]. Полное восстановление функции печени обычно происходит через 1–3 недели. В США с 1976 по 1985 г. было зарегистрировано около 11 тыс. случаев предположительной передозировки парацетамола, большинство из которых были умышленными. Из 2540 больных, которым был своевременно введен N-ацетилцистеин, умерли только 11 [16].
С учетом потенциальной тяжести лекарственных гепатотоксических реакций большое значение имеет их профилактика.
Можно выделить два аспекта этой проблемы:
1) идентификация ЛГТ в предрегистрационных исследованиях новых лекарственных веществ и в клинической практике;
2) контроль нежелательных реакций со стороны печени у конкретных больных.
Опыт последних десятилетий показал, что тщательное изучение ЛС в доклинических и клинических исследованиях не позволяет избегать появления на рынке гепатотоксичных препаратов. Примером могут служить тровафлоксацин (фторхинолон), троглитазон (тиазолидиндион) и бромфенак (нестероидное противовоспалительное средство). При их изучении в клинических исследованиях не были зарегистрированы тяжелые гепатотоксические реакции, однако они наблюдались в клинической практике (в т. ч. с летальным исходом), что заставило отказаться от применения этих препаратов. Следует отметить, что сама по себе гепатотоксичность еще не является основанием для отказа в регистрации нового лекарственного препарата. Большее значение имеют тяжесть нежелательных реакций со стороны печени, несоответствие между риском и пользой ЛС и/или наличие альтернативных препаратов того же класса, характеризующихся меньшей токсичностью. Например, троглизатон был изъят с рынка после регистрации росиглитазона и пиоглитазона. Оценка потенциальной гепатотоксичности (активности аминотрансфераз, ЩФ, γ-глутамилтранспептидазы [ГГТП], уровня билирубина) является обязательным компонентом изучения нового препарата в предрегистрационных исследованиях. Критерием значимой гепатотоксичности обычно служит частое или выраженное (более чем в 8 раз по сравнению с верхней границей нормы) повышение активности аминотрансфераз, которое может сочетаться с гипербилирубинемией. Однако, чтобы выявить хотя бы один случай клинически значимого лекарственного поражения печени, число обследованных больных должно примерно в 3 раза превышать частоту соответствующей реакции [5]. Если частота идиосинкразической реакции составляет 1 : 10 тыс., в исследования следует включать по крайней мере 30 тыс. больных. В то же время в исследованиях III фазы обычно принимают участие примерно 3000 пациентов, соответственно, вероятность регистрации подобных реакций невелика. Кроме того, условия применения ЛС в обычной практике отличаются от клинических исследований (более широкий круг пациентов, различные дозы и длительность лечения, сопутствующая терапия), что может способствовать развитию ранее не зарегистрированных побочных эффектов. Большое значение для оценки ЛГТ имеет контроль нежелательных явлений, наблюдаемых при применении новых ЛС в широкой практике после их регистрации. Фармацевтические компании собирают и регулярно анализируют подобную информацию (сообщения врачей, фармацевтов и потребителей, описания случаев в литературе, послерегистрационные клинические исследования). Однако следует учитывать, что доля регистрируемых нежелательных явлений может быть небольшой. Например, во Франции фиксируется менее 6 % нежелательных реакций со стороны печени [17].
Большое значение для профилактики серьезных гепатотоксических реакций имеют регулярный контроль активности аминотрансфераз (например, каждый месяц в течение первых 6 месяцев) и своевременная отмена препарата при нарушении печеночных проб. Однако в амбулаторных условиях добиться строгого выполнения подобной рекомендации сложно. Кроме того, серьезные нежелательные явления могут возникать внезапно. Если их риск низкий, то регулярный контроль активности печеночных ферментов у большого числа пациентов не оправдан с экономической точки зрения.
Возможным подходом к предупреждению ЛГТ является одновременное применение препаратов, оказывающих защитное действие на ткань печени. Подобная тактика обоснованна, если врач вынужден назначать средства с известной гепатотоксичностью и не всегда может отменять их даже при нарушении печеночных проб. Примерами могут служить изониазид, антиретровирусные средства и противоопухолевые химиопрепараты. Изониазид продолжает широко использоваться для лечения туберкулеза, хотя среди 15–20 % больных во время лечения наблюдается повышение активности аминотрансфераз, а у 1 на 1000 пациентов развивается тяжелый некроз печеночной ткани [18]. Гепатотоксичность является характерным осложнением высокоактивной антиретровирусной терапии с использованием ингибиторов протеазы вируса иммунодефицита человека [19]. Риск ее повышается при одновременном инфицировании вирусами гепатита В и С. Высокой гепатотоксичностью обладают и многие противоопухолевые средства, которые могут вызывать любые известные изменения печени, включая некроз, стеатоз, фиброз, холестаз и поражение сосудов [20]. Гепатотоксические эффекты являются одной из главных причин снижения доз химиотерапевтических препаратов и отсроченных циклов химиотерапии – оба эти фактора ухудшают результаты лечения.
Для лечения и профилактики заболеваний печени широко используют т. н. гепатопротекторы. Данный термин в значительной мере дискредитирован тем, что к этой группе относят различные препараты, польза которых вызывает большие сомнения. Доводом в пользу их применения нередко служат заявления производителя о тех или иных фармакологических свойствах и малоубедительные результаты неконтролируемых исследований.
Обнадеживающие результаты были получены в клинических исследованиях S-аденозил-L-метионина (адеметионина). D. Santini и соавт. [22] провели открытое исследование с целью оценки эффективности адеметионина среди больных злокачественными опухолями с впервые развившейся гепатотоксичостью на фоне химиотерапии. Медиана возраста больных составила 63 года (33–76 лет). Критерием гепатотоксичности считали впервые выявленное увеличение активности аминотрансфераз, по крайней мере в 2,5 раза по сравнению с верхней границей нормы. Если активность аминотрансфераз превышала норму более чем в 4 раза, больных в исследование не включали, а очередной курс химиотерапии откладывали. При наличии гепатотоксичности перед началом последующего цикла химиотерапии больным назначали адеметионин внутрь по 400 мг 2 раза в сутки. Лечение продолжали в интервалах между циклами химиотерапии. Эффективность терапии адеметионином анализировали на основании динамики активности печеночных ферментов через 1 и 2 недели после начала лечения. Кроме того, сравнивали активность АСТ и АЛТ через 2 недели лечения и максимальную их активность при последующих курсах химиотерапии. Вторичными конечными точками служили эффективность адеметионина у пациентов с метастазами в печень и частота отсроченных курсов химиотерапии (в связи с гепатотоксичностью).
Через 1 и 2 недели после начала лечения адеметионином активность АСТ и АЛТ значительно снижалась. Благоприятный эффект препарата на уровни печеночных ферментов сохранялся при последующих курсах химиотерапии. У больных с печеночными метастазами гепатотоксичность характеризовалась более высокими уровнями аминотрансфераз, чем у пациентов без метастатического поражения печени. Однако частота ответа на лечение адеметионином (снижение активности печеночных ферментов более чем на 30 % по сравнению с исходными уровнями) была одинаковой у больных с метастазами и без них (70 и 75 % соответственно; р = 0,926). Полученные данные свидетельствуют о том, что метастазы в печень не влияют на результаты лечения препаратом. Снижение дозы химиопрепаратов в связи с гепатотоксичностью потребовалось только одному больному, а последующие циклы были отсрочены у трех пациентов. Существенных побочных эффектов или аллергических реакций не зарегистрировано.
ЛГТ обычно усиливается при последующих циклах химиотерапии, поэтому выявленное улучшение функции печени нельзя считать спонтанным. Более того, применение адеметионина позволяло проводить запланированную химиотерапию при минимальной частоте случаев снижения дозы или отсроченных курсов.
В другом исследовании 105 больных, получавших адъювантную химиотерапию по программе FOLFOX IV (фторурацил, оксалиплатин) после резекции толстой кишки по поводу рака, были разделены на две подгруппы, одна получала адеметионин (n = 60), другая (n = 45) − плацебо. В группе адеметионина к окончанию химиотерапии средняя медиана активности АСТ (p < 0,001), АЛТ (p = 0,003) и ГГТП (p = 0,002), а также уровня билирубина сыворотки (p = 0,04) были достоверно ниже по сравнению с группой плацебо. Кроме того, в группе адеметионина достоверно реже отмечались случаи гепатотоксичности (p = 0,002), соответственно, необходимость прерывания курсов химиотерапии (p < 0,0001) и снижения доз химиотерапевтических препаратов (p = 0,031) [28].
Важную роль в развитии ЛГТ при химиотерапии играют реактивные метаболиты и свободные радикалы. Электрофильные метаболиты связываются с белками и липидами мембран и вызывают их перекисное окисление. В результате развиваются структурные и функциональные нарушения, которые в конечном итоге приводят к гибели клеток и повышению активности аминотрансфераз. Адеметионин – это основной эндогенный донор метильных групп, участвующий в реакциях трансметилирования (рис. 5) [23, 24]. Он также является источником цистеина, необходимого для синтеза глутатиона. Последний выполняет ряд важных функций, включая нейтрализацию свободных кислородных радикалов, обмен тиосульфида, хранение и перенос цистеина, конъюгацию и нейтрализацию реактивных электрофильных метаболитов при биотрансформации ксенобиотиков. Недостаточность глутатиона приводит к повышению восприимчивости к окислительному стрессу. В печеночных клетках его недостаток вызывает также инактивацию аденозил-метионинсинтетазы, что служит причиной дальнейшего истощения запасов глутатиона в печени. Адеметионин оказывает стабилизирующее действие на клеточные оболочки и повышает содержание глутатиона. Эффективность его доказана при многих формах повреждения печени как в экспериментальных, так и клинических исследованиях.

S. Nei и соавт. [25] в 3-месячном рандомизированном контролируемом двойном слепом исследовании изучали эффективность адеметионина в дозе 400 мг/сут в профилактике гепатотоксичности циклоспорина у 72 мужчин с псориазом. Повышение активности аминотрансфераз и признаки холестаза наблюдались у 15 из 36 больных, получавших монотерапию циклоспорином, и отсутствовали у всех больных, которым иммунодепрессант назначали в сочетании с адеметионином. Более того, последний предупреждал повышение окислительного стресса под действием циклоспорина.
Одним из препаратов адеметионина на российском лекарственном рынке является Гептор (Верофарм). Доказана биоэквивалентность Гептора оригинальному препарату адеметионина.
Многие “гепатопротекторы” представляют собой биологически активные добавки или средства растительного происхождения. Для разрешения их применения не требуется тщательно спланированных клинических исследований, которые являются единственным методом подтверждения эффективности и безопасности лекарственных веществ. Кроме того, абсолютная безопасность лекарственных трав явно преувеличивается. Установлено, что многие из них вызывают серьезные нежелательные явления, включая гепатотоксичность [21].
Может ли фармакотерапия предупреждать токсические изменения печени, развивающиеся под действием некоторых лекарственных веществ? Сегодня сложно ответить утвердительно или отрицательно на этот вопрос, т. к. соответствующие исследования проводились в основном в экспериментальных условиях.
Заключение
Совершенствование системы доклинической и клинической апробации лекарственных средств и изучение механизмов гепатотоксичности не привело к снижению ее частоты. В будущем вряд ли удастся решить эту проблему, учитывая непредсказуемость гепатотоксических реакций и возможность их развития при применении, по сути дела, любых ЛС. Большое значение имеет настороженность врача, т. к. своевременная отмена препарата позволяет избегать более тяжелого поражения печени. При лечении заведомо гепатотоксичными ЛС (например, противотуберкулезными, противоопухолевыми и антиретровирусными) перспективно изучение профилактического эффекта некоторых препаратов, оказывающих благоприятное влияние на функцию печени, в частности S-аденозил-L-метионина и урсодезоксихолевой кислоты.
Информация об авторах:
Абдурахманов Джамал Тинович – доктор медицинских наук, профессор кафедры терапии и профболезней
ГОУ ВПО “Первый МГМУ им. И.М. Сеченова” Минздравсоцразвития РФ.
E-mail: abdjamal@mail.ru;
Моисеев Сергей Валентинович – доктор медицинских наук, профессор кафедры терапии и профессиональных болезней
ГОУ ВПО “Первый МГМУ им. И.М. Сеченова” МинздравсоцразвитияРФ.
E-mail: clinpharm@mtu-net.ru



