Алкогольная болезнь печени (АБП) – одна из наиболее старых форм поражения печени из известных человечеству. Сбраживание напитков существует по крайней мере в течение 10 тыс. лет, и почти столько же долго регистрируются заболевания печени, связанные с их употреблением. Алкоголь остается наиболее частой причиной болезней печени во всем мире [1]. В США 4,7 % лиц отвечают критериям злоупотребления алкоголем и 44 % всех случаев смерти от заболеваний печени также связаны с алкоголем [2]. В России доля смертности, ассоциированная с алкоголем, достигает 30 % у мужчин и 17 % у женщин. По этой причине Российская Федерация ежегодно теряет до 500 тыс. трудоспособных граждан [3].
Метаболизм этанола может проходить двумя путями: окислительным и неокислительным. Окислительный путь реализуется при помощи микросомальной этанол-окисляющей системы в цитохроме Р4502Е1 (CYP2E1). Окислительный путь может генерировать свободные радикалы, которые вызывают повреждение тканей. Неокислительный путь метаболизма этанола связан с деградацией ацетальдегида до ацетата, который является одним из субстратов синтеза жирных кислот через преобразование в цикле трикарбоновых кислот и пентозофосфатном цикле (рис. 1). В конечном итоге неокислительный путь метаболизма этанола приводит к избыточному накоплению триглицеридов в ткани печени. В связи с этим сегодня принято считать, что нарушение липидного метаболизма и окислительный стресс являются клинико-биохимическим и морфологическим субстратами АБП, что в свою очередь детерминирует подходы к терапии этой патологии [4]. В настоящее время популярной является двухступенчатая модель патогенеза АБП. На первой ступени происходит нарушение липидного метаболизма, приводящее к чрезмерному отложению липидов в печени и развитию стеатоза. На второй ступени влияние генетических факторов (полиморфизм CYP2E1, полиморфизм алкогольдегидрогеназы и ацетальдегиддегидрогеназы) в сочетании с неблагоприятными факторами внешней среды (избыточное содержание жира и железа в пище, действие ксенобиотиков и т. д.) путем инициации оксидативного стресса в сочетании с выработкой воспалительных цитокинов и дисбалансом адипокина определяет развитие хронического воспаления в ткани печени [5].
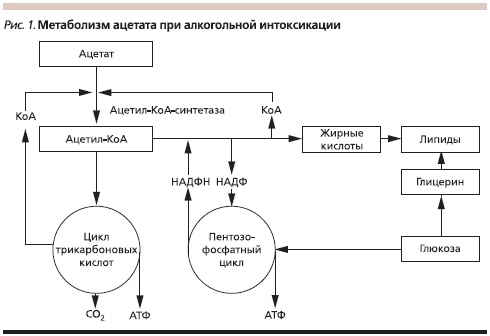
В понятие “алкогольная болезнь печени” сейчас принято включать стеатоз, алкогольный гепатит и цирроз печени. Стеатоз печени развивается у 90 % всех лиц, которые употребляют более 60 г алкоголя в день [6]. Алкогольный гепатит может развиваться у 10–30 % пациентов, злоупотребляющих алкоголем [7]. Длительное употребление 40 г этанола в день увеличивает риск возникновения цирроза печени до 30 % [8].
Главным фактором риска развития АБП является количество алкоголя, но связь эта не представляется совершенно ясной [9]. Очевидная ассоциация прослеживается между количеством алкоголя и развитием цирроза [10]. Риск развития цирроза увеличивается при употреблении свыше 60 г алкоголя в сутки у мужчин и более 20 г алкоголя в сутки у женщин в течение 10 лет и более [11]. Употребление этанола вне приема пищи увеличивает риск развития алкогольной болезни печени в 2,7 раза в сравнении с лицами, которые употребляют спиртные напитки во время приема пищи [12]. Женщины в 2 раза более чувствительны к токсическому действию алкоголя, чем мужчины [13]. Важным фактором, предрасполагающим к развитию АБП, является генетическая предрасположенность. Дети алкоголиков имеют значительно более высокий уровень алкогольной зависимости, чем дети здоровых лиц [14]. В эпидемиологических исследованиях у монозиготных близнецов отмечали более высокую распространенность алкогольного цирроза, чем у дизиготных близнецов [15]. Вирус гепатита С значительно усиливает повреждение печени у пациентов, злоупотребляющих алкоголем [16].
Диагностика алкогольной болезни печени базируется на стандартных клинических, лабораторных и инструментальных методах. Мы приводим рекомендации Американского колледжа гастроэнтерологии по лабораторной диагностике АБП [17]:
- Ферменты сыворотки крови: АСТ > АЛТ, повышение уровней щелочной фосфатазы и γ-глутамилтранспептидазы (ГГТП).
- Метаболические нарушения: гипергликемия, гипертриглицеридемия, повышение уровней калия и магния.
- Функция печени: уровень альбумина, протромбиновое время, уровень билирубина чаще нормальны.
- Общая кровь: легкая анемия, число тромбоцитов и лейкоцитов увеличено.
Следует обратить внимание на значимость изменений показателей углеводного и липидного обмена при АБП. Для верификации стеатоза в настоящее время могут использоваться ультразвуковое исследование, компьютерная и магнитно-резонансная томография [18]. “Золотым стандартом” диагностики АБП по-прежнему остается морфологическое исследование биоптатов. Морфологические признаки алкогольного повреждения печени могут включать стеатоз, лобулярное воспаление, перипортальный фиброз, тельца Мэллори, ядерную вакуолизацию, пролиферацию желчных протоков и признаки цирроза печени [19]. Американская ассоциация по изучению болезней печени (AASLD) для определения прогноза заболевания рекомендует использовать индекс Maddrey, который вычисляется по следующей формуле: 4,6 × (протромбиновое время, с + билирубин, ммоль/л) / 17. Тридцатидневная выживаемость при индексе Maddrey < 32 составляет 80–100 %, при показателе > 32 – только 50 % [20].
Принципы лечения АБП печени включают достижение абстиненции, коррекцию пищевого статуса, нормализацию изменений липидного метаболизма, борьбу с продуктами оксидативного стресса, антицитокиновую и противовоспалительную терапию.
Абстиненция является главной целью ведения пациентов с АБП. Абстиненция сопровождается значительным и быстрым улучшением клинического состояния пациентов на всех стадиях заболевания [21]. Реально абстиненция весьма труднодостижима. В США возобновляют употребление алкоголя в течение первого года абстиненции от 67 до 81 % пациентов [22]. Современные консенсусы рекомендуют привлечение психотерапевтов для достижения абстиненции [20].
Отчетливая мальнутриция (недостаточность питания), сопровождающаяся нарушениями белково-минерального обмена и гиповитаминозами, наблюдается у большинства больных АБП, причем выраженность мальнутриции коррелирует с тяжестью АБП [23]. В связи с этим нормализация энергетического и белкового обмена является приоритетной задачей лечения. Влияние пищевого режима, содержащего 2000 ккал/сут, по лечебному действию сопоставимо с применением 40 мг преднизолона в сутки [24].
Нарушение липидного метаболизма, сопровождающееся изменениями мембран гепатоцитов, накопление продуктов оксидативного стресса обусловливают применение эссенциальных фосфолипидов (ЭФЛ) в терапии метаболических нарушений при АБП. Фосфатидилхолин, являющийся основным компонентом препарата Эссенциале, действует как антиоксидант, регулирует активность CYP2E1, восстанавливает активность S-аденозилметионинсинтетазы, снижает активацию звездчатых клеток и синтез коллагена [25]. В последнее время указывается на способность ЭФЛ изменять метаболизм простагландинов и арахидоновой кислоты и снижать воспаление в печени. Детальный механизм действия ЭФЛ представлен на рис. 2.
Рисунок 2. Механизм действия эссенциальных фосфолипидов при заболеваниях печени.
Классической работой, демонстрирующей эффективность ЭФЛ, является крупное рандомизированное двойное слепое проспективное плацебо-контролируемое исследование, выполненное в США C.S. Lieber и соавт. на ветеранах войн, которые исходно употребляли около 500 мл крепких алкогольных напитков в сутки. Исследование проводилось в течение 2 лет. Все пациенты были рандомизированы в две группы: 1-я – принимала фосфатидилхолин, 2-я группа получала плацебо. В группе пациентов, лечившихся фосфатидилхолином, зарегистрировано более значительное снижение уровней АЛТ, АСТ и билирубина, чем в группе плацебо [26].
В недавней работе, выполненной E. Sas и соавт. (2011) и представленой на 46-м Международном конгрессе Европейской ассоциации по изучению печени в апреле 2011 г. в Берлине, представлены результаты проведенного с 2004 по 2010 г. рандомизированного проспективного слепого клинического исследования влияния полиненасыщенных фосфолипидов (Эссенциале форте) на пациентов с АБП. Было обследовано 86 пациентов с неосложненной АБП, получавших адекватную терапию в виде диеты и отказа от алкоголя. Из них 56 больных принимали Эссенциале форте в дневной дозе, содержащей 1368 мг фосфатидилхолина, а 30 – получали витамин Е в дозе 400 МЕ/сут. Длительность лечения составила 6 месяцев. В группе, лечившейся Эссенциале форте, зарегистрировано более значительное позитивное изменение уровней всех печеночных ферментов, глюкозы крови и инсулинорезистентности в сравнении с контрольной группой: показатели АЛТ снизились в 2,4 раза (p < 0,04), АСТ – в 2,5 (p < 0,02), ГГТП – в 1,9 раза (p < 0,03). Результаты биопсии печени и теста ФиброМакс показали, что у пациентов с АБП, принимавших Эссенциале форте, прогрессирование фиброза печени было значительно меньшим, чем в контрольной группе (Фибромакс-F1 и -F3 соответственно; р < 0,05) [27].
В нашей стране широко применяется препарат ЭФЛ Эссенциале Н, который содержит в своем составе фосфолипиды, экстрагированные из бобов сои. Эссенциале Н можно назначать как парентерально, так и перорально. Парентерально Эссенциале Н назначают в дозе 5–20 мл (1–4 ампулы) в сутки в течение 10–30 дней. Одновременно или после внутривенного курса рекомендуют начать прием препарата внутрь в дозе 3–6 капсул в сутки в 3 приема. Длительность лечения и кратность курсов устанавливаются индивидуально, их необходимая минимальная продолжительность составляет 3 месяца.
На фоне окислительного стресса возникает дефицит восстановленного глутатиона, S-аденозилметионина, необходимого для реакции трансметилирования и поддержания антиоксидантного потенциала клетки. Поэтому одним из важных направлений патогенетического лечения АБП является применение S-аденозилметионина (Гептрал). Некоторые аспекты действия этого препарата представлены на рис. 3.
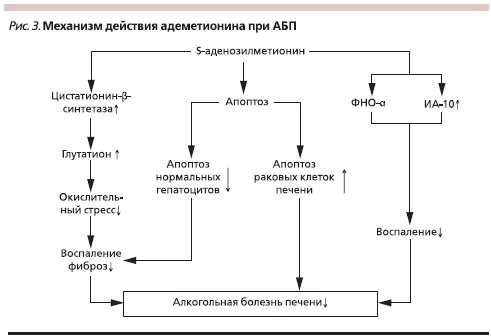
Наиболее доказательным подтверждением эффективности Гептрала при АБП является рандомизированное плацебо-контролируемое двойное слепое многоцентровое исследование J.M. Mato и соавт. Авторы в течение 2 лет наблюдали 123 пациента с циррозом печени, 62 из которых получали адеметионин в дозе 1200 мг в день, 61 – плацебо. После исключения из результатов исследования пациентов с циррозом печени класса С по Чайльд–Пью выживаемость была достоверно более высокой в группе, получавшей адеметионин (p = 0,025) [28].
Гептрал доступен в парентеральной и таблетированной формах – для острых ситуаций и поддерживающего лечения. В первые 2–3 недели лечения Гептрал назначают по 400–800 мг/сут внутривенно капельно или внутримышечно. На втором этапе в качестве поддерживающей терапии принимают по 800–1600 мг препарата внутрь (между приемами пищи) 2–4 недели и более.
На крупнейших международных конференциях, состоявшихся в 2011 г., – 46-м Международном конгрессе EASL в Берлине и DDW в Чикаго, активно обсуждалась роль кишечной микрофлоры в патогенезе АБП. Современная точка зрения состоит в том, что алкоголь повышает проницаемость кишечника для бактериальных эндотоксинов, которые, проникая в печень, активизируют иммунологические реакции, стимулирующие развитие воспаления и фиброза. В одной из работ, активно цитируемых в последнее время, авторы обнаружили выраженный дисбиоз кишечника со снижением содержания бифидобактерий, лактобацилл и энтерококков у больных АБП. Применение пробиотиков приводило к отчетливому снижению уровней АЛТ, АСТ, ГТТП и общего билирубина [29]. Одним из пробиотиков, состав и технологические характеристики которого отвечают современным требованиям, является Линекс, назначаемый после еды по 2 капсулы 3 раза в день. Длительность курса лечения является индивидуальной и варьируется от 2–3 недель до 3–4 месяцев.
Для терапии пациентов с выраженным алкогольным гепатитом с индексом Maddrey < 32 AASLD в 2010 г. рекомендовало в отсутствие противопоказаний назначение преднизолона в дозе 40 мг/сут в течение 28 дней с последующим стандартным снижением дозы препарата до его отмены в течение 2 недель [20]. AASLD считает, что при наличии противопоказаний к лечению кортикостероидными гормонами для снижения активности гепатита может применяться пентоксифиллин в дозе 400 мг перорально 3 раза в день в течение 4 недель.
В заключение необходимо подчеркнуть, что чрезмерное потребление алкоголя и АБП являются серьезной проблемой для России, решение которой требует значительных усилий со стороны общественности и врачей.
Информация об авторах:
Маев Игорь Вениаминович – доктор медицинских наук, профессор, заведующий кафедрой пропедевтики
внутренних болезней и гастроэнтерологии ГОУ ВПО “Московский государственный
медико-стоматологический университет” Минздравсоцразвития РФ.
Тел. 8 (495) 683-98-58, e-mail: proped@mail.ru;
Цуканов Владислав Владимирович – доктор медицинских наук, профессор, руководитель гастроэнтерологического
отделения, Учреждение РАМН НИИ медицинских проблем Севера СО РАМН.
Тел. 8 (391) 212-53-63, e-mail: gastro@impn.ru;
Самсонов Алексей Андреевич – доктор медицинских наук, профессор кафедры пропедевтики внутренних болезней
и гастроэнтерологии ГОУ ВПО “Московский государственный медико-стоматологический
университет” Минздравсоцразвития РФ.
Тел. 8 (495) 683-98-58, e-mail: aleksey.samsonov@gmail.com;
Тонких Юлия Леонгардовна – кандидат медицинский наук, ведущий научный сотрудник гастроэнтерологического
отделения, Учреждение РАМН НИИ медицинских проблем Севера СО РАМН.
Тел. 8 (391) 228-06-56, e-mail: tjulia@bk.ru;
Васютин Александр Викторович – младший научный сотрудник гастроэнтерологического
отделения, Учреждение РАМН НИИ медицинских проблем Севера СО РАМН.
E-mail: alexander@kraslan.ru;
Кучерявый Юрий Александрович – кандидат медицинских наук, доцент кафедры пропедевтики
внутренних болезней и гастроэнтерологии ГОУ ВПО “Московский государственный
медико-стоматологический университет” Минздравсоцразвития РФ.
Тел. 8 (495) 683-98-58, e-mail: proped@mail.ru



